替罗非班对接受PCI治疗的ACS患者炎性反应及预后的影响
2013-11-07梁海峰杨明韩凌高亢陈萍李晓红马铮
梁海峰 杨明 韩凌 高亢 陈萍 李晓红 马铮
血小板活化和炎性反应贯穿于急性冠脉综合征(ACS)发生发展的整个过程,构成其发病的主要机制。ACS患者斑块的破裂与不稳定性与炎性反应直接相关[1]。有研究显示,炎性反应与血小板活性之间存在一定的联系,炎性因子可以刺激前列腺素合成TXA2,促进血小板活化和聚集[2]。ⅡbⅢa受体拮抗剂替罗非班通过阻断GPⅡbⅢa受体与vwF因子或纤维蛋白原α链上的RGD序列的结合,阻断血小板聚集的最终通路,是强效的血小板抑制剂。本研究以合并不同炎性反应水平的ACS患者为对象,观察替罗非班对炎性因子和临床预后的影响,探索其抗血小板外的作用。
1 资料与方法
1.1 一般资料 2009年10月至2012年6月我院收治的ACS患者,包括:不稳定型心绞痛(unstable angina pectoris,UAP)、非ST段抬高心肌梗死(non-ST segment elevation myocardial infarction,NSTEMI)及ST段抬高心肌梗死(ST segment elevation myocardial infarction,STEMI)。ACS患者根据是否合并全身炎性反应综合征(SIRS)分为SIRS组(A组),对照组(B组)。2组患者再随机分为SIRS替罗非班组(A1组),SIRS非替罗非班组(A2组);对照替罗非班组(B1组),对照非替罗非班组(B2组)。4组患者在年龄、性别比、相关疾病等方面比较差异均无统计学意义(P >0.05)。B1、B2组UAP患者比例高于A1、A2组(P <0.05)。见表1。

表1 4组临床资料比较
1.2 入选与排除标准
1.2.1 入选标准:参照中华医学会心血管病分会不稳定型心绞痛与急性心肌梗死的诊断标准及ACC/AHA不稳定型心绞痛、非ST段抬高型心肌梗死的指南[3],符合ACS诊断标准,行介入治疗并签署知情同意书患者。
1.2.2 排除标准:①年龄小于20岁或大于80岁;②血小板计数<100×109/L或>300×109/L;③应用华法令治疗;④消化性溃疡患者;⑤1年内脑卒中史;⑥收缩压持续>180 mm Hg(1 mm Hg=0.133 kPa),舒张压持续 >110 mm Hg。
1.3 SIRS诊断标准 根据ACCP/SCCM1991年芝加哥 SIRS诊断标准:(1)体温 >38℃ 或 <36℃;(2)呼吸频率 >20次/min,或动脉血二氧化碳分压(PaCO2)<32 mm Hg;(3)外周血白细胞>12×109/L或<4.0×109/L或幼稚杆状细胞>10%;(4)心率>90次/min;符合SIRS标准2项及以上为SIRS。
1.4 治疗方法 4组患者均给予标准的冠心病二级预防及PCI治疗。A1、B1组:阿司匹林+氯吡格雷+替罗非班;A2、B2组:阿司匹林+氯吡格雷。A1、B1组患者在导丝通过病变后即刻给予替罗非班 10 μg·kg-1·min-1冠脉内注射,并以0.15 μg·kg-1·min-1持续泵点 48 h。
1.5 检测指标 分别于给药前及给药后2 d(24~48 h),留取标本测定 mPAR(ADP 诱导)、hs-CRP、sCD40L、MMP-9,所有患者随访30 d,了解临床终点事件发生情况。
1.5.1 mPAR 测定:采用含 3.18%枸橼酸钠 0.3 ml的真空采血管肘静脉取血2.7 ml(1∶9抗凝)轻柔混匀;1 000 r/min离心10 min,提取富血小板血浆,剩余血液再以3 000 r/min离心30 min取出上层贫血小板血浆;贫血小板血浆血小板计数为(10~20)×109/L,用贫血小板血浆调整富血小板血浆至(200~300)×109/L;将富血小板血浆及贫血小板血浆各200 μl分别加入到2支比浊管内,应用SC-2000四通道全血小板聚集仪将富血小板血浆及贫血小板血浆的透光度调节为90和10;在富血小板血浆中加搅拌棒,比浊管置37℃温育3 min;搅拌10~20 s后,将 1/10体积腺苷二磷酸(ADP,终浓度为10 μmol/L)诱导剂加入贫血小板血浆中(ADP由CAYMAN公司提供),记录聚集时间不少于3 min,采用比浊法测定。
1.5.2 Hs-CRP测定:采用超敏乳胶增强散射比浊法经全自动生化分析仪测定。
1.5.3 MMP-9、sCD40L 测定:采用酶联免疫吸附法(ELISA)测定。
1.6 观察终点 下述指标作为出现临床事件:(1)血小板及出血:①血小板减少[标准:应用替罗非班24 h内,血小板计数<100×109/L或下降≥25%;血小板计数(50~100)×109/L为轻度,<50×109/L为重度];②出血[TIMI轻度及以上出血;标准:(A)TIMI重度出血:血红蛋白下降>50 g/L或红细胞压积下降>0.15;颅内出血;心包填塞;(B)TIMI轻度出血:已知部位出血:30 g/L<血红蛋白下降<50 g/L或红细胞压积下降>0.1;未知部位出血:40 g/L<血红蛋白下降<50 g/L或0.12<红细胞压积下降<0.15;不知出血部位;自发性肉眼血尿、呕血或咯血、血红蛋白下降<30 g/L;(C)无显著意义出血并发症:未达到上述标准的出血并发症];(2)急性或亚急性支架内血栓;(3)新发心肌梗死;(4)全因死亡;(5)再发心肌缺血需要再次入院及需经介入或手术干预者。
1.7统计学分析应用SPSS 16.0统计软件,计量资料以±s表示,计量资料进行方差齐性检验。组间比较采用单因素方差分析,组内不同时间点比较采用配对t检验;计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 4组患者mPAR比较 术前,A1、A2组患者mPAR均明显高于B1、B2组(P <0.01)。术后2 d,A2组患者mPAR较术前降低,但差异无统计学意义(P>0.05);其余3组患者mPAR较术前降低(P <0.01)。术后2 d,A1组患者mPAR明显低于A2组(P <0.01),B1组血小板聚集率低于B2组(P <0.01),术后,A1、B1组间差异无统计学意义(P >0.05)。见表2。
表24组患者mPAR比较%,±s

表24组患者mPAR比较%,±s
注:与术前比较,*P <0.01;与A1组比较,#P <0.01;与 A2组比较,△P <0.01;与 B1 组比较,☆P <0.01
2 d A1组(n=64) 50±14 10±5组别 术前 术后*A2组(n=64) 48±14 45±13#B1组(n=110) 39±9# 10±4*B2组(n=110) 38±9△ 35±9*△☆
2.2 4组患者hs-CRP比较 术前,A1、A2组患者hs-CRP高于B1、B2组(P <0.01)。术后2 d,4组患者 hs-CRP均较术前降低(P <0.05或 <0.01),A1组患者低于 A2 组(P <0.05)。见表3。
表34组患者hs-CRP比较ng/ml,±s

表34组患者hs-CRP比较ng/ml,±s
注:与术前比较,*P <0.05,#P <0.01;与 A1 组比较,△P <0.05,☆P <0.01;与 A2 组比较,▲P <0.01
组别 术前(ng/ml) 术后2 d(ng/ml)A1 组(n=64) 8.7 ±3.2 3.6 ±1.9#A2 组(n=64) 7.7 ±2.8 5.9 ±3.8*△B1 组(n=110) 3.6 ±2.3☆ 2.5 ±1.0#☆B2 组(n=110) 3.3 ±2.7▲ 2.8 ±1.5#▲
2.3 4组患者sCD40L比较 术前,A1、A2组患者 sCD40L高于 B1、B2组(P <0.01)。术后 2 d,A1、B1 组患者 sCD40L 均较术前降低(P <0.05)。术后 2 d,A1组患者低于 A2组(P < 0.01),B1组低于 B2组(P <0.05)。见表4。
表44组患者sCD40L比较ng/ml,±s

表44组患者sCD40L比较ng/ml,±s
注:与术前比较,*P <0.05,#P <0.01;与 A1 组比较,△P <0.01;与 A2 组比较,☆P <0.01;与 B1 组比较,▲P <0.05
2 d A1 组(n=64) 9.6 ±5.1 7.4 ±4.0组别 术前 术后#A2 组(n=64) 9.4 ±4.4 9.0 ±4.0△B1 组(n=110) 5.1 ±2.8 △ 4.3 ±2.7*△B2 组(n=110) 5.0 ±2.6☆ 5.2 ±2.5☆▲
2.4 4组患者MMP-9比较 术前,A1、A2组患者MMP-9高于B1、B2组(P <0.01)。术后2 d,A1组患者 MMP-9水平较术前降低(P <0.01),B2组术后较术前升高(P <0.05)。术后2 d,A1组患者低于A2组(P <0.01)。见表5。
表54组患者MMP-9的比较ng/ml,±s

表54组患者MMP-9的比较ng/ml,±s
注:与术前比较,*P <0.05,#P <0.01;与 A1 组比较,△P <0.01;与 A2 组比较,☆P <0.01
2 d A1组(n=64) 12±5 10±4组别 术前 术后#A2组(n=64) 12±6 12±5△B1组(n=110) 9±4△ 8±4△B2组(n=110) 9±5☆ 9±4*☆
2.5 4组患者临床终点事件比较 术后30 d,A2组缺血事件的发生率高于 A1、B1、B2组(P <0.05)。A1、A2组出血事件的发生率高于B1、B2组(P <0.05)。因数量较少,4组患者全因死亡率不适合统计分析。见表6。
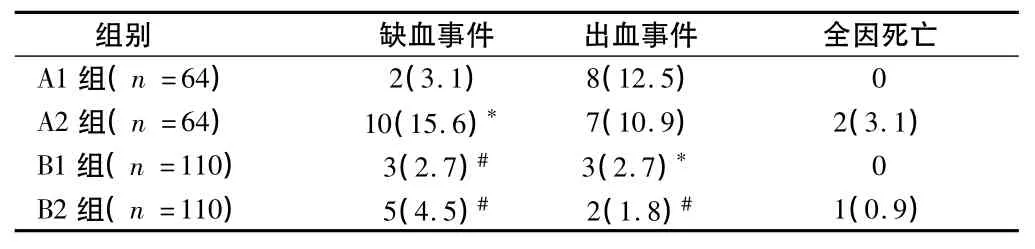
表6 4组患者临床终点事件比较 例(%)
3 讨论
炎性反应和急性血栓形成在ACS的发病、演变过程中扮演了重要的角色[4,5]。长期以来,阿司匹林联合氯吡格雷的双重抗血小板治疗被认为是ACS患者抗血小板治疗的金标准[6]。然而,在双重抗血小板治疗下仍有近20%接受PCI的患者会发生再发缺血或血栓事件[7]。如何识别这些高危人群,进行合理的抗炎和抗血小板治疗是问题的关键。
SIRS是1991年美国胸科医师学会和危重病医学会(ACCP/SCCM)联席会议上提出的一个危重症医学概念[8],其本质是机体对原发打击因素做出的过度炎性反应[9,10]。本研究中,四组患者冠心病类型比较显示,非SIRS组,UAP占有较高比例,而NSTEMI及STEMI所占比例较低,这一结果提示,病情严重的患者炎性反应明显。同时与对照组相比,合并SIRS的ACS的患者中有相当部分患者mPAR处于较高水平。因此,对于这些患者,有必要给予更强的抗血小板治疗。新型抗血小板药物替罗非班属于非肽类ⅡbⅢa受体拮抗剂,它通过阻断GPⅡbⅢa受体与vwF因子或纤维蛋白原α链上的RGD序列的结合,竞争性抑制急性血栓的形成,从而阻断血小板聚集的最终共同通路[11,12],有着强大的抗血小板作用。一些重要试验研究(RESTORE、PRISM-PLUS)结果显示,替罗非班可以有效的减少ACS患者 PCI术后缺血事件的发生[13,14]。研究显示,替罗非班除强大的抗血小板作用外,还可以降低患者体内hs-CRP的水平[15]。本研究中,PCI术后2d,A1组hs-CRP明显低于A2组,有统计学意义;B1组hs-CRP低于B2组,但无统计学意义,提示随着患者体内炎性反应水平的增强,替罗非班降低hs-CRP的作用也较为明显。
可降解细胞外基质的MMPs在心血管重塑中扮演着非常重要的角色[16,17]。Luttun 等[18]研究发现 MMP-9 对动脉粥样硬化形成、斑块破裂具有促进作用。组织病理学分析也证明了在易损斑块中MMPs是增加的[19],MMPs与动脉粥样硬化斑块的破裂和由此导致的冠心病急性缺血事件的发生有关。本研究显示,术前,合并SIRS的ACS患者MMPs-9水平明显高于对照组,提示炎性反应与冠状动脉斑块的不稳定存在内在的联系。术后2 d,A1组患者MMP-9水平较术前降低,提示替罗非班在一定程度上可以降低MMP-9的水平,这可能与血小板促进MMP-9分泌有关[20]。本研究中,B2组术后MMP-9较术前升高。这一结果与PCI过程中,球囊的扩张和冠脉支架的置入导致斑块进一步破裂,激活 MMP-9升高有关,与 Higo等[21,22]报道一致。
近年来,人们逐渐认识到血小板也是一种炎性细胞,活化的血小板可以分泌大量的炎症介质,其中最重要的是sCD40L。它是导致ACS血栓形成的炎性介质[23]。当血小板受到较高的切应力时,CD40就从内部转移到血小板表面。血液中95%以上的sCD40L由激活的血小板产生[24]。从本研究中我们可以看到,合并SIRS的ACS患者mPAR与sCD40L同时升高。血小板源sCD40L的产生和它的血栓形成有关活动也被最终的与血小板GPIIB/IIIA联系起来。血小板聚集导致GPⅡbⅢa受体介导的由外向内的信号通路活化,引起的促炎症物质如TGF-β、CD62p释放,导致血管炎症。替罗非班对GPⅡbⅢa受体的抑制,阻止了可溶性sCD40L从激活的血小板脱落,从而阻断信号通路活化,抑制炎性反应的发生[25]。此外,sCD40L使基质金属蛋自酶(MMPS)活性增强,降解细胞外基质,从而引起粥样硬化斑块的不稳定[26]。因此,sCD40L水平明显增高与冠脉不良事件的发生相关[27]。笔者认为,从SIRS理论角度讲,替罗非班降低ACS患者体内炎性反应的部分作用可能通过抗血小板后改善ACS患者的缺血打击而实现。这一作用在高度炎性反应的危重缺血患者身上表现的更加明显。对4组患者随访结果显示,合并SIRS的ACS患者出血不良事件的发生率明显高于对照组,特别值得一提的是,在合并SIRS的ACS患者中,血小板水平普遍低于不合并SIRS的患者,这可能与SIRS导致患者血小板功能高度激活从而引起血小板耗竭有一定的关系,不能完全归因于替罗非班的不良反应。而在出血患者中,消化道出血占有较高的比例,而在合并SIRS的患者组内,替罗非班的应用并没有增加出血风险。在临床工作中对于这部分患者应该在改善缺血,抑制炎性反应的同时加强出血的预防治疗。PCI围手术期给予替罗非班治疗后30 d随访显示,对于合并SIRS的患者,替罗非班可以明显降低30 d缺血事件的发生率,而对于未合并SIRS患者,替罗非班未带来明显获益。所以合并SIRS的ACS患者更容易从替罗非班的应用中获益。因伦理问题,他汀类药物的同时应用在一定程度上影响了本研究结果的直观性。尽管如此,本研究为我们今后替罗非班的个体化应用提供了试验依据。替罗非班抑制炎性反应的机制和抗血小板作用共同构成了其改善急性冠脉综合征患者预后的基础。
1 贾利敏,黄立新.C反应蛋白的临床应用及预测价值.实用心脑肺血管病杂志,2006,14:761-762.
2 Cipollone F,Patrignani P,Greco A.Differential suppression of thromboxane biosynthesis by indobufen and aspirin patients with unstable angina.Circulation,1997,96:1109-1116.
3 梁海峰,杨明,韩凌,等.替罗非班对急性冠脉综合征患者围手术期血小板和C反应蛋白的影响.中国微循环,2009,13:528-531.
4 2007年中华医学会心血管病学分会.不稳定性心绞痛和非ST段抬高心肌梗死诊断与治疗指南.中华心血管病杂志,2007,35:295-304.
5 vander Zee PM,Biró E,Ko Y,et al.P-selectin-and CD63-exposing platelet micro-particles reflect platelet activation in peripheral arterial disease and myocardial infarction.Clin Chem,2006,52:657-664.
6 Libby P,Ridker PM,Maseri A.Inflammation and atherosclerosis.Circulation,2002,105:1135-1143.
7 Gurbel PA,Bliden KP,Guyer K,et al.Platelet reactivity in patients and recurrent events post-stenting:results of the PREPARE POST-STENTING Study.J Am Coll Cardiol,2005,46:1820-1826.
8 钟榕宽,何志裕,陆东风.氯吡格雷联合阿司匹林治疗不稳定型心绞痛的疗效观察.广西医学,2009,22:970-971.
9 Cincent JL.Dear SIRS,I’m sorry to say I don’t like you…….Crit Care Med,1997,25:372-374.
10 祝筱梅,姚咏明,盛志勇.炎症复合体与炎性反应.生物化学与生物物理进展,2010,37:129-137.
11 卢崇亮.全身炎性反应综合征.华夏医学,2001,1,14:254-258.
12 吴惠珍,李静,吕迁洲.血小板Ⅱb/Ⅲa受体拮抗药盐酸替罗非班临床研究现状.中国药房,2008,19:627-630.
13 Haas TA,Plow EF.The cytoplasmic domain ofαⅡbβ3.A ternary complex of the integrinαandβsubunits and a divalent cation.J Biol Chem,1996,271:6017-6026.
14 The RESTORE Investigators.Effect of platelet glycoprotein Ⅱb/Ⅲ a blockade with tirofiban on adverse cardiac events in patients with unstable angina or acute myocardial infarction.Circulation,1997,96:1445-1453.
15 The PARAGON Investigators.International randomized,controlled trial of lamifiban(aplateletglycoprotein IIb/IIIa inhibitor),heparin or both in unstable angina.Circulation,1998,97:2386.
16 Pickering JG,Ford CM,Tang B.Coordinated effects of fibroblast growth factor-2 on expression of fibrillar eollagms,amltix metalloproteiinases by human vascular smooth muscle cells:Evidence for repressed collagen production and activated degradative capacity.Arterioscler Thromb Vase Biol,2008,48:237-341.
17 Sbu YE,Humphries S,Henney A.Matrix metalloproteinases:implication in vascular matrix remodeling during atherog-enesis.Clin Sci,1998,94:103.
18 Luttun A,Lutgens E,Manderveld A,et al.Loss of matrix metalloproteinases-9 or Matrix metalloproteinase-2 protects apolipoprotein E-de.Ficient mice against atherosclerotic aediadestruction but differ.Entially affects growth,Circulation,2004,109:1408-1414.
19 Ikeda U,Shimada K.Matrix metalloproteinases and coronary artery diseases.Clin Cardiol,2003,26:55-59.
20 Libby P.Molecular bases of the acute coronary syndromes.Circulation,1995,91:2844-2850.
21 Higo S,Uematsu M,Yamagishi M,et al.Elevation of plasma matrixmetallop-roteinase-9 in the culprit coronary artery in patients with acute myocardial infarction:clinical evidence from distal protection.Circ J,2005,69:1802-1851.
22 Higo S,Uematsu M,Yamagishi M,et al.Elevation of plasma matrixmetallop roteinase-9 in the culprit coronary artery in patients with acute myocardial infarction:Clinical evidence from distal protection.Circ J,2005,69:1180-1185.
23 Vishnevetsky D,Kiyanista VA,Gandhi PJ.CD40 ligand:a novel target in the fightagainst cardiovascular disease.Ann Pharmacother,2004,38:1500-1508.
24 Andre P,Nannizzi-Alaimo L,Prasad SK,et al.Platelet-derived CD40L:the switch-hittingplayer of cardiovascular disease.Circulation,2002,106:896-899.
25 吴素华,马虹,董吁钢主编.急性冠脉综合征.第1版.广州:广东科技出版社,2007.256-265.
26 Schonbeck U,Mach F,Sukhova GK,et al.CD40 ligation induces tissue factorexpression in human vascular smooth muscle cell.Am J Pathol,2000,156:614-620.
27 Schonbeck U,Libby P.The CD40/CD154 receptor/ligand dyad.Cell Mol Life Sci,2001,58:41.
