靶向c-Raf-1基因的反义核酸抗乙型肝炎病毒活性研究
2013-10-29黄海张秀娟谢佩雯王学军王升启
黄海 ,张秀娟 ,谢佩雯 ,王学军 ,王升启
1.河南中医学院,河南 郑州 450003;2.军事医学科学院 放射与辐射医学研究所,北京 100850
乙型肝炎病毒(hepatitis B virus,HBV)感染严重影响人类健康。目前,治疗乙肝病毒的药物主要有2大类,即干扰素和核苷类似物,但这2类药物仍然存在不同程度的副作用且均不能彻底清除HBV,尤其对HBV表面抗原(hepatitis B surface protein,HBsAg)的清除作用微弱,而HBsAg的表达是造成HBV免疫耐受的关键因素之一[1]。因此,寻找能抑制HBsAg的药物将是未来抗HBV治疗的重中之重。
寻找病毒和宿主之间的相互作用关系并发现有效的抗病毒药物靶点,是当前病毒学研究的重点和热点,治疗方法从传统的靶向病毒向靶向宿主基因发展已成为一种新趋势,并且在许多抗病毒治疗探索中均取得了重要进展[2-5]。HBV感染是引起人类肝细胞癌的重要潜在致病因子。HBV基因组中具有转录激活活性的HBx蛋白,可引发c-Raf-1/MEK激酶级联反应[6],促进HBV的表达,致使细胞增殖周期失调,进而形成肿瘤。众多研究数据表明,宿主基因c-Raf-1参与了HBV在肝细胞内的复制[7],并且c-Raf-1的活化在肝癌的发展中也起重要作用[8]。这就提示我们c-Raf-1基因可能是抗HBV药物设计的潜在作用靶点,抑制c-Raf-1可能起到抗HBV复制及其疾病进程的作用。
反义核酸(antisense oligonucleotide)是根据碱基互补原理,利用一段特异互补的DNA或RNA片段抑制或封闭特定基因表达的一门技术,是在mRNA水平干扰基因功能,开发新药的一种方法[9]。我们通过设计并筛选能特异性抑制c-Raf-1基因的反义核酸,验证通过干扰c-Raf-1基因的功能是否具有抑制HBV表达的作用。
1 材料与方法
1.1 材料
4~5周龄C57/BL6雄性小鼠购自军事医学科学院动物实验中心;HBV稳定转染细胞HepG2.2.15由本实验保存,在含10%胎牛血清(FBS,Hyclone公司)、380 μg/mL G418的DMEM细胞培养液[M&C Gene Technology(Beijing)Ltd.]中,于 37℃、5%CO2条件下培养;GenJet Ver.II转染试剂购自SignaGen公司;HBsAg及乙肝e抗原(HBeAg)定性检测试剂盒购自上海科华有限公司;HBsAg及HBeAg定量检测试剂盒购自北京泰格有限公司;Cell Counting Kit-8(CCK-8)试剂盒购自日本同仁化学研究所(Dojin⁃do);反转录试剂盒购自北京天根生化科技公司;TRIzol购自Invitrogen公司。
1.2 靶向c-raf-1基因反义核酸的设计
根据GenBank中人和小鼠c-raf-1基因mRNA序列(人:NM_002880;小鼠:NM_029780)的同源区,用 Antisense Design软件(http://sfold.wadsworth.org)进行基于RNA二级预测结构的计算机辅助反义核苷酸设计,通过GenBank联机BLAST比对,保证所选择的靶序列具有较好的特异性,设计并合成3条靶向 c-raf-1 的反义核苷酸 Raf-565(5′-TTGCTTGTC TTAGAAGGATC-3′)、Raf-943(5′-TAGTAGGTACT TTGGTGCTA-3′)和 Raf-3145(5′-AAACCTGTATT CCTGGCTTC-3′)。
1.3 脂质体介导瞬时转染寡核苷酸
将生长状态良好的HepG2.2.15细胞分别按7×103/孔接种于96孔板,每个实验组设置3个重复孔。细胞于37℃、5%CO2、饱和湿度条件下培养12~24 h,待细胞达到60%~70%融合时,参照SignaGen公司GenJet Ver.II转染试剂操作说明进行转染,将脂质体和寡核苷酸按3∶1的体积质量比混匀,每孔转染的反义核酸体积为 100 μL,终浓度为 0.4 μmol/L。同时设立转染试剂对照组,转染8 h后去除含脂质体-寡核苷酸的转染液,用含10%FBS的DMEM正常培养液继续培养,转染96 h后收集细胞培养液,检测HBsAg和HBeAg的表达。
1.4 细胞上清HBsAg和HBeAg的检测
收集细胞上清,按照HBsAg和HBeAg的ELISA检测试剂盒说明书操作步骤进行。即取50 μL细胞培养液加入包被有HBsAg或HBeAg抗体的96孔板中,每孔加入50 μL的HBsAg或HBeAg对应的酶标结合物,封板,振荡混匀,于37℃温箱孵育30 min,手工洗板5次,加入显色液A和B,封板,振荡混匀,于37℃温箱孵育15 min,加终止液50 μL,振荡混匀,酶标仪上测定D450nm值。
1.5 反义核酸细胞毒性检测
分 别 以 0.4、0.8、1.6、3.2 μmol/L 的 浓 度 转 染HepG2.2.15细胞,每个药物做3个复孔,同时设立转染试剂对照组(按最高剂量),参照SignaGen公司GenJet Ver.II转染试剂操作说明进行转染,将脂质体和寡核苷酸按3∶1的体积质量比混匀,每孔转染的反义核酸体积为 100 μL,终浓度为 0.4 μmol/L。转染8 h后换正常细胞培养液(含10%FBS的DMEM细胞培养液)继续培养,转染96 h后按照CCK-8说明书检测反义核酸的细胞毒性,细胞加入CCK-8后于37℃孵育箱中孵育0.5~1 h,酶标仪上测定D450nm值。
1.6 RT-PCR检测c-Raf-1基因mRNA水平
反义核酸 Raf-3145分别以 0.4、0.8、1.6 μmol/L的浓度转染HepG2.2.15细胞,并设正义序列(1.6 μmol/L,5′-TTTGGACATAAGGACCGAAG-3′)、随机序 列(1.6 μmol/L,5′-CGGTACAGCCGTTCAATCG A-3′)和转染试剂对照组(按最高剂量)。转染8 h后换正常细胞培养液(含10%FBS的DMEM细胞培养液),37℃、5%CO2继续培养。转染96 h后用TRIzol RNA提取试剂盒提取HepG2.2.15细胞总RNA,并取 1~2 μg RNA 作为模板,加入 2 μL 5×cDNA缓冲液及无RNase的ddH2O 6 μL,于42℃孵育 3 min,再将其与 2 μL 10×Fast RT 缓冲液、1 μL RT Enzyme Mix和2 μL RQ-RT Primer Mix混合,42℃孵育15 min,95℃孵育3 min,得到cDNA。参照GenBank中人c-Raf-1的基因序列设计PCR引物进行扩增,同时以GAPDH作为内参对照。c-Raf-1基因上游引物为5′-AAGATGCCGTGTTTG ATGGC-3′,下 游 引 物 为 5′-ATCCTGGAAACAGAC TCTCG-3′;GAPDH 上 游 引 物 为 5′-GCGGGAAATC GTGCGTGACATT-3′,下游引物为 5′-GATGGAGTT GAAGGTAGTTTCGTG-3′[10]。 PCR 反 应 体 系 包 括2.5 ng cDNA,Taq酶(TaKaRa公司)0.25 μL,10×PCR缓冲液5 μL,dNTP混合液4 μL,上、下游引物各 1 μL,灭菌蒸馏水 35 μL。PCR 反应条件:94℃30 s,55℃ 30 s,72℃ 1 min,30个循环。取PCR产物进行1.2%琼脂糖凝胶电泳。
1.7 反义核酸体内药效学评价
取4~5周龄C57/BL6雄性小鼠50只,每只尾静脉注射相当于体重10%的PBS和6 μg pHBV1.18质粒[11],在 5~8 s内注射完毕,2 d 后检测 HBsAg和HBeAg的表达,并分为模型对照组和3个给药组(剂量分别为 30、10、3 mg/kg),每组10只;腹腔注射隔天给药,给药容积0.2 mL,对照组注射0.2 mL PBS,检测体重变化;分别于第 2、8、14、21、28、42 d尾静脉取血,取 10 μL 血与 190 μL PBS 混匀,5000 r/min离心5 min取上清,定量检测HBsAg和HBeAg的含量。按化学发光检测试剂盒说明书步骤进行操作,取已离心上清50 μL加入已包被有HBsAg或HBeAg抗体的96孔板中,每孔再加入50 μL酶标结合物,封板,振震荡混匀,于37℃温箱中孵育30 min,手工洗板5次,加入发光液A和B,封板,避光,振荡混匀,酶标仪检测发光值。
1.8 做图及统计学分析
用软件Graph Pad Prism 5做图,进行统计分析,数据以x±s表示,假设检验采用t检验或方差分析,P值以星号表示(***为P<0.001,**为P<0.01,*为P<0.05)。
2 结果
2.1 靶向c-Raf-1的反义核酸抗HBV筛选
以0.4 μmol/L剂量转染反义核酸至HepG2.2.15细胞,ELISA检测细胞上清中的HBsAg和HBeAg表达水平,结果见图1,反义核酸Raf-3145对HBsAg具有较好的抑制作用。
2.2 反义核酸Raf-3145抗HBV的剂量依赖关系
分别将反义核酸Raf-3145以0.2、0.4、0.8和1.6 μmol/L的剂量转染HepG2.2.15细胞,正义序列与反义序列剂量为1.6 μmol/L,考察Raf-3145抑制HBV的剂量依赖关系,ELISA方法检细胞上清中HBsAg和HBeAg水平,结果显示Raf-3145对HBsAg的表达具有一定的抑制作用,并和剂量呈正相关(图2)。
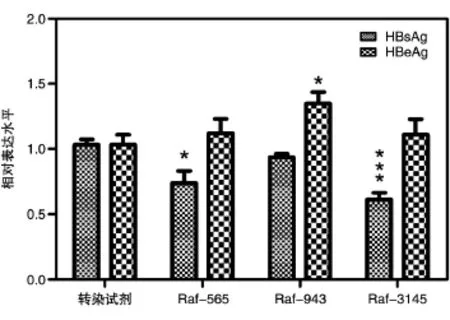
图1 反义核酸对HepG2.2.15细胞上清HBsAg、HBeAg表达的抑制作用
2.3 反义核酸Raf-3145对HepG2.2.15细胞的毒性检测
分别将反义核酸 Raf-3145 以 0.4、0.8、1.6、3.2 μmol/L的剂量转染HepG2.2.15细胞,8 h后换液正常培养,并于转染96 h后加入CCK-8,于37℃、5%CO2孵育箱中孵育0.5~1 h,于酶标仪上检测D450nm值,结果显示当给药浓度在3.2 μmol/L时细胞稍显毒性(图3)。
2.4 RT-PCR检测反义核酸Raf-3145对c-Raf-1基因mRNA水平的抑制作用
分别将反义核酸Raf-3145以0.4、0.8和1.6 μmol/L的剂量转染HepG2.2.15细胞,正义序列与反义序列浓度为1.6 μmol/L,8 h后换液正常培养,并于转染96 h后提取细胞总RNA,浓度结果显示细胞总RNA纯度较好(D260nm/D280nm为1.8~2.0),琼脂糖凝胶电泳结果显示无降解。取等量的总RNA 1 μg,按要求进行RT-PCR扩增,琼脂糖凝胶电泳结果显示,Raf-3145对HepG2.2.15细胞中靶基因c-Raf-1的抑制效果比较明显,并呈现一定的剂量依赖关系(图4)。

图2 Raf-3145对HepG2.2.15细胞上清HBsAg和HBeAg表达抑制的剂量依赖关系
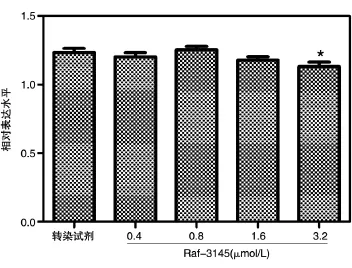
图3 CCK-8检测反义核酸对HepG2.2.15细胞的毒性作用
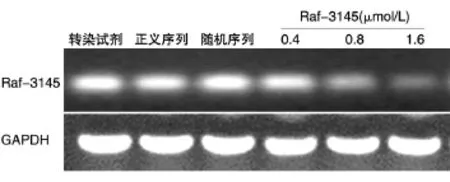
图4 Raf-3145对HepG2.2.15细胞内c-Raf-1基因mRNA水平的抑制作用
2.5 反义核酸Raf-3145抗HBV体内药效学评价
利用HBV小鼠水动力模型评价了反义核酸Raf-3145的体内抗HBV活性,ELISA定量检测结果表明只有Raf-3145高剂量组对HBsAg呈现出较明显的抑制作用,其他组对HBsAg和HBeAg的抑制作用不明显,个别时间点还呈现了一定的促进作用(图5)。与对照组比较,各给药组均无明显的体重下降趋势;解剖结果肉眼未见明显器质性病变,表明在该剂量范围内未见明显毒性(图6)。
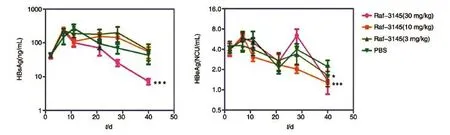
图5 反义核酸Raf-3145对小鼠血清中HBsAg、HbeAg表达的抑制作用
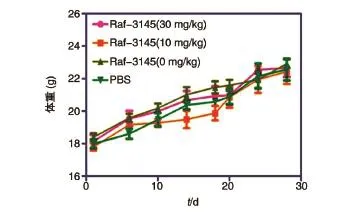
图6 反义核酸Raf-3145对小鼠体重的影响
3 讨论
Raf激酶有3种不同亚型,即Raf-1/c-Raf-1、Raf-A和Raf-B。Raf-A和Raf-B表现出独特的组织表达形式,但c-Raf-1的表达更广泛[12]。目前,对于HBV是如何调节c-Raf-1表达的机制还不是很清楚,但有研究显示,HBV能通过增强Raf-1启动子的活性,提高其在HepG2.2.15细胞中的表达[13]。以往研究c-Raf-1在肝细胞肝癌组织中的表达多数与Raf1/MAPK信号通路的激活有密切关系,且c-Raf-1在此过程中起重要作用[14]。HBV转录激活的2种蛋白均可引发该通路的激活,HBV的X蛋白更是与肝癌的发生、发展有着密切关系[15]。另外,c-Raf-1还与其他多种癌症的发生、发展相关[3,16-19]。c-Raf-1作为癌症治疗的靶点已有相关报道,Kasid等证明用特异反义核酸ISIS-5132干扰c-Raf-1基因后,能够抑制无胸腺小鼠体内的人类肺、卵巢及乳腺肿瘤异种移植物的生长[20],并首次证明了c-Raf-1基因是抗癌症研究中有效的靶点;还有研究显示用脂质体介导转染的靶向c-Raf-1的反义核酸可明显抑制卵巢癌细胞c-Raf-1蛋白的表达[21]。
当前治疗乙肝的药物主要靶向病毒自身,容易产生耐药性,靶向HBV复制必需的宿主基因有望解决这一问题。c-Raf-1在HBV复制过程中的机制虽不是很清楚,但其在HBV复制中的关键角色却是确定的。本研究的新颖之处在于首次利用反义技术设计靶向宿主基因c-Raf-1的反义核酸,探讨c-Raf-1作为抗HBV靶点的有效性。为了便于体内外同步筛选验证,我们选择的靶序列为人鼠同源序列,同时尽量避免脱靶效应。体内外结果显示Raf-3145对HBsAg的表达表现出较好的抑制作用。考虑到c-Raf-1基因参与了HBV的复制过程,且有研究显示c-Raf-1在肝癌患者体内的表达与HBV有关[13],因此靶向c-Raf-1的药物不但可抑制HBsAg的表达,有利于打破免疫耐受,而且可能延缓HBV导致的肝癌发展进程,具有重要的研究和开发价值。
综上所述,本研究筛选并证实靶向基因c-Raf-1的反义序列Raf-3145具有一定的抑制HBsAg表达的活性,进而验证了靶基因c-Raf-1的可靠性。考虑到反义序列Raf-3145具有的潜在开发价值,值得对其进行进一步的药效学和毒性研究。
[1]Dandri M,Locarnini S.New insight in the pathobiology of hepatitis B virus infection[J].Gut,2012,61(Suppl 1):i6-17.
[2]Ding X,Yang J,Wang S.Antisense oligonucleotides targeting abhydrolase domain containing 2 block human hepatitis B vi⁃rus propagation[J].Oligonucleotides,2011,21(2):77-84.
[3]Chen Y,Ouyang G L,Yi H,et al.Identification of RKIP as an invasion suppressorprotein in nasopharyngealcarcinoma byproteomicanalysis[J].JProteome Res,2008,7(12):5254-5262.
[4]HaoL,SakuraiA,WatanabeT,etal.DrosophilaRNAi screen identifies host genes important for influenza virus repli⁃cation[J].Nature,2008,454(7206):890-893.
[5]Konig R,Stertz S,Zhou Y,et al.Human host factors re⁃quired for influenza virus replication[J].Nature,2010,463(7282):813-817.
[6]Stockl L,Berting A,Malkowski B,et al.Integrity of c-Raf-1/MEK signal transduction cascade is essential for hepatitis B virus gene expression[J].Oncogene,2003,22(17):2604-2610.
[7]Qu J,Li J,Chen K,et al.Hepatitis B virus regulation of Raf1 promoter activity through activation of transcription fac⁃tor AP-2alpha[J].Arch Virol,2012.
[8]殷飞,赵雅娟,姚树坤.Raf-1在肝细胞肝癌组织的表达[J].世界华人消化杂志,2009,17(6):618-622.
[9]吕艳秋.反义寡核苷酸技术研究进展.[J].广东医学,2006,27(8):1270-1272.
[10]吴永忠,任庆兰,李少林.C-erbB-2与c-raf-1基因反义寡核苷酸联合对人卵巢癌裸鼠皮下移植瘤的治疗作用][J].癌症,2003,22(8):836-839.
[11]Wang X J,Li Y,Huang H,et al.A simple and robust vec⁃tor-based shRNA expression system used for RNA interference[J].PLoS One,2013,8(2):e56110.
[12]Morrison D K,Cutler R E.The complexity of Raf-1 regulation[J].Curr Opin Cell Biol,1997,9(2):174-179.
[13]Tian Y,Hu Y,Wang Z,et al.Hepatitis B virus regulates Raf1 expression in HepG2.2.15 cells by enhancing its promot⁃er activity[J].Arch Virol,2011,156(5):869-874.
[14]Hwang Y H,Choi J Y,Kim S,et al.Over-expression of c-raf-1 proto-oncogene in liver cirrhosis and hepatocellular carcinoma[J].Hepatol Res,2004,29(2):113-121.
[15]李钢,胡明道.乙型肝炎病毒X蛋白在肝细胞癌发生发展中的作用[J].医学综述,2012,18(11):1666-1668.
[16]Fransén K K M,Osterström A,Dimberg J,et al.Mutation analysis of the BRAF,ARAF and RAF-1 genes in human colorectal adenocarcinomas[J].Carcinogenesis,2004,25(4):527-533.
[17]Meng F D J,Liu N,Zhang J.Inhibition of gastric cancer an⁃giogenesis by vector-based RNA interference forRaf-1[J].Cancer Biol Ther,2005,4(1):113-117.
[18]Chattopadhyay I P R,Singh A,Vasudevan M.Molecular pro⁃filing to identify molecular mechanism in esophageal cancer with familial clustering[J].Oncol Rep,2009,21(5):1135-1146.
[19]Mullen P M F,Monia B P,Smyth J F.Comparison of strate⁃gies targeting Raf-1 mRNA in ovarian cancer[J].Int J Can⁃cer,2006,118(6):1565-1571.
[20]Kasid U D A.RAF antisense oligonucleotide as a tumor ra⁃diosensitizer[J].Oncogene,2003,22(37):876-5884.
[21]Cheng Y C,Stein C A.Antisense inhibition of gene expres⁃sion[J].Cancer:Princ Pract Oncol,1997,63(5):3057-3070.
