正交设计优化唇形科植物ITS反应体系
2013-10-23沈文华李娅迪
沈文华,陈 业,李娅迪,江 辉,关 萍
(贵州大学生命科学学院,贵州贵阳550025)
唇形科(Lamiaceae)是双子叶植物纲中的一个大科,大约有220属3 500余种,中国约有98属800余种,全国广布;贵州有47属127种[1]。中国唇形科药用植物共有74属345余种,其中《中药大辞典》收录的共41属120余种[2],常见的唇形科药用植物有益母草、牛至、夏枯草、筋骨草、藿香、紫苏、薄荷、荆芥、黄芩等[3]。唇形科植物只有在花果期时才便于鉴定,且属内不同种相似性较大,种质鉴定极其不易,作为药材时,经常有奸商将伪品鱼目混珠[4]。DNA条形码(DNA barcoding)作为一种快速、有效而标准化的分子鉴定方法,由加拿大U-niversity of Guelph动物学家Paul Hebert首次提出[5]。Kress等[6]最早将 ITS 作为植物 DNA 条形码候选片段,目前已有在七叶一枝花[7]、柴胡[8]、黄草石斛[9]等中药材方面的研究。本文对常见唇形科植物ITS-PCR反应体系进行了优化,旨在为唇形科药用植物的分子鉴定奠定技术基础。
1 材料与方法
1.1 材料
供试的16种唇形科植物均于2012年6月至9月采于贵阳市花溪区,由贵州大学生命科学学院关萍教授鉴定(表现1)。
1.2 基因组DNA的提取与检测
采用改良的CTAB法[10]提取全基因组DNA,0.8%的琼脂糖凝胶电泳检测DNA的质量,通过紫外分光光度计确定DNA浓度与纯度,并将浓度稀释至20~80 ng/μL。
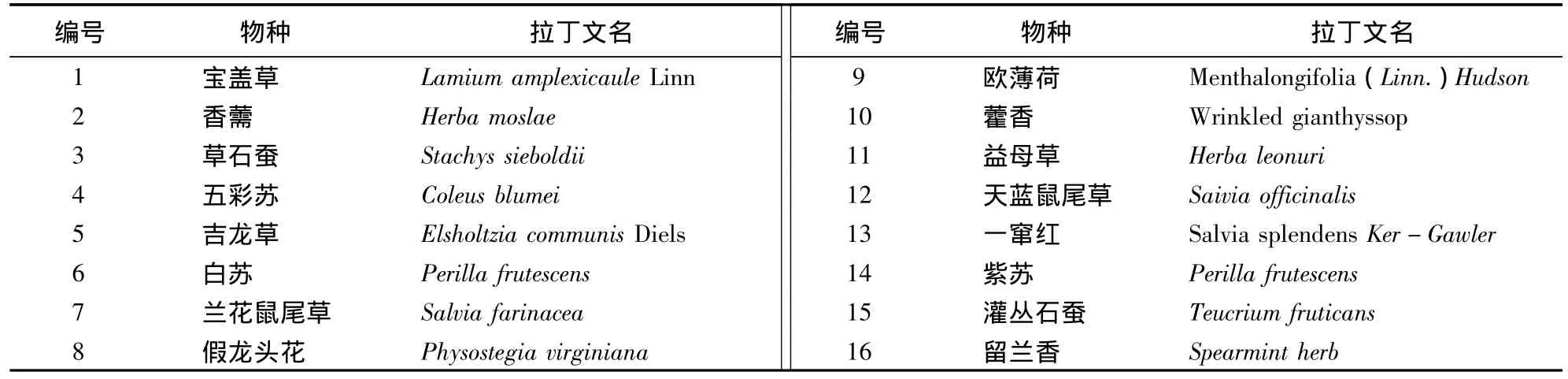
表1 研究材料Tab.1 The materials used for PCR reaction system optimization
1.3 正交设计与各反应因素水平确定
益母草nrDNA ITS片段的扩增采用通用引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和 ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)[11]。以益母草DNA为模板,选用L9(34)正交表(表2),对Taq聚合酶、Mg2+、dNTP及引物的浓度进行筛选。反应体系总体积为25μL,每管加入2.5μL的10×PCR buffer和1μL模板DNA,加去离子水补足,每组处理重复两次。
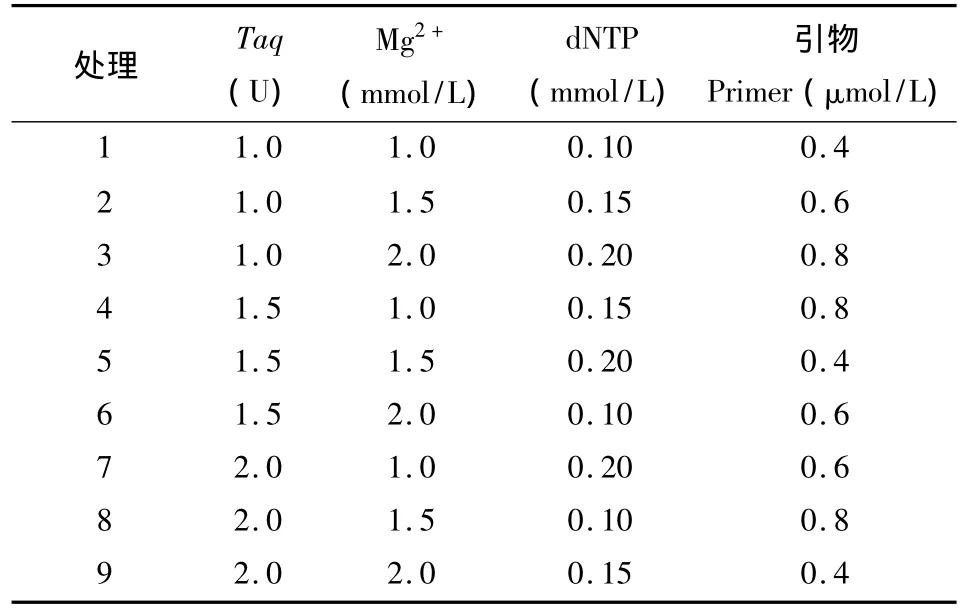
表2 PCR正交试验设计表[L 9(34)]Tab.2 Orthogonal design for PCR amplification
PCR扩增反应在Bio-Rad梯度PCR扩增仪上进行,反应程序为:94℃ 4 min;94℃ 1 min;54℃45 s;72℃ 1 min;35次循环;72℃最后延伸7 min,扩增完成后4℃保存。用1.5%的琼脂糖凝胶成像系统成像。
依据桂腾琴等[12]的方法对PCR扩增结果依次打分,采用正交设计助手ⅡV3.1与MINITAB软件对试验进行直观分析与分差分析,依据方差分析的结果确定是否需要进行多重比较分析。
根据试验分析结果,选择最佳反应体系对退火温度进行梯度试验,设定 50.0、50.7、51.9、53.6、55.6、57.2、58.4、59.0℃8 个温度梯度,每个梯度设两个重复,最后用最佳反应体系与程序对16种唇形科植物进行ITS-PCR稳定性验证。
2 结果与分析
2.1 ITS-PCR正交设计直观分析
正交试验PCR产物电泳结果见图1。综合考虑两次重复的扩增结果,条带最清晰、稳定的组合计9分,最差的计1分,9个组合的分数依次为3、4、8、5、6、9、2、1、7,再根据打分,采用正交设计助手ⅡV3.1进行直观分析(表3)。极差值R反应了影响因素对反应体系的影响,R越大,影响越显著。由表3可知,各因素水平的变化对反应体系的影响从大到小依次为:Mg2+>Taq>dNTP>引物。
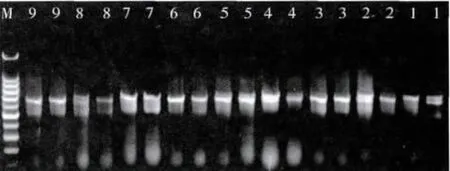
图1 正交试验PCR产物电泳结果Fig.1 Electrophoresis of orthogonal design PCR products The codes of lane
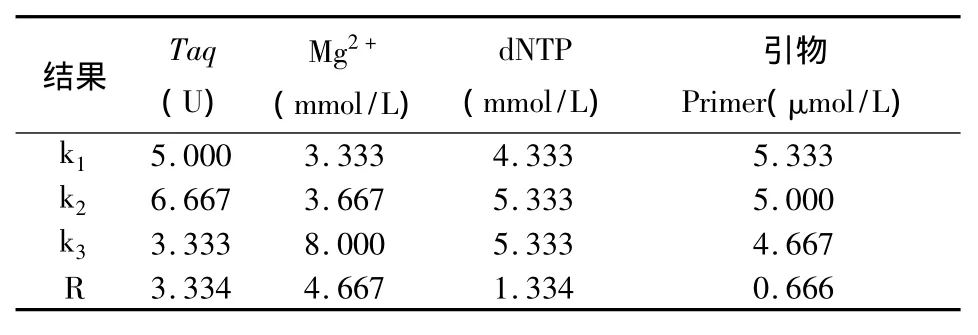
表3 正交设计直观分析Tab.3 Intuitive analysis of orthogonal design
依据每个因素水平下的均值ki,直观分析得出的最佳反应体系为:1.5 U Taq聚合酶;2.0 mmol/L Mg2+;0.15 ~0.20 mmol/L dNTP;引物浓度为 0.4 μmol/L。直观分析得出的最佳反应体系并没有在正交表中表现出,虽然与得分最高的6号组合在引物用量上有差别,但其ki值相差并不是很大。
2.2 正交设计方差分析
用正交设计助手ⅡV3.1软件对试验结果进行方差分析(表4)。由F比值可知,Mg2+浓度各水平对PCR结果的影响最大,其次是Taq聚合酶用量,而dNTP与引物量对PCR结果影响不明显。
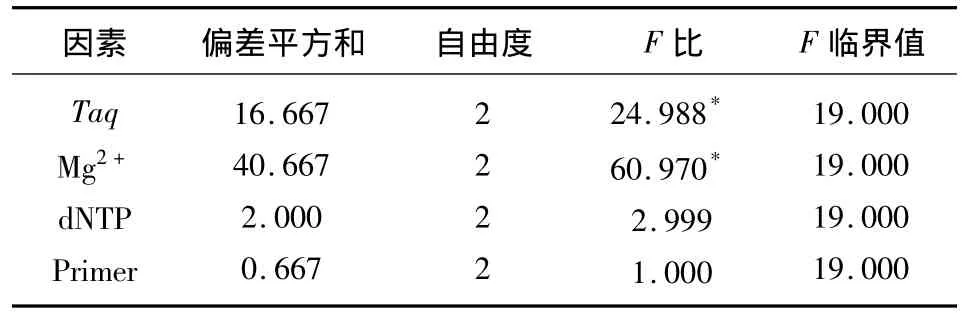
表4 正交设计方差分析Tab.4 Variance analysis of orthogonal design
用MINITAB软件对试验结果进行多重比较分析(图2),结果表明,Mg2+浓度对该试验结果的影响最大。Mg2+浓度在 1.0、1.5 mmol/L 水平间的差异不明显,但与2.0 mmol/L水平的差异显著(图2)。图 1 中,当 Mg2+浓度为1.0 mmol/L(1、4、7 号处理)时和1.5 mmol/L(2、5、8 号处理)时,临近处理号PCR产物条带相似,扩增条带弱、有杂带,且弥散、拖尾;当 Mg2+浓度为 2.0 mmol/L(3、6、9 号处理)时,扩增条带亮度清晰、明亮,无杂带,弥散与拖尾现象减弱或者消失。因此,选择2.0 mmol/L为最佳水平。
Taq聚合酶用量对PCR结果的影响仅次于Mg2+用量,各水平间均有显著差异,说明在本试验所选梯度范围内Taq聚合酶用量对PCR反应结果影响较大,最佳用量为1.5 U。
dNTP浓度在该试验选取的3个水平范围内对PCR扩增结果影响不显著,这一结论与马大龙等[13]的研究相似,参照ki值以及从经济角度考虑,最佳dNTP浓度为0.15 mmol/L。
在本试验所选的3个水平范围内,引物浓度对PCR扩增结果的影响也不显著,这与陈业等[14]的研究相似,参照每一因素水平下的数据平均值ki,最佳引物浓度为1.0μmol/L。
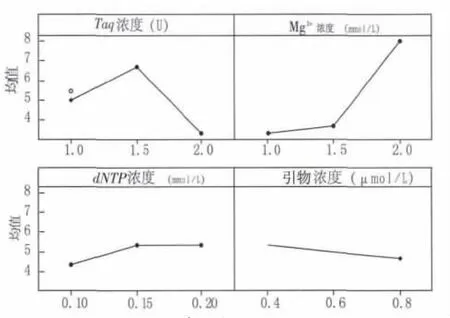
图2 各因素与实验结果主效应图Fig.2 The main effect pattern of each factor and experiment result
2.3 退火温度对益母草ITS-PCR扩增的影响
根据正交试验结果,选择的反应体系为:1.5 U Taq 聚合酶,2.0 mmol/L Mg2+,0.15 mmol/L dNTP,0.4μmol/L引物。依据引物Tm值,以此体系进行温度梯度试验(图3)。由图3可见,退火温度较高时(55.6、57.2、58.4、59℃),扩增条带较弱,且杂带较多;退火温度较低时(50℃),扩增条带虽然清晰、明亮,但主带附近有1条明显的杂带;退火温度50.7~53.6℃都能扩增出单一明亮的条带。由于适当提高退火温度可提高扩增产物的特异性,故选择53.6℃为最佳退火温度。
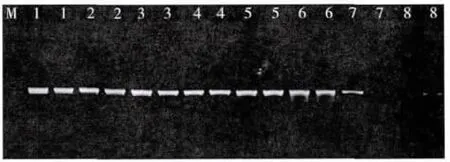
图3 退火温度对ITS反应的影响Fig.3 The effect of annealing temperature on ITSamplification Lane 1 to 8 indicating the annealing temperature
2.4 最佳反应体系和反应程序的验证
根据正交试验及温度梯度扩增试验结果,对唇形科16种植物进行反应体系的验证。反应程序为:第一阶段,94℃预变性4 min;第二阶段,94℃变性 1 min,53.6℃退火 45 s,72℃延伸 1 min,循环 35次;第三阶段,72℃延伸7 min,反应终止,4℃保存。PCR扩增后进行电泳检测出现清晰、明亮的单一谱带(图4),产物经上海生工测序,除10以外都获得了ITS序列。
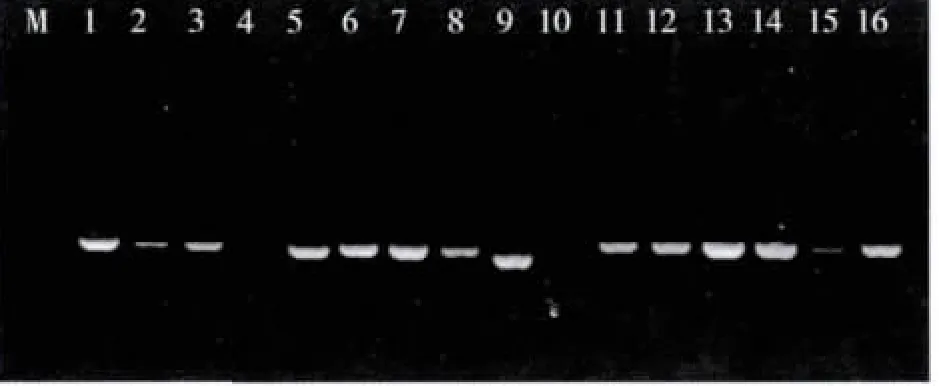
图4 16种常见唇形科植物ITS扩增结果Fig.4 Electrophoresis of 16 common lamiaceae PCR products
3 讨论
已有研究报道[10-12]表明,PCR反应对模板浓度要求范围较宽,故本试验未对模板浓度进行探究。试验结果表明,在ITS扩增反应体系中,Taq聚合酶、Mg2+对扩增结果有重要影响,而dNTP、引物浓度对扩增结果的影响不明显。在PCR反应体系中,Mg2+浓度过高,会使反应特异性降低,浓度过低,使产物产量减少;Taq聚合酶浓度太高,会出现非特异性扩增,而过低时则扩增产量太低。同时,为增加试验的可比性,应尽量选择同一产家同一批次的Taq聚合酶。dNTP与引物浓度对PCR扩增结果都有影响,dNTP浓度过低影响扩增产量,过高则会导致错误掺入,而引物浓度过高则有两个弊端:一是容易形成引物二聚体,二是微量靶目标并且起始材料又不太纯时容易产生非特异性产物。本试验dNTP与引物浓度的3个水平对扩增结果影响不明显,仅表明这3个水平对本试验的影响。因此,不同植物初建ITS-PCR体系时,要保证扩增结果的稳定性、可信性、重复性,必须对ITS扩增的条件与因素进行优化。
本试验将正交设计应用于PCR反应体系的优化中,并在结果分析中应用了正交设计助手、MINITAB软件。与单因素设计和完全组合设计相比具有以下优势:减少了处理组合,节省了人力财力;将结果量化,使结果更标准、完善、科学,具有一定的客观准确性;试验中各因素内水平间的相关性分析结合图表,其规律一目了然。本试验中对正交试验结果打分带有一定的主观性,打分结果可能出现因人而异的情况,因此,可采取多次打分取平均值的方法以削弱误差的影响,同时需建立一套客观、标准的评价准则。
本试验获得的最佳反应体系经过论证,可以为后续唇形科植物ITS-PCR反应提供参考。对于样品10,可以适当提高Mg2+浓度,或者结合单因素试验对Mg2+浓度进行优化,以获得ITS序列。
[1]贵州植物志编辑委员会.贵州植物志:第八卷[M].贵阳:贵州民族出版社,1988.
[2]王瑞祥,赵跃平,张 猛,等.山西省唇形科药用植物资源研究[J].现代农业科技,2011(23):275-276.
[3]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2000:33-34.
[4]吕国庆,姬可平,牛宪立,等.建立我国中药材DNA条形码数据库方法的探讨和前景展望[J].新乡医学院学报,2010,27(4):416-418.
[5]HEBERT P D N,CYWINSKA A,BALL S L,et al.Biological identifications through DNA barcodes[J].Proc Biol Sci,2003,270(1):313-321.
[6]KRESSW J,WURDACK K J,ZINMER E A,et al.Use of DNA barcodes to identify flowering plants[J].Proc Natl Acad Sci USA,2005,102(23):8 369-8 374.
[7]蒋向辉,佘朝文,许 栋,等.七叶一枝花基于ITS序列的DNA条形码构建研究[J].时珍国医国药,2010,21(12):3 295-3 296.
[8]武 莹,刘春神,刘玉法,等.5种习用柴胡的ITS序列鉴定[J].中国中药杂志,2005,30(10):732-734.
[9]徐 红,李晓波,丁小于,等.中药黄草石斛rDNA ITS序列分析[J].药学学报,2001,36(10):777-783.
[10]张玉晶,李牡丹,石 旭,等.珙桐基因组DNA的提取及ISSR-PCR体系的优化[J].山地农业生物学报,2011,30(3):211-214.
[11]WHITE T J,BRUNST,LEE S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M].New York:A guide to methods and application,Academic Press,1990:315-322.
[12]桂腾琴,孙 敏,乔爱民,等.正交设计优化果梅ISSR反应体系[J].果树学报,2009,26(1):108-112.
[13]马大龙,杨国亭,穆立蔷,等.赤松外生菌根ITS-PCR体系的建立及优化[J].林业科学,2010,35(5):25-28.
[14]陈 业,张玉晶,李娅迪,等.兜兰ITS-PCR反应体系的建立及优化[J].贵州农业科学,2012,40(7):52-55.
