拟南芥HSP70基因启动子表达载体的构建及在烟草BY2细胞中的应用
2013-10-23褚艳霞孙虎林郑亚洁孙恒吉司英语周树敏
郑 帮,陈 燕,褚艳霞,孙虎林,郑亚洁,孙恒吉,司英语,周树敏,张 卫
(上海大学 生命科学学院,上海200444)
0 引言
热激蛋白HSP70是拟南芥HSP70基因家族中的一种,其表达会随着温度的升高而增强,即热激特性[1].这种热激特性是由热激蛋白HSP70的启动子决定的,因此拟南芥的HSP70基因启动子也成为研究的热点之一.在以拟南芥植株为实验材料,将含有拟南芥的HSP70基因启动子的表达载体转入其中进行表达.受到植株生长周期长的影响,会造成实验周期长,对实验进展造成一定的影响.烟草BY2细胞(Nicotiana tabacum L.cv Bright Yellow2,BY2)是非常重要而且用途广泛的细胞系[2-3],由 Kato 等于1972年分离得到[4].BY2细胞可以比较容易地转化外源基因,此外,BY2细胞系拥有高度的同一性,且生长迅速,可获得具高度同周期性的BY2细胞,1周内便可增加80~100倍.因此,BY2细胞已成为研究生物研究的模式系统[5],而且转基因BY2细胞团和悬浮培养细胞都较容易获得.因此若能将含有拟南芥的HSP70基因启动子且以GFP为报告基因的表达载体转入其中,且可正常表达报告基因,则可明显缩短实验周期,对热激蛋白HSP70启动子的后续实验研究提供大量丰富的实验材料.
1 材料
1.1 植物材料
本实验室自有拟南芥Columbia生态型(Arabidopsis thaliana),置于温度为22℃,光照为16 h光照,8 h黑暗的人工光照温室培养[6].实验室自有液体悬浮烟草 BY2细胞,27℃,130 r/min,暗培养[7].培养基配方见参考文献
1.2 引物和试剂
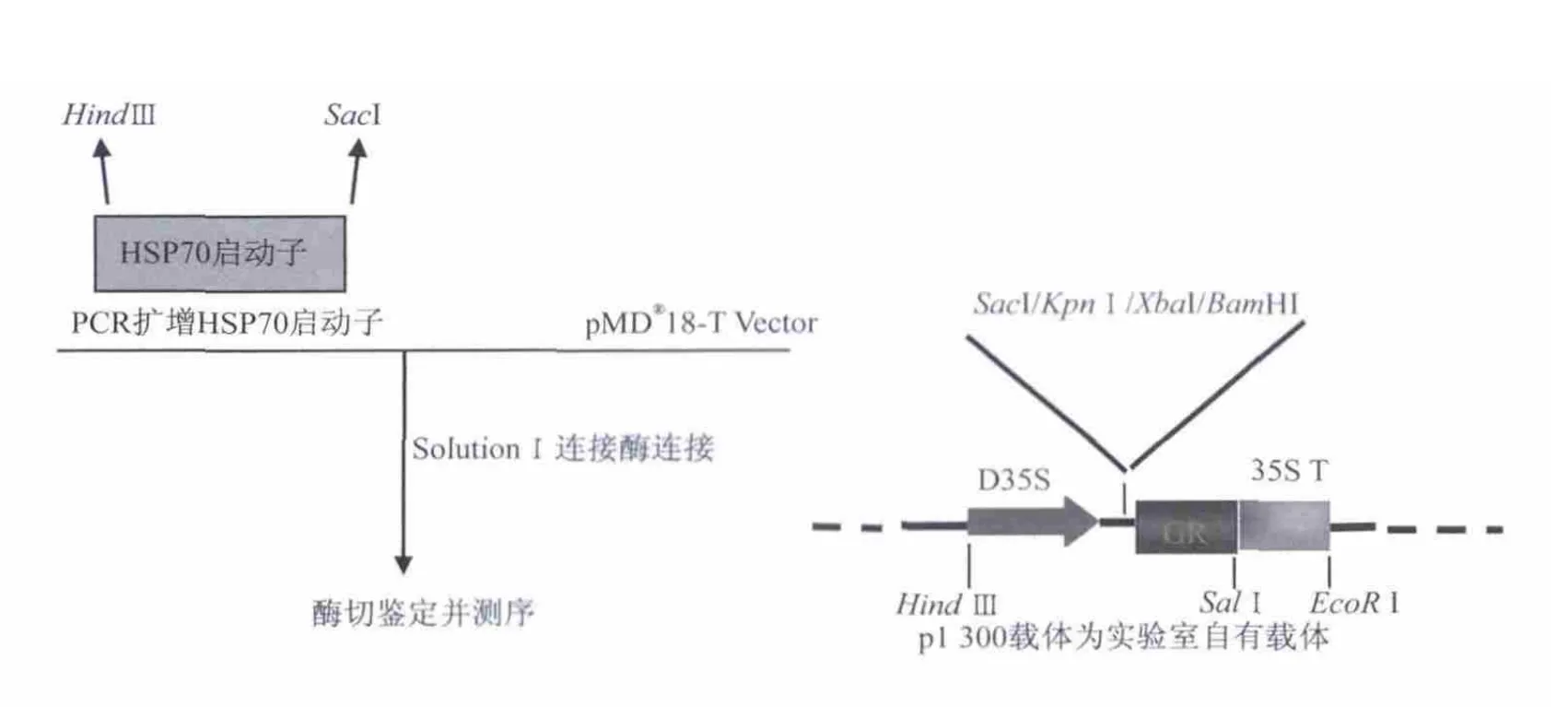
在www.arabidopsis.org网站下载HSP70启动子的序列并依据启动子的序列设计引物,在上下游引物两端分别加入HindⅢ和Sac1酶切位点.长度选取转录起始点至上游1.5 kbp.实验所用引物如表1所示.
实验室自有GFP-T质粒.GFP基因序列已经测序验证且正确.

表1 实验所用引物
引物合成由上海生工生物工程公司进行合成.
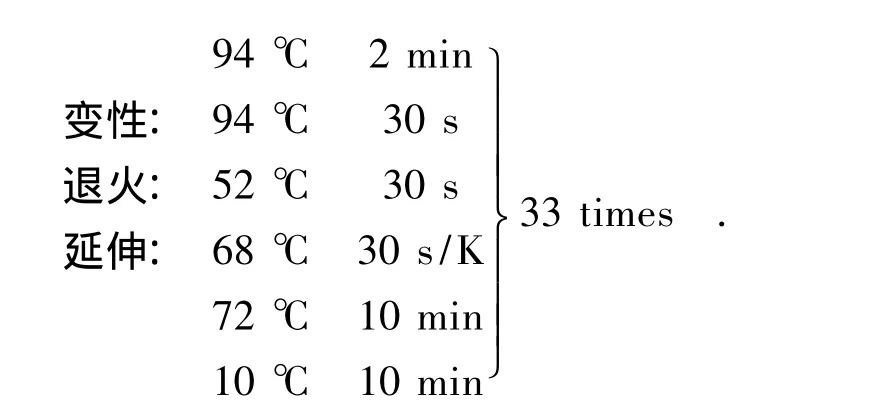
PCR扩增采用takara公司生产的KOD PCR扩增试剂盒.PCR扩增参数为:
胶回收试剂盒由takara公司生产的胶回收试剂盒进行胶回收.
pMD18-T载体和连接酶Solution I由TAKARA公司生产.连接体系(10μL)如下所示:

2 方法
2.1 基因组抽提
采用试剂盒抽提基因组的方法.试剂盒购自康为世纪生物技术公司.
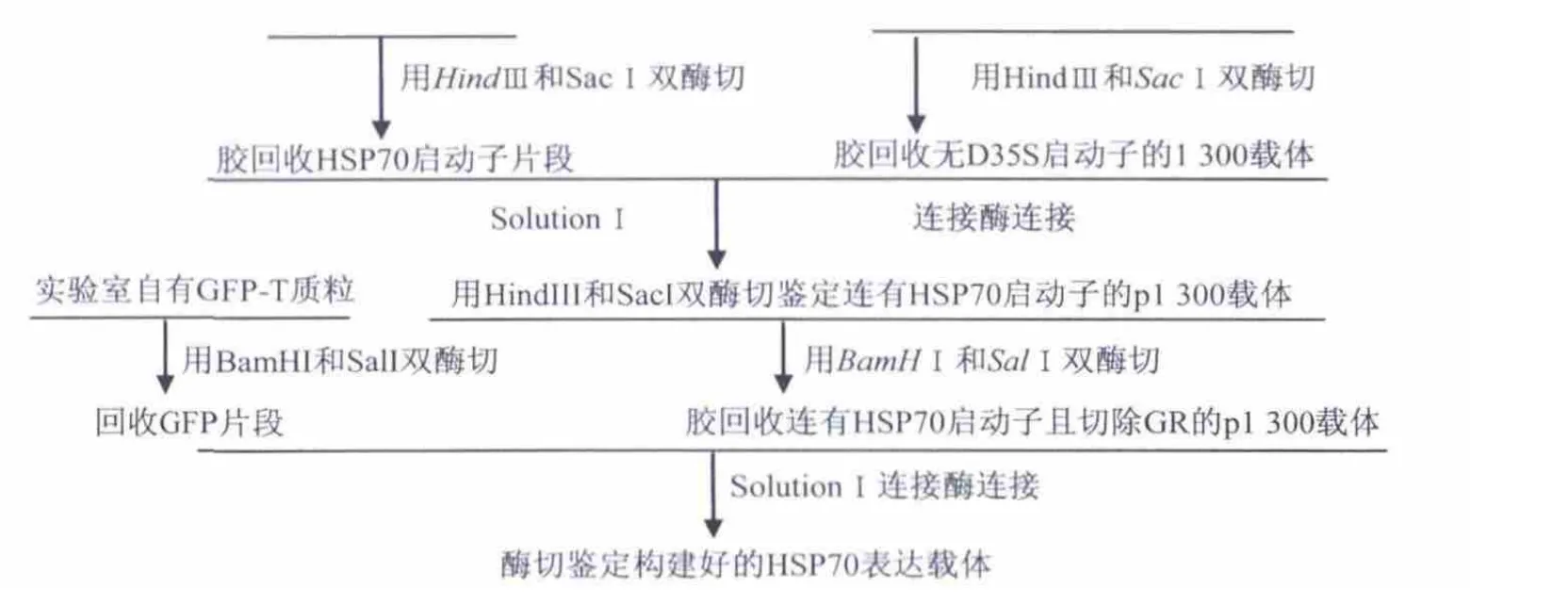
2.2 表达载体的构建流程
2.3 转化入农杆菌
将构建好的表达载体采用热激转化的方法转入农杆菌GV3101,并对农杆菌菌落进行阳性克隆的筛选和鉴定.转化方法详见参考文献[8-9].
2.4 转基因
(1)将鉴定已经转入表达载体的农杆菌GV3101阳性克隆划板,且挑取单克隆进行小型摇培(5 mL),继而进行转基因操作.具体转化步骤:
(2)从农杆菌平板上挑取单菌落于2 mL LB培养基,250 r/min,28℃过夜,OD600至0.6.
(3)洗农杆菌:1 mL菌液:2500 g离心10 min,室温,去上清,加入1 mL 10 mmol/L MgSO4,混匀,2500 g离心10 min,去上清,加入1 mL 10 mmol/L MgSO4,混匀,加入2μL 200 mmol/L As(有利于转化,也可不加),室温静置2 h.
(4)分装悬浮培养的烟草BY2细胞5 mL于小培养皿中(一般1个基因做2个,1个空白对照),用移液器吹打20次,诱导缺口,有利于转化.
(5)加入100μL处理好的农杆菌,轻轻摇匀,对照加入100 lL ddH2O.
(6)28℃静置暗培养48 h.
(7)每个培养皿中加入5 mL BY2液体培养基轻轻摇匀.
(8)转入50 mL EP管,用BY2液体培养基补到总体积25 mL.
(9)1000 g离心5 min,室温.
(10)小心倒去上清,均匀倒在含有潮霉素的BY2固体培养基平板.
(11)28℃静置培养3周.
2.5 阳性克隆细胞团的筛选
转基因BY2细胞转化后约3周可在50μg/mL的潮霉素和万古霉素抗性平板上长出阳性单克隆的细胞团,潮霉素起到筛选阳性克隆的作用,万古霉素起抑制农杆菌的生长,并将所筛选到的阳性单克隆细胞团移出至新的50μg/mL的潮霉素抗性平板传接一代,再接至液体培养基培养传代,如图1所示:
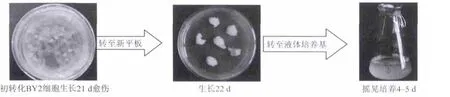
图1 转化后的BY2细胞传代
3 结果
3.1 HSP70启动子克隆
从拟南芥基因组中PCR扩增HSP70启动子(图2)和HSP70启动子与T-载体连接后的酶切(图3)鉴定电泳图.
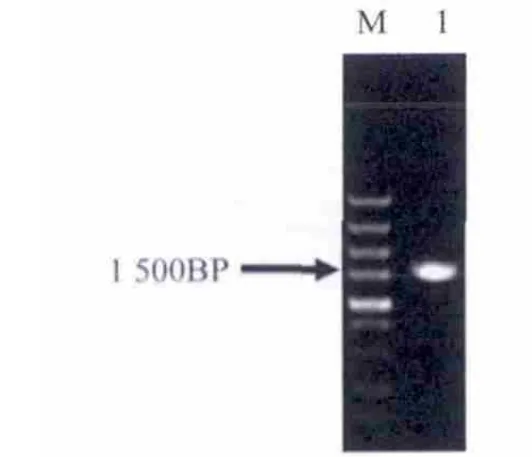
图2 PCR扩增HSP70启动子
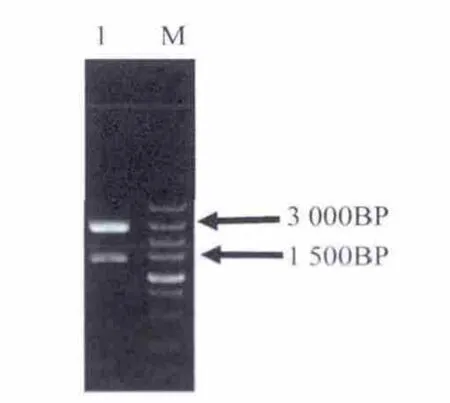
图3 HSP70启动子与T-载体连接后酶切鉴定
将HSP70启动子测序结果与NCBI网站的原始序列进行比对,测序结果和原始序列完全匹配,无缺失、错配等.
HSP70启动子序列如图4所示.

图4 HSP70启动子序列
3.2 表达载体的鉴定
将构建好的表达载体阳性克隆抽提质粒并进行酶切鉴定.对HSP70启动子采用HindⅢ和Sac I进行双酶切鉴定(图5),对GFP采用BamH I和Sal I进行双酶切鉴定(图6),并用HindⅢ和Sal I进行双酶切切出HSP70启动子加GFP片段(图7),分别切出1.5 kb条带,750 bp条带,2.25 kb条带以及剩余的载体条带.酶切鉴定结果如图7.
3.3 转基因BY2细胞鉴定
对筛选到的阳性细胞团基因组进行PCR鉴定,PCR扩增条带包括GFP及HSP70启动子部分片段,长度约为550bp,抗性平板共筛选到11个阳性细胞团,PCR鉴定结果如图8.
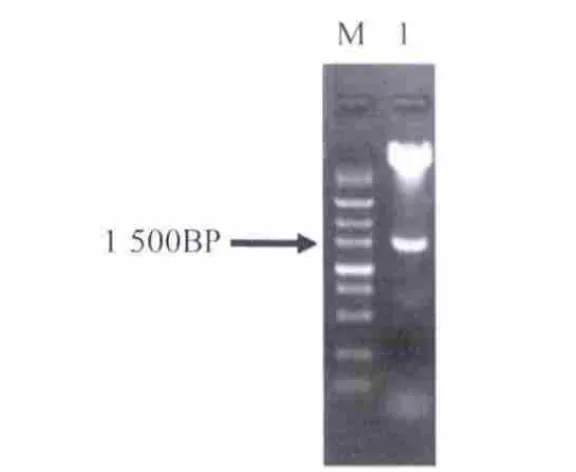
图5 HSP70启动子酶切鉴定
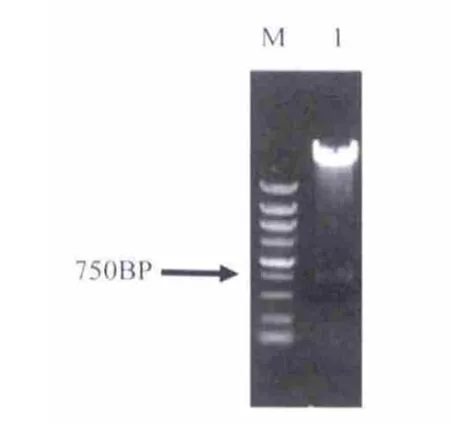
图6 GFP酶切鉴定
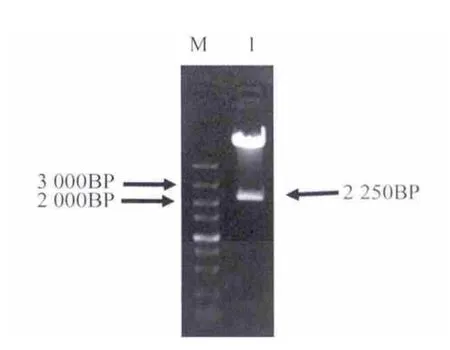
图7 HSP70启动子和GFP酶切鉴定
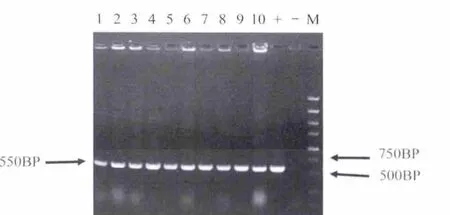
图8 转基因细胞PCR鉴定
3.4 荧光观察
通过采用激光共聚焦荧光显微镜对转基因和非转基因即野生型(WT)BY2细胞的荧光观察发现,野生型即非转基因BY2细胞有极其微弱的自发荧光,几乎看不到,但转基因BY2细胞的荧光要远远强于野生型BY2细胞(图9).同时对野生型和荧光强度进行定量(图10).RT-PCR结果证明野生型BY2细胞中并无GFP的表达,而转基因BY2细胞中表达很强(图11).
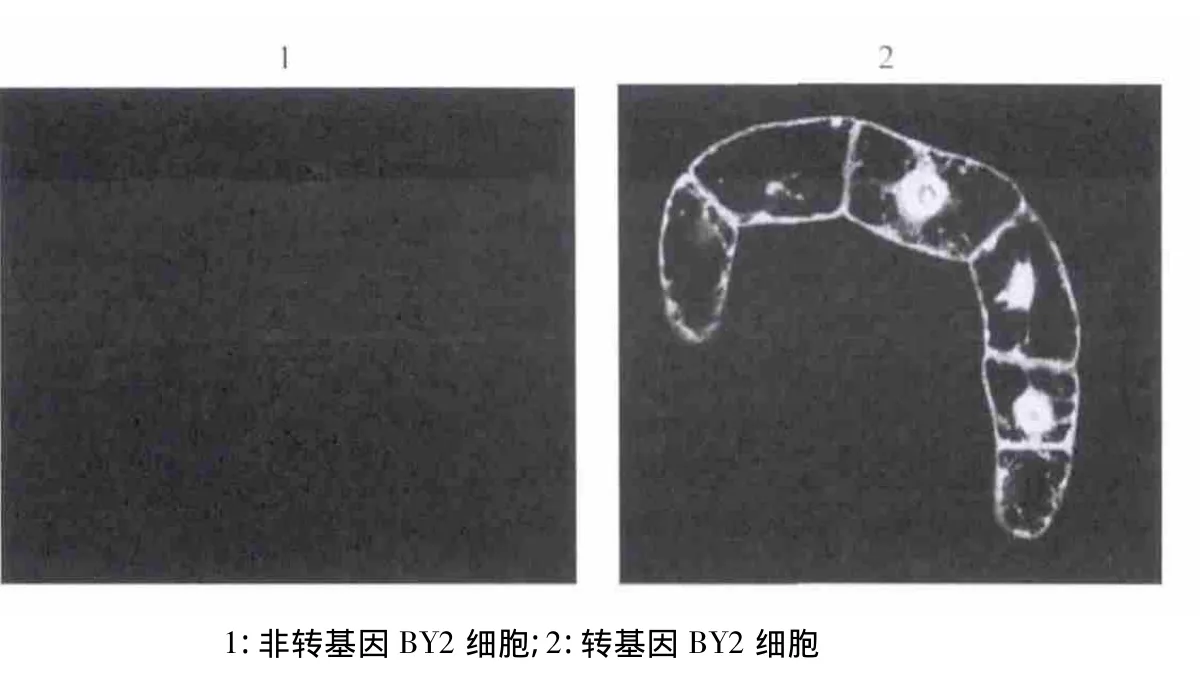
图9 BY2细胞荧光观察
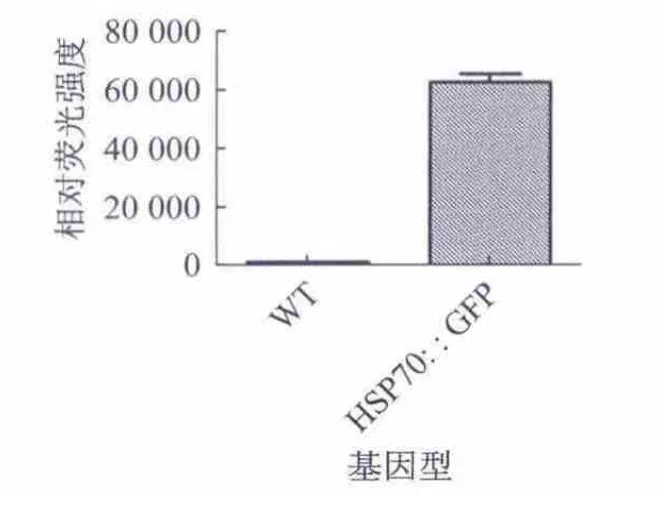
图10 荧光定量结果
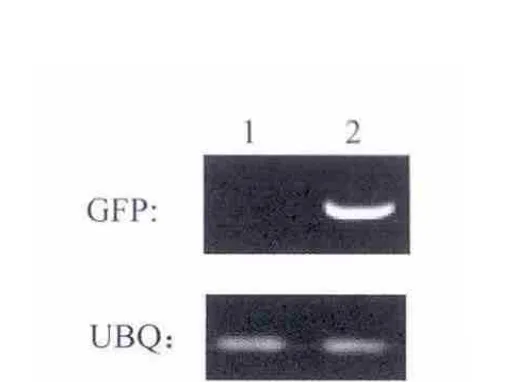
图11 RT-PCR结果
4 讨论
拟南芥的HSP70基因启动子是一种热激起动子,对其的研究一直是现代生物学的热点,其表达的强弱受到受到多方面因素的影响,如外界温度,自身启动子的顺式元件以及反式元件的协同作用[1].随着现代分子生物学的发展,实验操作的很多环节均可采用试剂盒来快速完成实验的操作,大大节省了时间,但是植物种植的时间很难缩短,因此在实验材料的获得上往往会限制实验的进展速度,具体以拟南芥为例,其生育周期常为42~56 d,在生长到20 d左右时可以转化,收到种子干燥10 d后才可筛选阳性苗,在筛选阳性苗的过程中还要经过春化,发苗等过程,在阳性苗生长到可以取材进行时,后续实验还要生长一段时间[10],且植株生长周期有限,有幼苗期和衰老时期不可能随时进行取材,但是液体悬浮培养的BY2细胞生命周期短,转接传代操作简单,可随时取材进行观察,省去植物种植的时间,因此将拟南芥的HSP70基因启动子表达GFP的表达载体转入液体悬浮培养的BY2细胞,可在一次转化后大量传接培养,4~7 d便可传代培养一次,相比于种植一代植物可节省大量时间,可明显缩短后续实验的周期,且由于液体悬浮培养的BY2细胞繁殖快,可大量传接,因此可以获得大量的实验材料,从而利于对拟南芥的HSP70基因启动子的研究,并对其他基因的研究提供可借鉴的思路.
[1]CATHERINE H U,SIOUYING L,WEN T,et al.Recent gene duplication and subfunctionalization produced a mitochondrial grpE,the nucleotide exchange factor of the Hsp70 complex,specialized in thermotolerance to chronic heat stress in arabidopsis[J].Plant Physiology,2012,158:747 - 758.
[2]WU Y Y,MATTHEW W,SOPHIE B,et al.Functional identification of two nonredundant arabidopsis(1,2)fucosyltransferases specific to arabinogalactan proteins[J].The Journal of Biological Chemistry,2010,285(18):13638-13645.
[3]CHANHUI L,ZHONG R Q,YE Z H.Arabi dopsis family GT43 members are xylan xylosyltransferases required for the elongation of the xylan backbone[J].Plant Cell Physiol,2012,53(1):135 -143.
[4]KATO K,MATSUMOTO T,KOIWAI S,et al.Liquid suspension culture of tobaco cells[M]//TERUI G.Ferment Technology Today.Osaka:Society of Fermentation Technology,1972:689 -695.
[5]XIN G,GÜNTHER B,PETER N.The cytoskeleton is disrupted by the bacterial effector HrpZ,but not by the bacterial PAMP flg22,in tobacco BY -2 cells[J].Journal of Experimental Botany,2013,64(7):1805 - 1816.
[6]赵术珍,毕玉平.拟南芥室内繁种技术的改进[J].山东农业科学,2011,3:50-51.
[7]吴科瀛,梁玉玲.烟草BY2细胞培养及盐胁迫研究[J].畜牧与饲料科学,2009,30(4):8-9.
[8]萨姆布鲁克 J,拉塞尔 D W.分子克隆实验指南(上下册)[M].黄培堂,译.北京:科学出版社,2005.
[9]张好富,张宪银.一种不依赖于无菌培养的拟南芥活体转基因种子筛选方法[J].浙江大学学报:农业与生命科学版,2009,35(4):372 -376.
[10]刘守伟,刘士勇.拟南芥室内培养技术研究[J].东北农业大学学报,2007,38(2):279-281.
