pH,DO及铁细菌对Fe2+氧化的影响研究
2013-10-22魏志勇王亚娥马智慧
魏志勇,王亚娥,李 杰,马智慧
(兰州交通大学 环境与市政工程学院,甘肃兰州 730070)
生物海绵铁体系除磷是将零价的海绵铁以一定的方式介入到活性污泥系统中,利用Fe0在体系中的电化学及生物化学腐蚀作用不断释放出Fe2+,进而被氧化成Fe3+,从而实现高效除磷的一种方法[1]。污水中的磷主要以等形式存在[2],由于磷酸根与Fe3+结合形成沉淀的可能性远大于与结合形成沉淀的可能性[3],而铁细菌是指能将 Fe2+氧化成Fe3+,并从中获得能量的一类细菌的总称[4]。因此,研究铁细菌在Fe2+氧化过程中的作用,对于搞清生物海绵体系中铁与微生物协同除磷机理有着重要的意义。本文通过正交试验考察了DO,p H值及铁细菌对Fe2+氧化的影响。
1 材料与方法
1.1 铁细菌的分离与富集
1.1.1 菌种来源
接种污泥取自本实验中投放Fe0的SBBR(序批式生物膜反应器)反应器,该反应器有效容积为0.36 m3,生物载体除Fe0外,还投放一定比例的具有自主知识产权的纳米凹凸棒土复合亲水性聚氨酯泡沫填料。该反应器已稳定运行1年多,污泥具有较高的微生物活性。主要性质指标见表1。
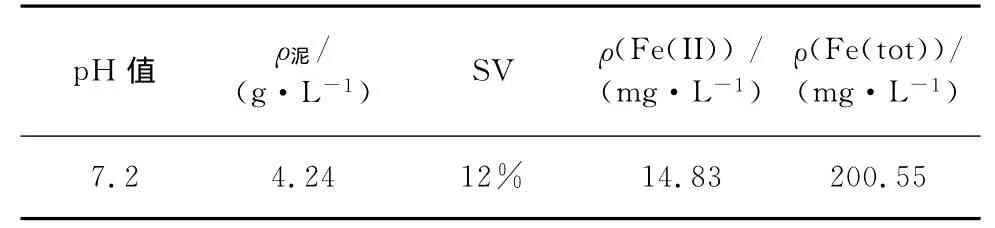
表1 试验接种污泥性质
1.1.2 培养基
本实验采用 Winogradsky培养基[5],具体组成见表 。

表2 Winogradsky铁细菌培养基
按表2称取上述试剂,并将其溶于1 000mL的蒸馏水中,在121℃下高压灭菌20 min即形成液体培养基,在液体培养基加入琼脂后,再经过高压灭菌则形成固体培养基。
1.1.3 分离增菌的方法
将取自上述反应器中活性污泥混合液经沉淀后取其上清液作为菌源,并将其接种于上述液体培养基中,放置在生化培养箱中进行恒温培养。培养10 d后,发现液体培养基中出现少许絮体,而后转变为赭黄色时,将其挑取少许制成水浸片,在显微镜下观察。取下玻片,在盖玻片的一侧加2%K3Fe(CN)6和10% 盐酸各1滴;在另一侧,用吸水纸吸去多余的水分,然后置于显微镜下观察形态。观察发现菌丝或粘液变为蓝色,证明有铁的沉淀物。即Fe3+与黄血盐作用形成普鲁氏蓝,说明所镜检的细菌为铁细菌[6]。
挑取菌液采用平板涂布的方法在固体培养基上,并将其放置在恒温生化培养箱中进行进一步培养,在固体培养基长出的菌落具有明显的金属光泽,说明培养出的细菌为铁细菌。
1.2 试验试剂及仪器
试验试剂:硫酸亚铁、缓冲溶液、普通氮气。
铁细菌菌液:每毫升中含有0.126 1 g铁细菌。
测定方法:试验中水质指标依据国家环境保护总局规定的水和废水监测分析方法进行测定,具体指标及分析方法见表3。

表3 试验水质指标的分析方法
1.3 实验方法
通过0.1 mol/L的缓冲溶液将硫酸亚铁溶液调节成不同的p H值,依靠向反应器中充入氮气来调节DO,并加入不同量的铁氧化菌,通过控制DO,p H值及菌量3个条件设计正交实验表,见表4。分别在1,2,3,5,10,20,30,60,90,120 min时取样,测上清液中的Fe2+的浓度,同时测定ORP值(氧化还原电位),实验温度为20℃。
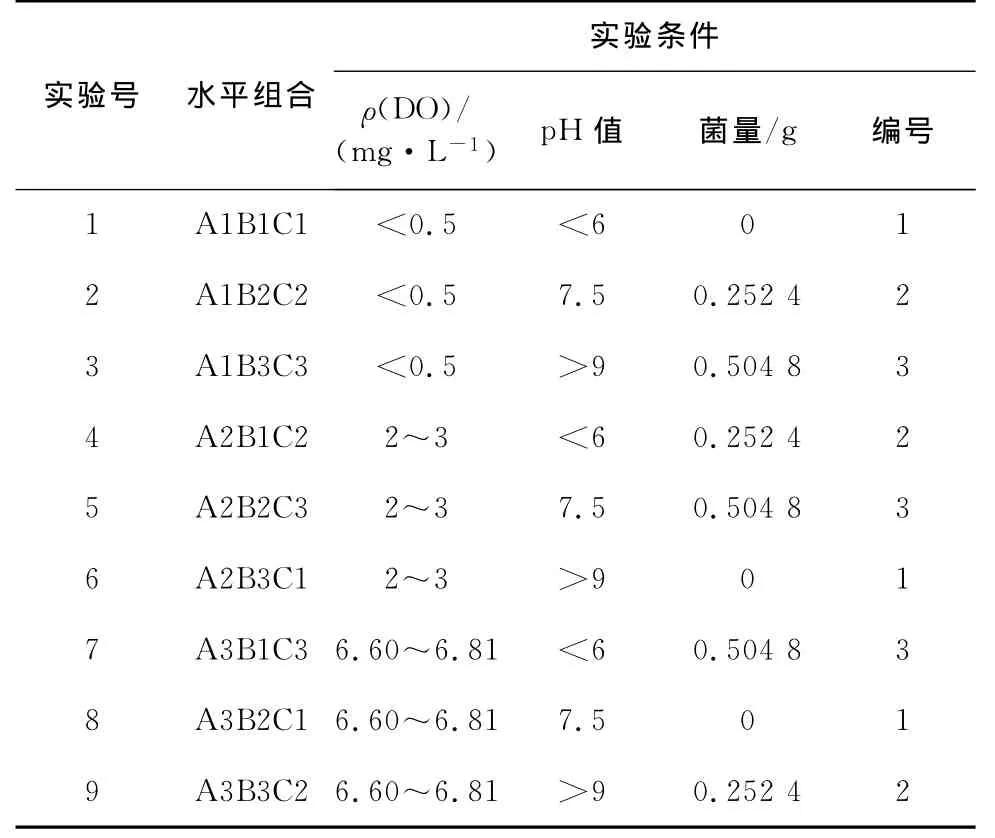
表4 正交实验表格
2 结果与讨论
2.1 不同体系中Fe3+浓度随时间的变化规律
实验中,随着反应的进行,Fe2+会被氧化而形成Fe3+,Fe3+的生成量反应了不同实验条件下体系的氧化能力。反应开始阶段加入的是硫酸亚铁,因此起始的Fe2+浓度即为总铁浓度,而此时的Fe3+浓度为0,随着反应的进行,根据Fe2+的减少量,可以计算出生成Fe3+的量,根据最后时刻的Fe3+浓度及反应时间,计算出各体系中的Fe3+生成速率,结果如表5所示。
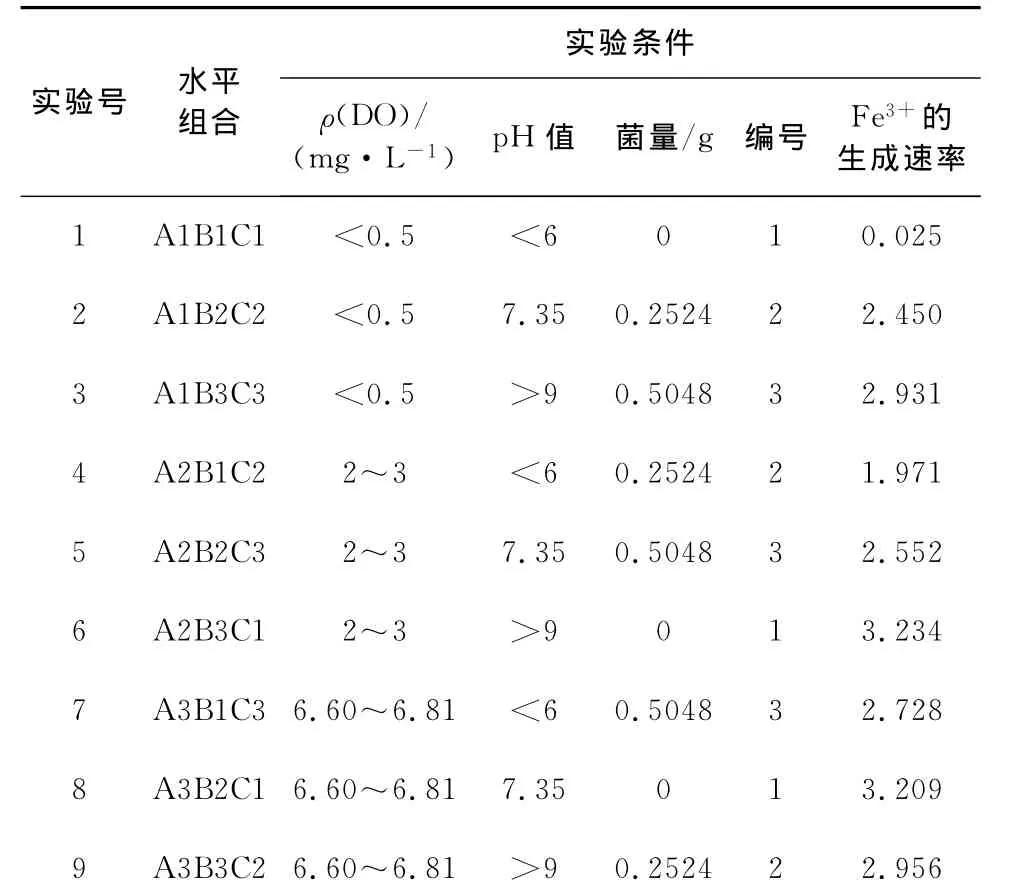
表5 正交实验结果分析
不同体系中Fe3+随时间的变化规律如图1所示。可以看出,除1号实验外,其余8组实验中Fe3+的浓度都随反应的进行而增加。在30min之前,Fe3+浓度的增加很快,而30min之后,Fe3+的浓度增长速率较慢,说明了在这样一种体系中,Fe2+的氧化速率呈现为先快后慢。而所有9组实验又体现出了不同体系中对Fe2+氧化能力的不同,说明了不同的pH值,DO及铁细菌加量条件下,体系对于Fe2+的氧化能力也有差异。1号实验中Fe3+基本没有检测到,很可能就是由于较低的DO,pH值及菌量不利于Fe2+的氧化。
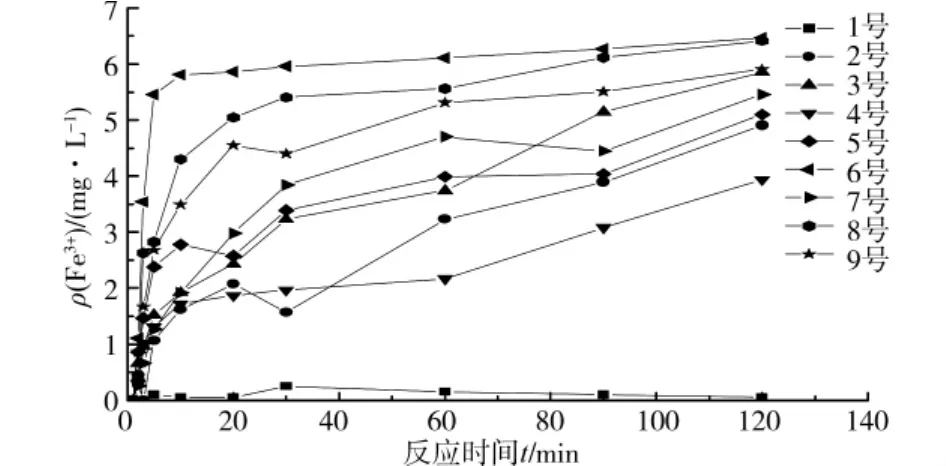
图1 不同系统中Fe3+随时间的变化
2.2 不同体系中ORP随时间的变化规律
经过对9组实验的对比(如图2),发现ORP值呈现出了一个共同的变化趋势:在pH值为4.91时,ORP值一直保持在200左右,比较恒定;当pH值为7.35时,ORP值呈上升的趋势,在最后的时刻达到了210左右;而当pH值为9.21时,ORP值不稳定,上下波动的幅度较大。此外,ORP的变化与Fe3+的变化也基本一致,即在30min之前上升较快,30min之后趋于稳定,总体呈现增加的趋势。分析原因:氧化还原电位就是用来反映水溶液中所有物质表现出来的宏观氧化-还原性。氧化还原电位越高,氧化性越强,电位越低,氧化性越弱。电位为正表示溶液显示出一定的氧化性,为负则说明溶液显示出还原性[7]。实验数据中的ORP值为正值,则说明有铁氧化菌存在的硫酸亚铁的混合溶液具有一定的氧化性。
2.3 极差分析
2.3.1 Fe3+浓度的极差分析
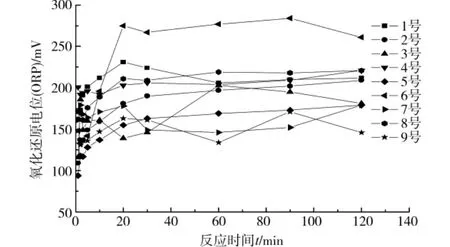
图2 ORP随时间的变化曲线
对表5中的试验结果进行极差分析,分析结果见表6,可知,RDO=1.16,RpH=1.46,R菌量=0.581。由于极差的大小反映了相应因素作用的大小,极差大的因素,意味着其不同水平给指标所造成的影响较大,且通常是主要因素。由此看来,RpH>RDO>R菌量,则得各影响因素的主次顺序为:pH值,DO,菌量。分析原因,硫酸亚铁暴露在空气中,或者加入碱极易被氧化。而正交试验中,溶液中的pH值为7.35和9.21,这就加快了Fe2+的氧化速度,硫酸亚铁极易被氧化。同时,由于介入的铁氧化菌的适宜生长环境为酸性环境,本实验中培养富集的铁氧化菌生长pH值为6。在正交实验中,pH值远大于铁氧化菌的适宜生长值,过高的pH值可能会令微生物活性受到抑制[8]。
DO过高不利于细菌的生长,有时候甚至对菌体产生毒害作用,氧的有害作用是通过形成超氧化基,过氧化基或者羟基自由基,破坏细胞内组分来体现的[9-11]。好氧菌的体内产生的过氧化物歧化酶(SOD)可以降解体内产生的有毒物质,若过氧负离子过多,由于氧气在水中的传质系数很小,导致气液传质阻力大,就会对菌体产生毒害作用[12]。虽然铁氧化菌是好氧菌,然而培养过程中并不是维持DO越高越好,即使是专性好氧菌,过高的DO对其生长可能带来不利的影响。因此在正交试验中,过高的DO反而不利于铁氧化菌进行自身的新陈代谢,也就导致了铁氧化菌在Fe2+氧化作用中,并不是主导因子。
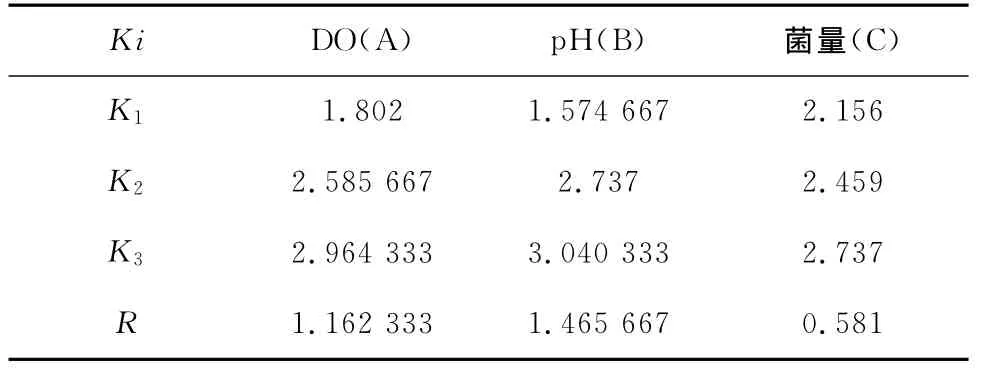
表6 Ki指标及极差计算
另外,从最优化条件产生来看,若在同一因素下,Ki值越大,说明在i水平下的相对指标越好,则由表6的计算分析值可知,在DO,pH和菌量因素下的K3分别在各自因素条件下最大,A3B3C3为该试验条件下的最佳搭配。
2.3.2 ORP极差分析
对各个体系在反应最终时刻的ORP进行极差分析,分析结果见表7。
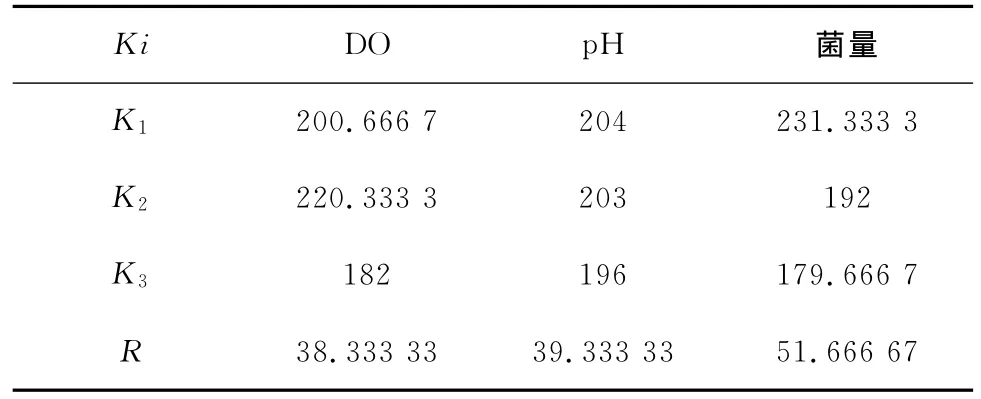
表7 ORP极差分析
从表7的极差分析结果可以看出,R菌量>RpH>RDO,则得各影响因素的主次顺序为:菌量,p H值,DO,说明铁细菌对于体系的氧化还原电位的影响最大,分析原因:氧化还原电位受溶液温度、p H及化学反应可逆性等因素影响[13],在体系中存在大量铁细菌的呼吸作用会消耗一定量的氧气,从而影响到体系的氧化还原电位。
2.4 方差分析
为进一步了解试验过程因素水平的变化对试验结果影响的程度,根据表5中的Fe3+生成速率的值进行相关的方差分析,得出表8的分析结论。
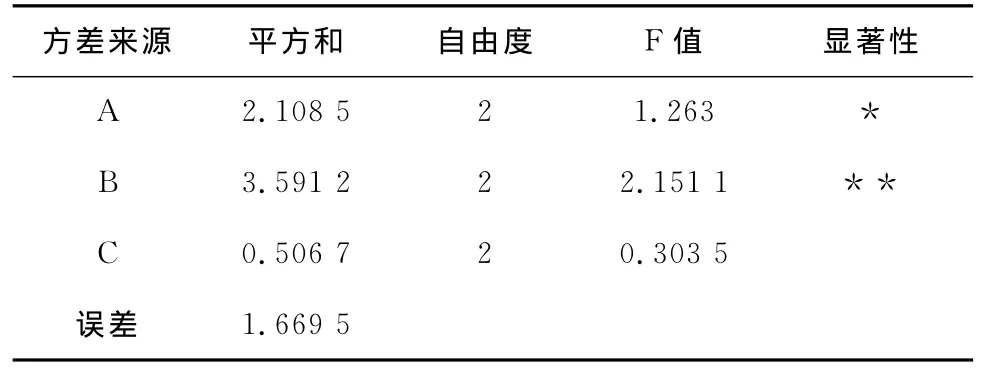
表8 F检验方差分析表
分析结论:A代表DO,B代表p H值,C代表菌量。F(1-α/2)<FB/FA<F(α/2),F(1-α/2)<FA/FC<F(α/2),F(1-α/2)<FB/FC<F(α/2)。F(α/2)=39,F(1-α/2)=0.025 6。在上述正交实验表中,方差平方和,以B的最大,其次是A,最小的是C,可以初步得出影响因素的排序时B>A>C。根据上述F检验的理论,其中,在因子A中,以6~7 mg/L的影响最大,同理,在因子B中以9.2影响最大,在因子C中以0.5 g的影响最大,这与极差分析的结果一致。
3 结论
经过以上试验及探讨,针对在有铁氧化菌存在的情况下,对于硫酸亚铁的氧化而言,可得出以下结论:
(1)Fe2+的氧化速率呈现为先快后慢,且较低的DO,p H值,及较少的菌量不利于Fe2+的氧化;
(2)p H,DO及铁细菌对于Fe2+的氧化均有一定的影响,且影响Fe2+氧化的因素排序是p H值、DO、投加的菌量,过高的DO反而不利于铁氧化菌进行自身的新陈代谢作用,也就导致了铁氧化菌在Fe2+氧化作用中,并不是主导因子。
(3)铁细菌的加入对于体系的ORP的影响最大,其次为p H值和DO。
[1]陆敏博,王世和.富磷上清液铁接触除磷工艺及影响因素[J].环境工程学报,2008,2(9):1 163-1 168.
[2]张永勇,张光义,夏 军,等.湿地污水处理机理的研究[J].环境科学与技术,2005,28(6):165-167.
[3]孟顺龙,裘丽萍,陈家长,等.污水化学沉淀法除磷研究进展[J].中国农学通报,2012,28(35):264-268.
[4]马智慧,王亚娥,李 杰.铁氧化菌特性及其在环境污染治理中的应用[J].环境科学与管理,2011,36(11):67-71.
[5]李惠珍,许旭萍.铁-锰氧化鞘细菌的生境条件及分离鉴定[J].水生生物学报,1999(4):311-315.
[6]耿海波,安丽平,郭 英,等.新疆十红滩砂岩型铀矿床中微生物多样性[J].生态学杂志,2009,28(4):710-714.
[7]于天仁,刘畹蘭.水稻土中氧化还原过程的研究 (Ⅲ)氧化还原条件对水稻生长的影响[J].土壤学报,1957,4:002.
[8]Weber K A,Achenbach L A,Coates J D.Microorganisms pumping iron:anaerobic microbial iron oxidation and reduction[J].Nature Reviews Microbiology,2006,4(10):752-764.
[9]彭永臻,郭建华,王淑莹,等.低溶解氧污泥微膨胀节能理论与方法的发现,提出及理论基础[J].环境科学,2008,29(12):3 342-3 347.
[10]Wang X M,Waite T D.Iron speciation and iron species transformation in activated sludge membrane bioreactors[J].Water research,2010,44(11):3 511-3 521.
[11]石天虹,刘雪兰,刘 辉,等.微生物发酵的影响因素及其控制[J].家禽科学,2005,2:45-48.
[12]陈淮杨,刘望夷.从超氧化物歧化酶的分布和结构看,分子进化[J].生物化学与生物物理进展,1996,23(5):408-413.
[13]贺明宇.以氧化还原电位控制Fenton反应处理模拟苯酚废水[D].西安:西安建筑科技大学,2010.
