Pb、Cd 单一及复合胁迫对桂花幼苗生理生化特性的影响
2013-10-22聂小倩黄应平
王 飞,胥 焘,张 晟,郭 强,聂小倩,黄应平
(1.三峡库区生态环境教育部工程研究中心(三峡大学),湖北 宜昌 443002;2.重庆市环境科学研究院,重庆 401147)
环境中以单一重金属元素造成污染的情况很少,常是多种重金属元素构成复合污染,因此研究复合污染的治理更为实用。在治理重金属污染的众多方法中,植物修复技术受到人们的普遍关注,该方法具有投资和维护成本低、操作简单、不造成二次污染、保护表土、减少侵蚀和水士流失等特点[1]。植物修复的关键技术是选育出对污染元素有较强吸收能力的超富集植物(hyperaccumulator)。迄今为止,筛选出的重金属超富集植物有400多种[2],其中,80%是镍的超富集植物[3]。而对Pb和Cd同时具有超富集作用的植物种类很少[4]。目前,有关Pb、Cd单一胁迫对植物生长影响的研究已较多,但是对于Pb、Cd复合胁迫对植物生长影响的研究相对较少。
桂花(Osmanthus fragrans(Thunb.)Lour)是长江流域广泛栽植的城市绿化、公路行道、园林景观树种,不仅具有绿化环境、净化空气、美化景观等环境效益,而且具有重要的药用价值[5]。而关于桂花的研究,目前主要集中在探讨水分胁迫对其生长的影响,有关重金属污染对其生长的影响鲜有报道。因此研究重金属胁迫对桂花生长的影响,具有重要意义。本文采用含有不同浓度重金属的土壤种植桂花幼苗,通过分析桂花幼苗生理生化指标的变化,探讨Pb、Cd单一及复合胁迫对桂花幼苗生长的影响。
1 材料与方法
1.1 供试材料
桂花幼苗于三峡植物园繁育基地内购买,选取生物量大致相同的桂花幼苗,进行盆栽实验。
1.2 试验方法
本实验采用规格为280 mm×320 mm的花盆,每盆装4 kg土壤,种植3棵植株。供试土壤取自三峡大学翠屏山,基本理化性质如下:p H值6.8,有机质0.74%,Pb质量比为85.34 mg/kg,Cd质量比为0.39 mg/kg,TP质量比为244.02 mg/kg,TN质量比为537.61 mg/kg。
重金属Pb、Cd试验浓度设置分单一和复合胁迫,其中单一胁迫 Pb质量比分0,50,100,500,1 000和2 000 mg/kg 6个处理组,Cd质量比分0,1,10,50,100,200 mg/kg 6个处理组,复合胁迫有100 mg/kg Pb + (0,1,10,50,100,200 mg/kg)Cd及10 mg/kg Cd+ (0,50,100,500,1 000,2 000 mg/kg)Pb共12个处理组,每处理3个重复,各浓度以纯Pb、Cd计。试验在温室内进行,植株处理6个月后采样分析。
1.3 生理生化指标测定
叶片色素含量的测定:取0.1 g桂花幼苗叶片加入质量分数80%丙酮溶液,浸提24 h后,于665,645 nm处测定光密度,单位为 mg/g(以鲜重计)[6]。
POD活性的测定:采用愈创木酚法,称取0.1 g桂花幼苗叶片在液氮下研磨,加入预冷的磷酸盐缓冲液(p H 值7.8),然后在4℃ 下离心30 min(10 000 r/min),上清液在470 nm 测定光密度,单位为ku/kg表示(以鲜重计)[7]。
丙二醛(MDA)含量测定:采用硫代巴比妥酸显色法,丙二醛(MDA)含量单位为umol/kg表示(以鲜重计)[8]。
1.4 统计分析
所有检测重复3次,在计算机上用 Microsoft Excel 2003进行平均值和标准差的运算,结果以Mean±SD形式表示。采用SPSS和ORIGIN软件分析数据和作图,采用单因素方差分析进行显著性检验。各表中,小写字母表示同一生长指标不同处理之间的差异,同一列中字母相同表示差异不显著(P>0.05),字母不同表示差异显著(P<0.05)。
2 结果与分析
2.1 不同浓度Pb、Cd处理对桂花幼苗叶绿素含量的影响
桂花幼苗的叶绿素a、叶绿素b和叶绿素a+b含量具有一致的变化规律,都随着重金属处理浓度的升高而下降,叶绿素a/b值随着重金属处理浓度的升高表现为先升后降趋势(见表1~表4)。重金属单独胁迫下,Pb处理为1 000 mg/kg时,与对照相比,桂花幼苗叶绿素a含量下降幅度为26.7%,Cd处理为100 mg/kg时,与对照相比,桂花幼苗叶绿素a含量下降幅度为36.7%,均达到了显著水平。Pb、Cd复合胁迫下,处理浓度为10 mg/kg Cd+2 000 mg/kg Pb时,与单独10 mg/kg Cd处理相比,叶绿素b含量下降幅度为36.4%,处理浓度为100 mg/kg Pb+200 mg/kg Cd时,与单独100 mg/kg Pb处理相比,叶绿素a含量下降幅度为35.5%,均达到了显著水平。
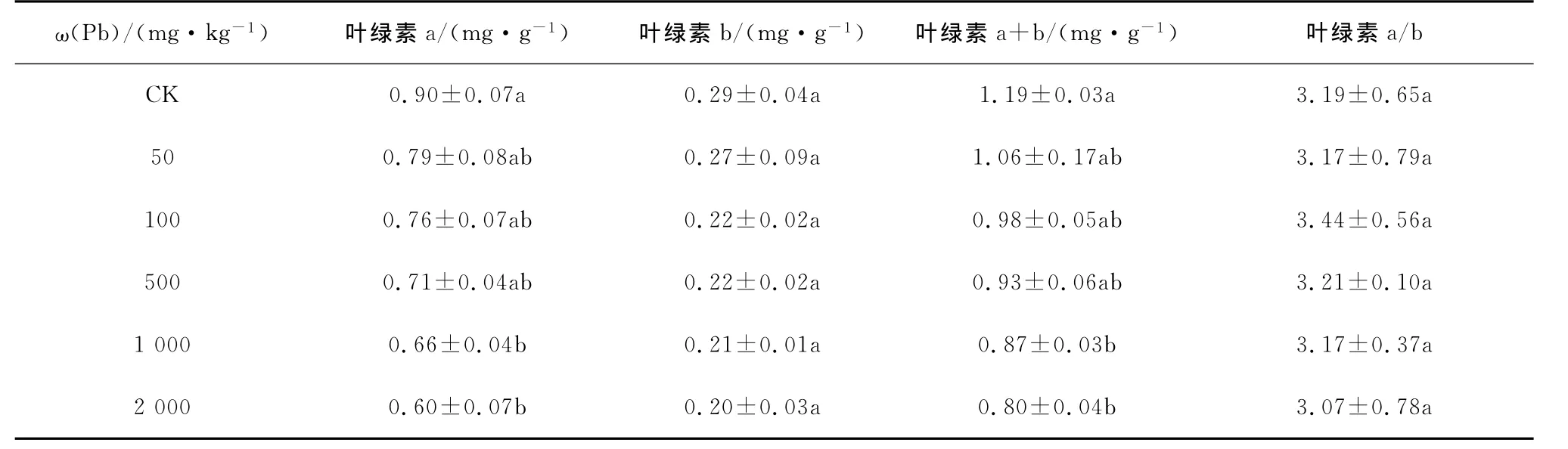
表1 Pb处理对桂花叶绿素含量的影响
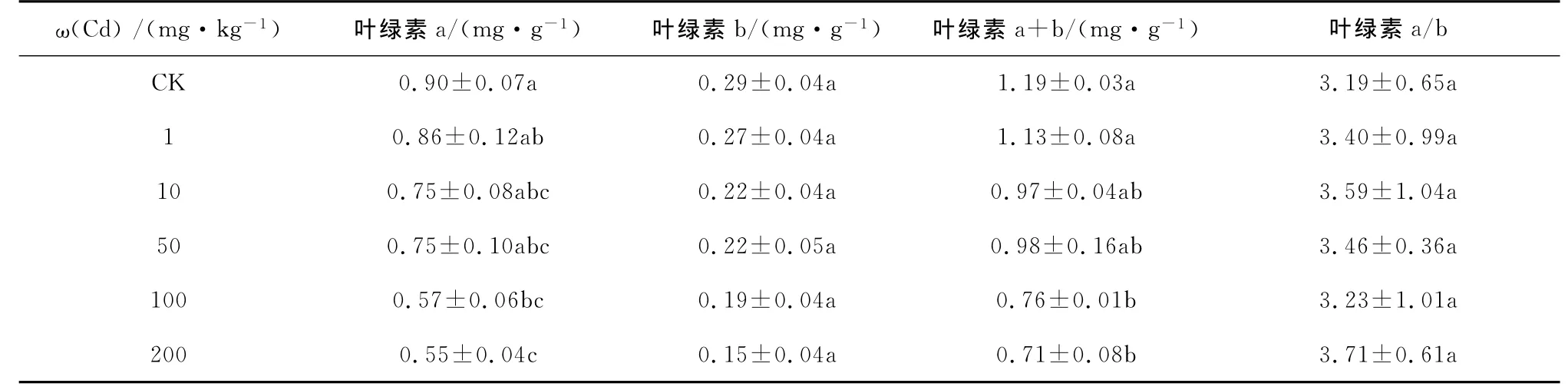
表2 Cd处理对桂花叶绿素含量的影响

表3 Pb和10 mg·kg-1 Cd复合胁迫对桂花叶绿素含量的影响
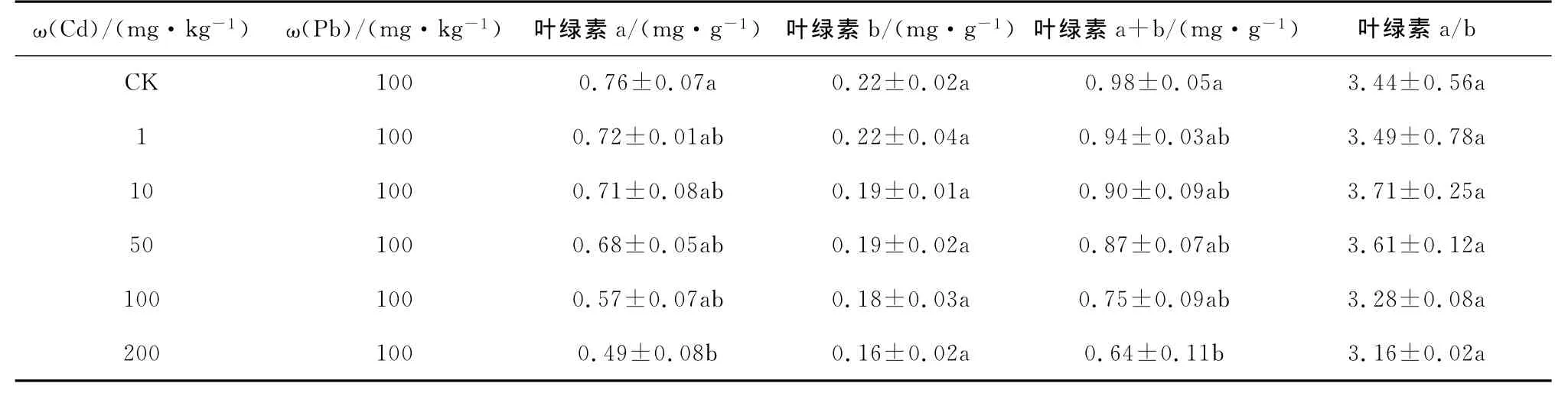
表4 Cd和100 mg·kg-1 Pb复合胁迫对桂花叶绿素含量的影响
2.2 不同浓度Pb、Cd处理对桂花幼苗POD活性的影响
在重金属Pb单一及固定每组10 mg/kg Cd处理和Pb不同处理浓度复合胁迫下,桂花幼苗叶中POD活性随Pb处理浓度的增加先升高后下降(见图1)。在Pb单一处理浓度为500 mg/kg时,POD活性最高,较对照增加了337.4%,尔后POD活性逐渐降低。固定每组10 mg/kg Cd处理,Cd和Pb复合胁迫下,在Pb处理浓度为500 mg/kg时,POD活性最高,与单独10 mg/kg Cd处理相比增加了136.4%,尔后POD活性逐渐降低。经单因素方差分析,Pb单一及固定每组10 mg/kg Cd处理和Pb不同处理浓度复合胁迫下,桂花幼苗叶中POD活性差异显著。
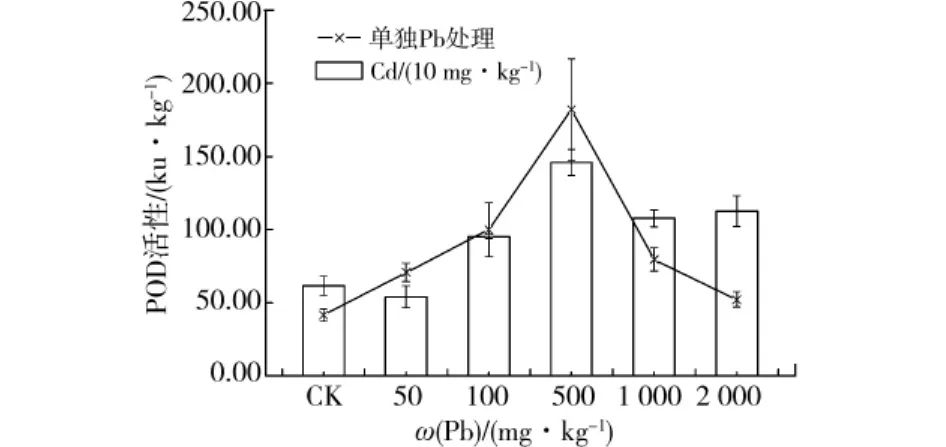
图1 Pb、Cd单一及复合胁迫不同Pb处理下桂花幼苗叶片中POD活性
在重金属Cd单一及固定每组100 mg/kg Pb和不同浓度Cd处理复合胁迫下,桂花幼苗叶中POD活性随Cd处理浓度的增加先升高后下降(图2)。在Cd单一处理浓度为50 mg/kg时,POD活性最高,较对照增加了228.4%,尔后POD活性逐渐降低。固定每组100 mg/kg的Pb处理,Cd和Pb复合胁迫下,在Cd处理浓度为1 mg/kg时,POD活性最高,与单独100 mg/kg Pb处理相比增加了58.27%,尔后POD活性逐渐降低。经单因素方差分析,Cd单一及固定100 mg/kg Pb处理和Cd不同处理浓度复合胁迫下,桂花幼苗叶中POD活性差异显著。
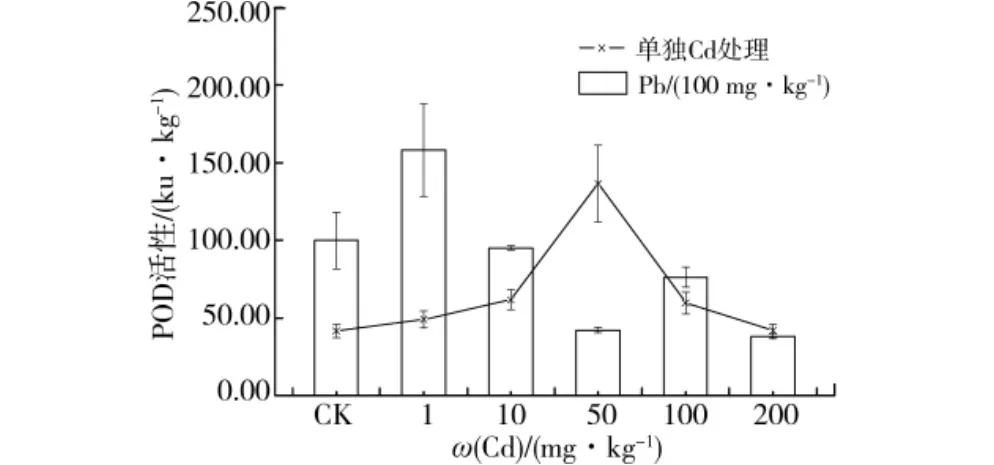
图2 Pb、Cd单一及复合胁迫不同Cd处理下桂花幼苗叶片中POD活性
2.3 不同浓度Pb、Cd处理对桂花幼苗MDA含量的影响
图3表示的是铅、镉单一及复合胁迫不同浓度铅处理下桂花幼苗叶片中MDA含量变化。从中可以看出,桂花幼苗在Pb单一及固定每组10 mg/kg Cd处理和Pb不同处理浓度复合胁迫下,叶中MDA含量均随着重金属处理浓度的增加而升高。且具有很好的线性关系,决定系数分别为0.723 2和0.748 0。在Pb单一处理浓度为2 000 mg/kg时,MDA含量最高,较对照增加了192.7%,在10 mg/kg Cd处理和Pb不同处理浓度复合胁迫下,复合处理浓度为10 mg/kg Cd+2 000 mg/kg Pb时,MDA含量最高,较10 mg/kg Cd单独处理增加了109.1%。经单因素方差分析,Pb单一及固定每组10 mg/kg Cd处理和Pb不同处理浓度复合胁迫下,桂花幼苗叶中MDA含量差异显著。
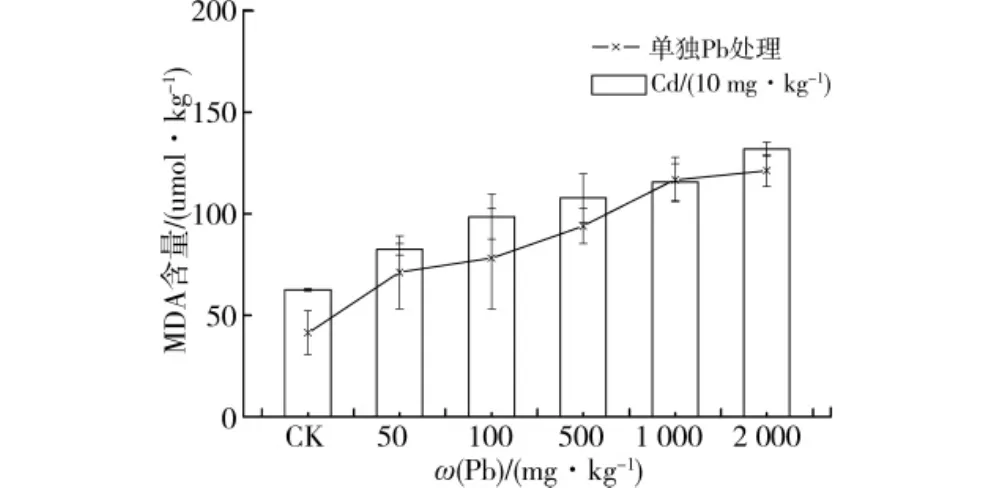
图3 Pb、Cd单一及复合胁迫不同Pb处理下桂花幼苗叶片中MDA含量变化
在重金属Cd单一及固定每组100 mg/kg Pb和不同浓度Cd处理复合胁迫下,桂花幼苗叶中MDA含量随Cd处理浓度的增加而升高(图4)。且具有很好的线性关系,决定系数分别为0.935 6和0.812 7。在Cd单一处理浓度为200 mg/kg时,MDA含量最高,较对照增加了156.2%,在固定每组100 mg/kg Pb和不同浓度Cd处理复合胁迫下,复合处理浓度为100 mg/kg Pb+200 mg/kg Cd时,MDA含量最高,较100 mg/kg Pb单独处理增加了63.0%。经单因素方差分析,在Cd单一及固定每组100 mg/kg Pb和不同浓度Cd处理复合胁迫下,桂花幼苗叶中MDA含量差异均显著。
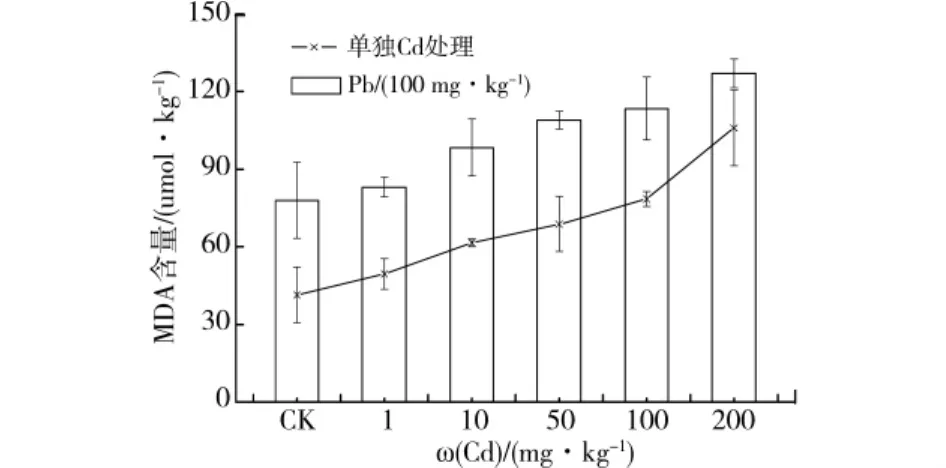
图4 Pb、Cd单一及复合胁迫不同Cd处理下桂花幼苗叶片中MDA含量变化
3 讨论
叶绿素是植物光合作用的物质基础,其含量高低决定植物光合作用水平[9]。本试验中,Pb、Cd单一及复合胁迫下桂花幼苗叶绿素均呈下降趋势,且差异均显著。这与王启明[10]、徐学华等[11]研究结果一致。逆境胁迫下叶绿素含量下降的主要原因是,当Pb、Cd等重金属离子进入植物体内以后,会通过蛋白质上的巯基结合或者取代叶绿体中的Mg2+和Fe2+,从而作用于叶绿素生物合成途径中的叶绿素酯还原酶和胆色素原脱氨酶等,改变其结构,抑制酶的活性,阻碍叶绿素的合成。另有研究证明,重金属胁迫作用于植物细胞上的主要部位是膜系统[12-13],因此Pb、Cd能使叶绿体被膜消失,造成叶绿体不可逆损伤,导致叶绿素含量降低。
研究表明超富集植物对重金属具有较强的耐性机制,一方面在于液泡的区室化作用和植物体内某些有机物(如MTs、PCs和有机酸等)对重金属的螯合作用,降低了重金属的毒性[14-16]。另一方面可能在于某些抗氧化酶系统如过氧化物酶(POD)等的反应[17-18]。本研究结果表明,桂花幼苗受到 Pb、Cd单一及复合胁迫,叶中POD活性随着重金属处理浓度的增加均先升后降。且100 mg/kg Pb和不同浓度Cd处理复合胁迫较Cd单独处理,叶中POD活性先到达最大值,这可能是因为Pb和Cd对桂花幼苗的毒性产生了叠加作用。POD是植物体内清除活性氧伤害的酶保护系统之一,在除超氧自由基、控制膜脂的过氧化作用和保护细胞膜的正常代谢方面起重要作用,将H2O2催化形成H2O,从而有效阻止和H2O2的积累,限制这些自由基对膜脂过氧化的启动[19]。Van Assche等[20]研究还发现,许多植物对重金属的共同响应为组织中的POD活性明显升高,说明其抗氧化酶系统在加强植物抗性方面起到重要作用。然而,酶的保护作用是有一定限度的,即使是耐性植物,其酶活性也存在一个阈值,超过这个范围,它们的活性则要下降[21]。
植物在逆境下,细胞膜会发生膜脂过氧化作用,而丙二醛是膜脂过氧化作用的产物,故MDA含量常用来表示植物对逆境条件反应的强弱[22]。本实验条件下,桂花幼苗MDA含量随重金属处理浓度的增加而增加。且同一条件下,重金属复合胁迫叶中MDA含量较单独胁迫要高。桂花幼苗生长过程中,在Pb、Cd胁迫下,活性氧产生和清除的代谢系统失调,活性氧和自由基在体内过量累积,造成膜脂过氧化,从而MDA含量升高。
4 结论
(1)高浓度Pb处理(1 000~2 000 mg/kg)和Cd处理(100~200 mg/kg)对桂花幼苗的生理生化特征产生了一定的负效应。Pb、Cd复合胁迫较单一胁迫,对植物的毒害作用有所加强。
(2)桂花幼苗对重金属Pb、Cd有较好的耐性,是修复Pb、Cd污染区的潜力物种。
[1]邓春光,任照阳.浅谈植物修复技术在三峡库区富营养化修复中的应用[J].安徽农业科学,2007,35(5):1 479-1 480.
[2]聂发辉.关于超富集植物的新理解[J].生态环境,2005,14(1):136-138.
[3]庹瑞锐,赵运林,董 萌,等.土壤重金属镉、铅污染的植物修复技术研究进展[J].贵州农业科学,2011,39(6):216-220.
[4]魏树和,周启星.杂草中具重金属超积累特征植物的筛选[J].自然科学进展,2003(12):1 259-1 265.
[5]陈洪国,周开兵,张红艳.三个桂花品种生长量、花量及叶片矿质营养含量变化研究[J].武汉植物学研究,2008,26(1):108-112.
[6]Hegedüs A,Erdei S,Horváth G.Comparative studies of H2O2detoxifying enzymes in green and greening barley seedling under cadmium stress[J].Plant Sci,2001,60:1 085-1 093.
[7]朱广廉.植物生理学实验指导[M].北京:北京大学出版社,1990.
[8]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002.
[9]秦天才,吴玉树,王焕校,等.镉、铅及其相互作用对小白菜根系生理生态效应的研究[J].生态学报,1998,18(3):320-325.
[10]王启明.铅·镉单一及复合胁迫对玉米幼苗生理生化特性的影响[J].安徽农业科学,2006,34(10):2 036-2 037.
[11]徐学华,黄大庄,王连芳,等.土壤铅、镉胁迫对红瑞木生长及生理生化特性的影响[J].水土保持学报,2009,23(1):213-216.
[12]张金彪,黄维南.镉胁迫对草莓光合的影响[J].应用生态学报,2007,18(7):1673-1676.
[13]徐勤松,施国欣,杜开和.锌胁迫下水车前叶细胞自由基过氧化损伤与超微结构变化之间关系得研究[J].植物学通报,2001,18(5):597-604.
[14]孙瑞莲,周启星.高等植物重金属耐性与超积累特性及其分子机理研究[J].植物生态学报,2005,29(3):497-504.
[15]Alkorta J,Hernández A J M,Becerril I,et al.Chelate-enhanced phytoremediation of soils polluted with heavymetals[J].Environ Sci Bio/Technol,2004,3(1):55-70.
[16]Vazquez M D,Poschenrieder C,Bareelo J,et al.Compartment of zinc in roots and leaves of the zinc hyperaccumulator Thlasp icaerulescens[J].Botany Acta,1994,107:243-250.
[17]Sun R L,Zhou Q X,Sun F H,et al.Antioxidantive defense and proline/phytochelatin accumulation in a newly discovered Cd-hyperaccumulator,Solanum nigrum L.[J].Environ Exp Bot,2007,60:468-476.
[18]Cao X D,Ma Lena Q,Tu C.Antioxidative responses to arsenic in the arsenic-hyperaccumulator Chinese brake fern(Pteris vittataL.)[J].Environ Pollut,2004,128:317-325.
[19]张太平,潘伟斌.重金属污染环境来源的玉米POD对Pb的胁迫反映[J].华南理工大学学报:自然科学版,2003,31(2):5-8.
[20]Van Assche F,Clijsters H.Effects of metal on enzyme activity in plants[J].Plant Cell Environ,1990(13):195-206.
[21]王美娥,周启星.重金属Cd、Cu对小麦(Triticum aestivum)幼苗生理生化过程的影响及其毒性机理研究[J].环境科学学报,2006,26(12):2 033-2 038.
[22]杨居荣,黄 翌.植物对重金属的耐性机理[J].生态学杂志,1994,13(6):20-26.
[23]张金彪,黄维南.镉对植物的生理生态效应的研究进展[J].生态学报,2000,20(3):514-523.
