P5增强卵巢癌细胞顺铂敏感性的体外研究
2013-10-22胡晓明范永娟瞿全新
胡晓明,范永娟,瞿全新
(天津医科大学第一中心临床学院妇产科,天津300192)
卵巢癌在女性生殖器恶性肿瘤中的发病率占第三位,但死亡率却居第一位。尽管已广泛开展肿瘤细胞减灭术及以铂类为基础的联合化疗,但卵巢癌患者5年存活率仍徘徊于20%~30%[1],10年生存率约4%~20%。由于缺乏特异的临床症状和相应的早期诊断手段,大部分卵巢恶性肿瘤患者就诊时已属晚期,其中约有15%~25%的卵巢上皮癌患者对以铂类为基础的联合化疗方案原发耐药,而所有化疗病人至少80%会出现继发性顺铂(DDP)耐药,直接影响化疗效果及患者预后[2]。近年来,越来越多的研究探讨凋亡机制与肿瘤化疗敏感性的关系。P5是一种由人自然抑制细胞HNK-1(CD57)产生的凋亡诱导核苷(apoptosis inducing nucleosides,AINs),对正常细胞没有毒性,却能够诱导人白血病细胞凋亡,而且对胃癌、结肠癌、食管癌、前列腺癌、乳腺癌也起作用,而在卵巢癌中的作用却知之甚少。本研究主要观察P5对卵巢癌细胞DDP敏感性的影响,为改善卵巢癌患者预后提供新方法。
1 材料与方法
1.1 实验材料
1.1.1 细胞系 卵巢腺癌COC1细胞株来源于分化较差的卵巢癌患者腹水肿瘤细胞,由中国医学科学院肿瘤研究所建株[3],由中国医学科学院血液研究所提供。
1.1.2 试剂 P5由日本东京大学医学部免疫室赠送,注射用顺铂(冻干型)由齐鲁制药厂生产,细胞凋亡-Hoechst试剂盒购自碧云天生物技术公司。
1.2 实验方法
1.2.1 细胞培养条件 COC1细胞用含10%小牛血清的RPMI-1640完全培养基,于37℃、5%CO2、相对湿度90%的培养箱中培养,细胞悬浮生长。
1.2.2 MTT法测定 DDP、P5及 P5联合 DDP对COC1细胞生长的影响
1.2.2.1 MTT法测定DDP对COC1细胞生长的影响:取对数生长期COC1细胞,经消化后以5.6×103个细胞/孔接种到96孔板中,每孔160μL。每孔加入 40 μL DDP,使其终浓度为 100、50、25、12.5、6.25、3.125、1.562 5、0.781 25 μg/mL,每一浓度设4个平行孔。同时设置对照组(只含等体积细胞悬液,不加药物),空白调零孔(只含等体积完全培养基,不加药物)。培养板放入37℃、5%CO2、相对湿度90%的培养箱中培养72 h后取出,每孔加入20μL新配制的MTT溶液(5mg/mL),培养箱中孵育4 h,1 500 r/min×10min离心使细胞沉淀,弃掉培养基,每孔加150μLDMSO振荡10min使结晶物充分溶解,用酶标仪在570 nm处测定吸光值(A)。计算DDP对COC1细胞的抑制率。根据DDP浓度和抑制率,利用直线加权回归方程求得COC1对DDP的半数抑制浓度(IC50)。实验重复3遍,取平均值。细胞的抑制率=(1-加药组吸光值/空白对照组吸光值)×100%
1.2.2.2 MTT法测定P5对COC1细胞生长的影响:取对数生长期COC1细胞,经消化后以5.6×103个细胞/孔接种到96孔板中,每孔160μL。每孔加入 40 μLP5,使其终浓度分别为 400、200、100、50、25、12.5、6.25、3.125 μg/mL,每一浓度设 4 个平行孔。同时设置对照组,空白调零孔。继续培养24 h后,计算不同浓度P5对COC1细胞的抑制率,方法步骤同1.2.2.1节。
1.2.2.3 MTT法测定P5联合DDP对COC1细胞生长的影响:取对数生长期COC1细胞,经消化后以5.6×103个细胞/孔接种到96孔板中,每孔160μL。实验分为4组,即:P5200μg/mL+DDP组、P525μg/mL+DDP组、对照组、空白调零组,其中DDP分组如1.2.2.1,为8个浓度梯度,每一浓度设4个平行孔。每孔加入20μLP5,使其终浓度分别为200、25μg/mL。继续培养24 h后取出,每孔加入20μLDDP,使其终浓度为 100、50、25、12.5、6.25、3.125、1.562 5、0.781 25μg/mL。同时对照组、空白调零组每孔加含2%胎牛血清的RPMI1640培养基20μL。继续培养72 h后,计算不同浓度P5联合DDP对COC1细胞的抑制率,以及COC1细胞对DDP的IC50值,方法步骤同1.2.2.1节。
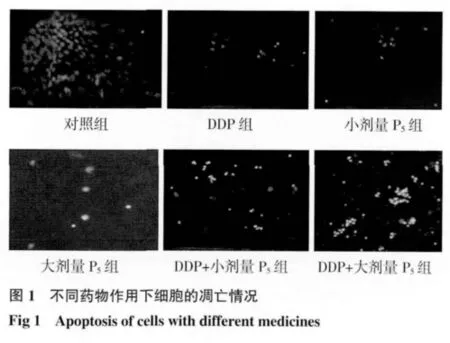
1.2.3 细胞凋亡的形态学观察 取5×105/mL浓度、对数生长期COC1细胞接种于6孔板内,分为DDP组、小剂量P5组、大剂量P5组、DDP+小剂量P5组、DDP+大剂量P5组、对照组,DDP终浓度为2.5μg/mL、小剂量P5终浓度为25μg/mL、大剂量P5终浓度为200μg/mL。培养24 h后,6孔板1 500 r/min离心10min,吸尽上清液,加入0.5mLHoechst固定液,固定1 h。再次离心去固定液,用PBS洗涤、离心去PBS,操作2遍。加入0.5mLHoechst染色液,染色5 min。吸尽Hoechst染色液,滴入抗荧光淬灭封片液封闭细胞,于荧光显微镜下观察并拍照。
1.3 统计学处理 采用SPSS10.0统计软件进行统计学分析,计量资料采用t检验,P<0.05作为有统计学意义的检验标准。
2 结果
2.1 DDP对COC1细胞生长的影响 COC1细胞对DDP 的 IC50值为(2.51±0.12)μg/mL。
2.2 不同浓度P5对COC1细胞生长的影响 见表1。不同浓度P5对COC1细胞抑制率较低,因此可认为

表1 不同浓度P5对COC1细胞生长的影响Tab1 Theeffectof thegrow th of COC1 cellwith different concentrationsof P5
此浓度范围内的P5对COC1细胞生长无抑制作用。
2.3 P5对COC1细胞DDP敏感性的影响 见表2、表3。小剂量及大剂量P5均能提高COC1细胞的DDP 敏感性(t=5.84,P<0.05;t=6.14,P<0.05),大剂量P5与小剂量P5对DDP敏感性的影响相近,无统计学差异(t=1.12,P>0.05)。

表2 不同浓度P5联合DDP对COC1细胞的抑制率(%)Tab2 The inhibition rateof COC1 cellwith P5 combined with DDP(%)
表 3 P5对 COC1DDP IC50的影响Tab 3 Theeffectof theCOC1’sDDP IC50 with P5

表 3 P5对 COC1DDP IC50的影响Tab 3 Theeffectof theCOC1’sDDP IC50 with P5
P5浓度/(μg/mL)0 25 200 COC1 细胞 IC50/(μg/mL)2.51±0.12 1.56±0.34 1.52±0.29
2.4 细胞凋亡的形态学观察 经Hoechst染色后,在荧光显微镜下观察,正常细胞的细胞核呈蓝色。细胞发生凋亡时,染色质会固缩,细胞核致密浓染,或呈碎块状致密浓染,颜色略发白。对照组COC1细胞仅偶见凋亡细胞核,小剂量P5及大剂量P5组可见少数细胞凋亡现象,DDP组可见半数细胞凋亡现象,DDP+P525μg/mL组及 P5200μg/mL组,在作用24 h后,可见凋亡细胞明显增多。见图1。
3 讨论
细胞凋亡,也即程序性细胞死亡,在正常组织动态平衡和肿瘤病理生理学中发挥着重要作用。P5作为一种由人自然抑制细胞HNK-1(CD57)产生的AINs,可诱导白血病[3]、胃癌[4]、绒癌[5]、食管癌[6]、前列腺癌[7]、乳腺癌[8]等肿瘤细胞凋亡。研究表明[9],在PC3细胞(人前列腺癌细胞系)、胃癌细胞中,AINs可进入细胞转换成三磷酸根形式,引起DNA链断裂及激活caspase-3来诱导凋亡。本实验通过MTT法、形态学检测显示,P5对COC1细胞生长无抑制作用,在Hoechst染色荧光显微镜下观察,其诱导细胞凋亡不明显,并且大小剂量无明显差异,与文献报道其能够诱导人白血病、胃癌、结肠癌、食管癌、前列腺癌、乳腺癌细胞凋亡,并有药物浓度依赖性[9]不相符,故不能单独作为卵巢癌细胞的凋亡诱导剂。P5促进COC1细胞凋亡作用微弱可能和COC1存在着广泛的染色体异常有关,主要是1p、2q、3q、8q、12p、19p、20q 的扩增和 4p、13q、18q 的缺失。但在P5对COC1细胞DDP敏感性的影响结果中显示,P5能提高COC1细胞的DDP敏感性(t=5.84,P<0.05;t=6.14,P<0.05),也即 P5能够加强 DDP 对肿瘤的细胞毒性作用,有效降低DDP使用浓度,所以P5对于COC1细胞是一种DDP化疗增敏剂。
由于DDP的细胞毒作用主要是形成铂-DNA加合物,抑制DNA的复制和转录,导致DNA断裂和错误编码,最终触动凋亡机制使细胞程序性死亡,而P5具有破坏DNA链和激活caspase-3的能力,故推测P5增强DDP化疗敏感性可能与其激活caspase-3有关。本研究采用DDP联合P5小剂量和大剂量作用COC1细胞,镜下形态学观察均可见细胞凋亡明显增加,MTT法测得IC50值由2.51μg/mL分别下降到1.56μg/mL、1.52μg/mL。由于小剂量P5与大剂量P5效果相当,因此应对小剂量P5对卵巢癌细胞DDP的增敏作用进行深入研究。
本研究认为,P5可以作为DDP增敏剂。在卵巢癌DDP化疗中,联合P5治疗,不仅可减少DDP剂量,减轻药物毒副作用,还可提高疗效,减少卵巢癌细胞DDP耐药的发生。
[1]Gordinier M E,Kudelka A P,Kavanag J J h,etal.Thiotepa in combination with cisplatin for primary epithelialovarian cancer:A phase … study[J].Int JGynecol Cancer,2002,12(6):710
[2]CoukosG,Rubin SC.Chemotherapy resistance in ovarian cancer:newmolecular perspectives[J].Obstet and Gynecol,1998,91(5):783
[3]Mori T,Li X,Mori E,etal.Human T cell leukemia cell death by apoptosis-inducing nucleosides from CD57+HLA-Drbritghtnatural suppressor cell line[J].Jpn JCancer Res,2000,91(6):627
[4]Li X,Guo MW,Mori E,etal.Active rolesof caspase-3 in human gastric carcinoma cell death by apoptosis inducing nucleosides from CD57+HLA-Drbritghtnaturalsuppressor cell line[J].Int JOncol,2001,18(4):837
[5]MoriT,GuoMW,LiX,etal.Humanmalignantcelldeath by apoptosis-inducing nucleosides from the deciduas derived CD57+HLA-Drbritghtnatural suppressor cell line[J].JReprod Immunol,2002,53(1/2):289
[6]MoriT,GuoMW,LiX,etal.Human esophageal cancer celldeath mediated by apoptosis-inducing nucleosides from CD57+HLADrbritghtnatural suppressor cell line[J].Int JOncol,2001,19(6):1235
[7]Guo MW,Sato E,Jin A S,etal.Human prostate cancer cell death by novel anticancer compounds,apoptosis-inducing nucleosides from CD57+HLA-Drbritghtnatural suppressor cell line[J].Prostate,2002,51(3):166
[8]Guo MW,Jin A S,QiY L,etal.Effects of apoptosis-inducing nucleosides released from CD57+HLA-Drbritghtnatural suppressor cell on human breast cancer cell death and growth[J].Int JOncol,2003,23(1):205
[9]Jin A,Qi Y,Mori E,etal.Therapeutic effects of novel anti-tumor reagent,apoptosis inducing nucleosides from CD57+HLA-DRbrightnatural suppressor cell line on human gastric carcinoma-bearing SCIDmice[J].Int JOncol,2004,24(6):1523
