甘肃地区不同基因型丙肝感染与糖脂铁代谢异常的相关性研究
2013-10-22毛小荣彭雪彬张有成李林平
毛小荣,彭雪彬,张有成,李林平
(1.兰州大学第一医院,甘肃兰州 730000;2.兰州大学第二医院,甘肃兰州 730000;3.康乐县人民医院,甘肃康乐 731500)
慢性丙型肝炎病毒(HCV)感染患者在全世界约有1.7亿[1],该病常常进展为肝硬化及肝癌。HCV感染不仅仅对肝脏产生影响,同时也会影响其他器官及系统。研究表明,HCV感染与葡萄糖不耐受有关,是引起慢性丙型肝炎患者合并糖尿病的原因之一,也与脂类代谢、铁代谢有关[2-4];而且感染不同HCV基因型的患者其肝组织学损害、肝外表现以及对干扰素的治疗反应均有所不同[5],由此我们推测,感染不同基因型HCV的丙肝患者糖、脂、铁代谢的异常程度可能存在差异。对此,本研究检测了不同基因型丙肝患者糖、脂、铁代谢的相关指标,分析了不同基因分型对以上3种物质代谢的影响。
1 资料与方法
1.1 研究对象 按照中华医学会肝病学分会、传染病与寄生虫病学分会2005年制定的“丙型肝炎防治指南”,2009年1月至2011年6月兰州大学第一医院感染科门诊和住院临床确诊为慢性丙型肝炎患者220例,均为甘肃汉族,年龄≥18岁,其中男性128例、女性92例,年龄(42.30±13.15)岁。220例中1b型肝功能异常者44例,2a型肝功能异常者80例。
1.2 方法
1.2.1 基因分型 HCV基因分型采用北京巴奥瑞欣生物技术有限公司,操作方法参照各试剂盒说明书。
1.2.2 血清学指标的测定 使用奥林巴斯AU2700全自动生化分析仪测定胆固醇(CHOL)、甘油三酯(TG)、葡萄糖(GLU)、胰岛素、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总胆红素(TBIL)、间接胆红素(IBIL)、直接胆红素(DBIL)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、不饱和铁结合力(UIBC)、转铁蛋白(TRF)及总铁结合力(TIBC)血清学指标,测定所使用的试剂均由北京九强生物技术有限公司提供,操作方法均参照各试剂盒说明书。
1.3 统计学处理 采用SPSS 17.0统计软件包进行统计学分析,正态分布资料两组间均数比较采用t检验,非正态性分布资料以“中位数(Median)和上、下分位数间距(25%,75%)”表示,两变量间相关性采用Person相关分析,统计学显著性检验水准α=0.05。
2 结果
2.1 1b型和2a型基因型HCV携带者CHOL、TG、GLU及胰岛素的比较 表1示,2a型基因型HCV携带者的TG含量明显高于1b型基因型HCV携带者(P<0.05);1b型基因型与2a型基因型HCV携带者的CHOL、GLU和胰岛素含量经统计学检验,差异无统计学意义(P>0.05)。
2.2 1b型和2a型基因型HCV携带者UIBC、TRF、TIBC、SF和血清铁比较 表2所示,1b型基因型HCV携带者的TRF和TIBC含量略低于2a型基因型HCV携带者(P<0.05);1b型基因型与2a型基因型HCV携带者的UIBC、SF和血清铁经统计学检验,差异均无统计学意义(P >0.05)。
2.3 1b型和2a型基因型HCV携带者AST、ALT、TBIL、IBIL、DBIL、ALP 和 GGT 的比较表3示,1b型基因型HCV携带者的ALT含量低于2a型基因型HCV携带者(P<0.05);1b型基因型和2a型基因型HCV携带者的AST、TBIL、IBIL、DBIL、ALP 和 GGT 含量经统计学检验,差异无统计学意义(P>0.05)。

表1 1b型和2a型基因型HCV携带者CHOL、TG、GLU及胰岛素的比较Table 1 Comparison of the 1b type and 2a type genotype HCV carriers'CHOL,insulin,TG and GLU

表2 1b型和2a型基因型HCV携带者UIBC、TRF、TIBC、SF和血清铁的比较Table 2 Comparison of the 1b type and 2a type genotype HCV carriers'UIBC,TRF,TIBC,SF and serum iron

表3 1b型和2型基因型HCV携带者AST、ALT、TBIL、IBIL、DBIL、ALP和GGT的比较Table 3 Comparison of the 1b type and 2a type genotype HCV carriers'AST,ALT,TBIL,IBIL,DBIL,ALP and GGT
2.4 1b型和2a型基因型HCV携带者TRF、TIBC和TG与ALT相关性分析 两组丙肝基因型间存在差异的糖脂铁代谢指标TG、TRF、TIBC均与 ALT无明显相关性(r=0.010~0.267、P >0.05,表 4)。
3 讨论
丙型肝炎病毒(HCV)属于黄病毒科,由单股正链RNA病毒组成,分子量约9400 bp,具有包膜[6]。HCV的基因组变异性强,目前已经发现了6种HCV基因型以及上百种基因亚型。研究表明,HCV基因亚型的分布与地区有关,在亚洲地区以 1b和 2a型多见[7]。不同的HCV基因型在致病性、感染预后以及对干扰素治疗反应等方面均有很大差异[8]。
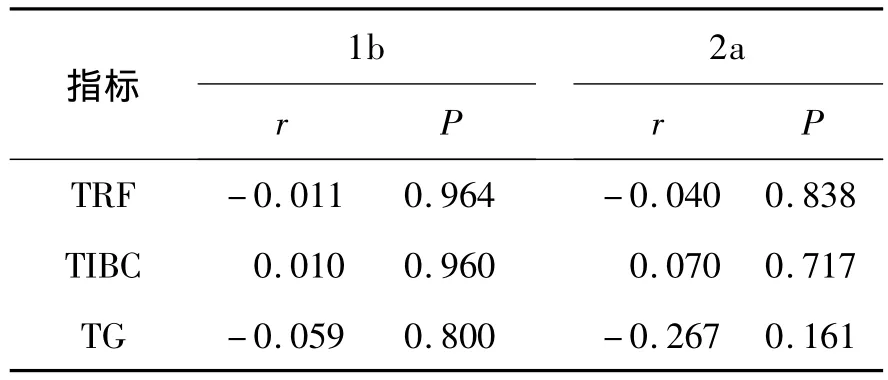
表4 1b型和2型基因型HCV携带者糖脂铁代谢指标与ALT相关性Table 4 1b andtype 2 genotypesofHCV carriers of glycolipids iron metabolism indicators with ALT correlation
3.1 HCV感染与糖代谢 既往报道,HCV感染与2型糖尿病相关,主要机制为HCV导致胰岛素抵抗。①HCV所形成的免疫复合物可能导致胰岛细胞损伤;② HCV在胰腺组织的复制可能引起B细胞功能衰竭;③HCV会引起肝脏脂肪变,导致胰岛素抵抗,从而引发2型糖尿病;④HCV感染者的血清铁蛋白升高[9]。本研究结果显示,空腹血糖及胰岛素在1b型及2a型没有明显差别,说明以上2种HCV基因型在血糖代谢方面可能无明显差别。
3.2 HCV感染与脂代谢 既往报道,慢性HCV感染者易发生肝细胞脂肪变,这可能影响HCV感染的自然过程,与肝纤维化形成有关;能增加患2型糖尿病的风险,影响抗病毒疗效,也可能是肝细胞癌(HCC)发生的危险因素[10]。Jarmay等对114例HCV感染的患者进行分析,发现约74% 的患者合并脂肪肝,而且这部分患者CHOL、TG水平显著升高;与单纯丙肝患者相比,伴有脂肪变的患者更易伴有高甘油三酯血症。一般认为基因3(主要为3a)型感染者肝脂肪变发生率高于其他基因型感染者,而又以基因1型感染者的发生率最低[11-13]。本研究结果显示,2a型TG水平高于1b型,即2a型患者脂肪变倾向可能高于1b型。
3.3 HCV感染与铁代谢 既往报道,慢性丙型肝炎患者血清铁蛋白和肝组织铁含量(HIC)比乙型肝炎患者高,过多的铁在肝脏沉积,可加重肝纤维化程度,甚至合并血色病及癌变[14]。另外,慢性丙型肝炎患者体内和肝内的铁过多,还可能影响干扰素等抗病毒药物的疗效[15]。本研究结果显示,1b型基因型HCV携带者的TRF和TIBC含量略低于2a型基因型HCV携带者。转铁蛋白不但是体内运输铁的主要蛋白体,有防止血浆铁在组织细胞沉着过多导致细胞损害的作用,而且还能促进肝细胞的再生,说明1b型患者相较2a型患者可能更容易出现铁沉积。而ALT可反映肝脏炎性反应的改变程度,不同的基因型肝细胞损害的严重程度可能也有差别。既往报道发现,ALT增高更多见于基因1型,且更易慢性化[16]。本研究显示,2a型ALT高于1b型,表明2a型患者的肝脏损害程度可能高于1b型。这种研究存在差异的糖脂铁代谢指标TG、TRF、TIBC均与ALT无明显相关性。
综上,在不同病毒基因型HCV感染的人群中,其差别出现的原因可能在于西方国家基因1型患者明显多于2型患者。本研究结果显示,丙肝1b型和2a型基因型患者糖、脂、铁的代谢对于疾病的严重程度及对于干扰素治疗反应均有影响。此外,对于高血糖、脂肪变及铁沉积的控制有助于改善肝功能,提高抗病毒治疗效果以及阻止肝纤维化进展。但是,由于目前的研究基本上均为横断面及回顾性研究,其中的关系仍有许多未明之处,对这些问题的解决有赖于进一步的大样本的研究。
[1]SIMMONDs P,Genetic diversity and evolution of hepatitis C virus 15 years on [J].J Gen Virol,2004,85:3173-3188.
[2]GUTIERREZ-GROBE Y,PONCIANO-RODRIGUEZ G., MENDEZ-SANCHEZ N.Viral hepatitis infection and insulin resistance:a review of the pathophysiological mechanisms[J].Salud Publica Mex,2011,53(Suppl 1):S46-51.
[3]HUANG H C,CHUANG C S,HSIEH Y Y,et al.Serum HCV RNA level is not associated with insulin resistance and metabolic syndrome in chronic hepatitis C patients with genotype 1 or 2 infection[J].Chang Gung Med J,2011,34(5):487-495.
[4]NELSON J E,KLINTWORTH H,KOWDLEY K V.Iron metabolism in nonalcoholic fatty liver disease[J].Curr Gastroenterol Rep,2012,14(1):8-16.
[5]MUNIR S,SALEEM S,IDREES M,et al.Hepatitis C treatment:current and future perspectives[J].Virol J,2010,7(296):1186-1192.
[6]BARTENSCHLAGER R,KAUL A,SPARACIO S.Replication of the hepatitis C virus in cell culture[J].Antiviral Res,2003,60(2):91-102.
[7]NOORALI S,PACE D G,BAGASRA O.Of lives and livers:emerging responses to the hepatitis C virus[J].J Infect Dev Ctries,2011,5(1):1-17.
[8]GEVERS T J,SLAVENBURG S,VAN OIJEN M G,et al.Treatment extension benefits HCV genotype 1 patients without rapid virological response:a systematic review [J].Neth J Med,2011,69(5):216-221.
[9]PARVAIZ F,MANZOOR S,TARIQ H,et al.Hepatitis C virus infection:molecular pathways to insulin resistance[J].Virol J,2011,8(474):186-192.
[10]LONARDO A,LORIA P,ADINOLFI L E,et al.Hepatitis C and steatosis:a reappraisal[J].J Viral Hepat,2006,13(2):73-80.
[11]ANTUNEZ I,APONTE N,FERNANDEZ-CARBIA A,et al.Steatosis as a predictive factor for treatment response in patients with chronic hepatitis C [J].P R Health Sci J,2004,23(2 Suppl):57-60.
[12]GUIDI M,MURATORI P,GRANITO A,et al.Hepatic steatosis in chronic hepatitis C:impact on response to anti-viral treatment with peg-interferon and ribavirin [J].Aliment Pharmacol Ther,2005,22(10):943-949.
[13]BUGIANESI E,SALAMONE F,NEGRO F.The interaction of metabolic factors with HCV infection:Does it matter?[J].J Hepatol,2012,56S1(S56-S65):278-283.
[14]ASARE G A,MOSSANDA K S,KEW M C,et al.Hepatocellular carcinoma caused by iron overload:a possible mechanism of direct hepatocarcinogenicity[J].Toxicology,2006,219(1-3):41-52.
[15]DI BONA D,CIPPITELLI M,FIONDA C,et al.Oxidative stress inhibits IFN-alpha-induced antiviral gene expression by blocking the JAKSTAT pathway[J].J Hepatol,2006,45(2):271-279.
[16]ZEUZEM S,LEEJH,FRANKEA,etal.Quantification of the initialdeclineofserum hepatitis C virus RNA and response to interferon alfa[J].Hepatology,1998,27(4):1149-1156.
