冷冻消融联合DC-CIK治疗伴转移的胰腺癌
2013-10-19姚飞陈继冰袁远英曾健滢王小花刘卫群李家亮穆峰牛立志左建生徐克成
姚飞 陈继冰 袁远英 曾健滢 王小花 刘卫群 李家亮 穆峰 牛立志 左建生 徐克成
·短篇论著·
冷冻消融联合DC-CIK治疗伴转移的胰腺癌
姚飞 陈继冰 袁远英 曾健滢 王小花 刘卫群 李家亮 穆峰 牛立志 左建生 徐克成
对于伴有转移的晚期胰腺癌,因肿瘤对放、化疗治疗不敏感,且不良反应较大,治疗后患者生存时间有限[1]。有研究显示,氩氦刀冷冻联合碘离子植入治疗Ⅳ期胰腺癌术后患者不良反应少,耐受性好,中位生存时间为8个月[2],同时氩氦刀冷冻治疗还可缓解肿瘤侵袭神经引起的剧烈疼痛,提高患者的生存质量[3]。自体肿瘤抗原负载的树突状细胞联合自体细胞因子诱导的杀伤细胞(DC-CIK)的免疫治疗可在不损伤机体免疫系统结构和功能的前提下直接杀伤肿瘤细胞,对预防肿瘤复发、改善患者生存质量具有重要意义[4-5]。本研究回顾性分析化疗、DC-CIK、氩氦刀冷冻消融以及冷冻联合DC-CIK4种治疗方式对伴转移的胰腺癌患者生存时间的影响。
一、材料与方法
1.临床资料:2008年11月至2011年6月广州复大肿瘤医院共收治145例经病理确诊的Ⅳ期胰腺癌患者。入组条件:(1)治疗前卡氏评分(karnofsky performance status,KPS)≥70;(2)血小板计数≥80×109/L,白细胞计数≥3×109/L,嗜中性粒细胞计数≥2×109/L,血红蛋白含量≥90 g/L;(3)前凝血酶国际标准化比值≥1.5;(4)术前CT评价最大原发灶和转移灶长径<6 cm;(5)胰腺肿瘤未浸润总胆管、后腔静脉、十二指肠或结肠;(6)无3级高血压、严重冠状动脉疾病、骨髓移植、呼吸系统疾病以及急慢性感染;(7)肝功能基本正常、腹水穿刺释放量<1 L;(8)患者愿意且可配合完成治疗过程;(9)临床与随访资料完整;(10)签署知情同意书。入组胰腺癌患者共106例,其中男性57例,女性49例,中位年龄65岁(42~84岁)。55例次患者伴肝转移,35例次患者伴腹膜及肝转移,26例次患者存在其他部位转移。26例患者存在糖尿病,25例患者存在胸腹水,14例患者存在轻度高血压。经综合评估后,36例患者接受单纯胰腺及转移瘤的冷冻消融,31例患者冷冻消融后再接受DC-CIK治疗,22例患者接受单纯化疗,17患者接受单纯DC-CIK治疗。
2.经皮冷冻消融术:参考文献[6]的方法。
3.DC-CIK治疗:取患者外周血单核细胞,加入细胞因子定向诱导成CIK和DC,用自体肿瘤抗原(Ag)在培养的第5天负载DC,第8天将DC与CIK细胞共同培养。待DC-CIK细胞数量达到1.0×1010~1.3×1010时开始回输。回输前先静脉滴注生理盐水,然后连接含1%人白蛋白的生理盐水200 ml制成的细胞悬液回输细胞,1 h内输完,隔天1次,共5次,每疗程回输细胞总数>5×109。
4.化疗:每次静脉注射吉西他滨,1周2次,持续3周,暂停一周,每例患者平均接受6个周期治疗。
5.冷冻联合DC-CIK治疗:在冷冻消融前2 d取血培养CIK及DC后再回输。
6.免疫功能评价:采用流式细胞仪评价患者外周血淋巴细胞数量和功能。采用TBNK试剂(no. 644611,BD) 检测 CD3+CD4+细胞(参考值:441~2156细胞数/μl)、CD3+CD8+(参考值:125~1312细胞数/μl)、CD3+(参考值:603~2990细胞数/μl)、CD3-CD19+(参考值:107~698细胞数/μl)和CD3-CD16+CD56+(参考值:95/μl~640细胞数/μl)细胞数。采用Human Th1/Th2 Cytokine Kit II (no.551809,BD)检测 IL-2(参考值:8~12.5 pg/ml)、IL-4(参考值:3.5~6 pg/ml)、IL-6(参考值:2.7~8.5 pg/ml)、IL-10(参考值:1.8~4 pg/ml)、TNF(参考值:1.7~2.5 pg/ml)和IFN-γ(参考值:1.5~4 pg/ml)水平。严格按试剂盒说明书操作。
7.术后评估和随访:根据《通用手术副作用术语标准4.0版》对不良事件严重度从1~5级的临床描述对术后不良反应进行记录、分级和评价。术后腹部CT平扫评估冷冻引起的并发症。术后第1个月及间隔3个月进行一次CT平扫评价冷冻效果。通过修正的《实体肿瘤应答评估原则v1.1》 评估胸腔和腹腔肿瘤应答情况。随访记录包括术后患者病情及生存情况。
8.统计学处理:采用美国San Diego公司GraphPad软件进行统计学处理。患者生存期从确诊日算起。冷冻前后免疫指标变化采用t检验。生存率曲线采用Kaplan-Meier方法描绘,各治疗组间患者总体生存期差异采用Dunnett test或Tukey-Kramer test,冷冻次数、治疗前患者免疫功能与患者总体生存期关系采用Long-rank检验。P<0.05表示差异具有统计学意义。
二、结果
1.冷冻消融术后不良反应:冷冻消融术后均未出现严重并发症。19例(28%)患者于术后1 d出现血清淀粉酶升高,术后5 d恢复正常;7例(10%)糖尿病患者术后1 d空腹血糖上升至20~25 mmol/L;12例患者(18%)术后出现轻微血小板下降,均于术后8~13 d自动恢复;21例(31%)患者腹胀或腹部疼痛,术后5 d内消失;17例(25%)患者术后出现食欲减退、腹腔积液,术后3~5 d缓解;14例(21%)患者出现腹部轻微出血,于术后7 d缓解;19例患者体温升高,其中冷冻联合DC-CIK治疗组11例,冷冻治疗组2例,DC-CIK治疗组6例,但发热均不超过39 °C。均于治疗后3 d恢复。
2.免疫功能变化:冷冻联合DC-CIK治疗组患者及单纯DC-CIK治疗组患者血淋巴细胞数量及反应淋巴细胞功能的细胞因子测定结果见表1。
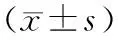
表1 胰腺癌患者免疫功能测定
3.治疗方式与患者生存期关系:全组患者总体中位生存期为7个月,其中冷冻联合DC-CIK治疗组的中位生存期为13个月,冷冻治疗组为7个月,DC-CIK治疗组为5个月,化疗组为3.5个月。冷冻联合DC-CIK治疗组患者总体生存期显著长于冷冻组(P<0.05),冷冻组的总体生存期又显著长于化疗组(P<0.001)。
4.冷冻消融次数与患者生存期关系:冷冻联合DC-CIK治疗组中12例患者(2次:8例;3次:4例;4次:1例;9次:1例),冷冻治疗组中15例患者(2次:9例;3次:6例)接受多次冷冻治疗,接受多次冷冻治疗患者的总体生存期显著长于同组接受单次冷冻治疗的患者(P值分别为0.0048、0.041,图1)。冷冻治疗组中单次冷冻患者的中位生存期为7个月,多次冷冻患者的中位生存期为9个月。
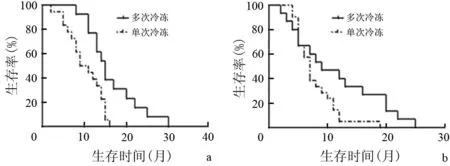
图1冷冻联合DC-CIK治疗组(a)、冷冻治疗组(b)的冷冻消融次数与患者总体生存期的相关性
5.治疗前免疫水平与患者生存期关系:冷冻联合DC-CIK治疗组中21例患者免疫指标高于或处于参考范围内,10例低于参考范围;DC-CIK治疗组中10例高于或处于参考范围内,7例低于参考范围。免疫指标高于或处于参考范围患者的总体生存期均显著长于同组免疫指标低于参考范围患者,冷冻联合DC-CIK治疗组为14个月比7.5个月,DC-CIK治疗组为6个月比2个月(P值均≤0.001, 图2)。
图2冷冻联合DC-CIK治疗组(a)、DC-CIK治疗组(b)患者免疫功能与总体生存期的相关性
讨论对于伴转移的胰腺癌患者,由于失去手术机会,其治疗方法有限。目前一线治疗方案是化疗,但吉西他滨化疗患者的生存期延长有限,联合化疗方案FOLFIRINOX可使患者中位生存期延长到11.1个月[7]。本研究中单纯吉西他滨化疗组患者的中位生存期仅3.5个月。
DC-CIK免疫治疗一直是免疫治疗领域非常重要的肿瘤治疗方法[8-9]。DC是有效的专职抗原提呈细胞,成熟的DC可以通过Ⅱ型组织相容性抗原(MHC-Ⅱ)等途径提呈肿瘤抗原,有效抵制肿瘤细胞的免疫逃逸机制。细胞因子诱导的杀伤细胞(CIK)是一类抗肿瘤抗病毒效应细胞,能在体外被诱导并大量增殖。两者结合可有效杀伤肿瘤细胞。本研究结果显示,DC-CIK治疗患者的中位生存期为5个月,并不能显著延长生存时间。其原因可能是由于肿瘤局部的微环境对免疫细胞的抑制作用[10]。因为在肿瘤局部微环境中DC的抗原提呈功能缺失或者受损,DC也可能处于免疫抑制状态或者产生免疫耐受,从而限制了效应T细胞的功能。因此,在免疫治疗的同时应该尽可能地对肿瘤进行消融治疗,改变肿瘤微环境[11-12]。本研究中冷冻联合DC-CIK免疫治疗伴转移的胰腺癌患者的中位生存时间为13个月,显著高于单纯免疫治疗、单纯冷冻治疗及单纯吉西他滨化疗的患者。这是因为冷冻治疗是在肿瘤原位对肿瘤组织进行冷消融,肿瘤细胞坏死、凋亡后会释放大量的肿瘤相关抗原入血,从而诱发冷冻免疫反应[11,13],同时也使DC携带更多的肿瘤抗原信号,从而更加精准地杀伤肿瘤;冷冻消融还可解除肿瘤局部微环境对免疫细胞的抑制作用,提高免疫治疗疗效;免疫治疗可杀灭转移的肿瘤灶,减少肿瘤转移和复发。因此,冷冻联合DC-CIK治疗可最大限度地减少肿瘤复发和转移,延长患者的生存期,这可能是伴转移的胰腺癌治疗领域的一条新路。
本次研究对冷冻治疗次数、患者免疫功能与生存时间的关系进行了初步研究。结果显示,接受多次治疗患者总体生存期优于单次冷冻治疗患者,治疗前免疫功能正常患者总体生存期显著长于治疗前免疫功能异常患者,提示多次冷冻可进一步延长患者的生存期,而患者的总体生存期与患者的机体免疫功能有关。
[1] Burris HA, Moore MJ, Andersen J, et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol,1997, 15:2403-2413.
[2] Chen JB, Li JL, He LH, et al. Radical treatment of stage IV pancreatic cancer by the combination of cryosurgery and iodine-125 seed implantation. World J Gastroenterol,2012, 18:7056-7062.
[3] Niu L, Wang Y, Yao F, et al. Alleviating visceral cancer pain in patients with pancreatic cancer using cryoablation and celiac plexus block. Cryobiology,2013, 66:105-111.
[4] Su X, Zhang L, Jin L, et al. Coculturing dendritic cells with zoledronate acid efficiently enhance the anti-tumor effects of cytokine-induced killer cells. J Clin Immunol,2010, 30:766-774.
[5] Marten A, Renoth S, von Lilienfeld-Toal M, et al. Enhanced lytic activity of cytokine-induced killer cells against multiple myeloma cells after co-culture with idiotype-pulsed dendritic cells. Haematologica,2001, 86:1029-1037.
[6] Xu KC, Niu LZ, Hu YZ, et al. Cryosurgery with combination of (125)iodine seed implantation for the treatment of locally advanced pancreatic cancer. J Dig Dis,2008, 9:32-40.
[7] Tokh M, Bathini V,Saif MW. First-line treatment of metastatic pancreatic cancer. JOP,2012, 13:159-162.
[8] Li XD, Xu B, Wu J, et al. Review of Chinese clinical trials on CIK cell treatment for malignancies. Clin Transl Oncol,2012, 14:102-108.
[9] Thanendrarajan S, Nowak M, Abken H, et al. Combining cytokine-induced killer cells with vaccination in cancer immunotherapy: more than one plus one? Leuk Res,2011, 35:1136-1142.
[10] Plate J. Clinical trials of vaccines for immunotherapy in pancreatic cancer. Expert Rev Vaccines,2011, 10:825-836.
[11] Sabel MS. Cryo-immunology: a review of the literature and proposed mechanisms for stimulatory versus suppressive immune responses. Cryobiology,2009, 58:1-11.
[12] Schnurr M, Scholz C, Rothenfusser S, et al. Apoptotic pancreatic tumor cells are superior to cell lysates in promoting cross-priming of cytotoxic T cells and activate NK and gammadelta T cells. Cancer Res,2002, 62:2347-2352.
[13] Rovere-Querini P, Manfredi AA. Tumor destruction and in situ delivery of antigen presenting cells promote anti-neoplastic immune responses: implications for the immunotherapy of pancreatic cancer. JOP,2004, 5:308-314.
10.3760/cma.j.issn.1674-1935.2013.05.015
510665 广州,暨南大学医学院附属广州复大肿瘤医院(姚飞、陈继冰、曾健滢、王小花、刘卫群、李家亮、牛立志、左建生、徐克成);中国科学院广州复大生物院附属复大医院(袁远英、穆峰)
李家亮, Email:feyamail@163.com
2013-05-03)
(本文编辑:吕芳萍)
