脑动脉粥样硬化性脑血栓形成患者梗死体积和神经功能评分与多种危险因素的关系
2013-10-18朱本亮
张 俊 袁 勇 朱本亮
脑梗死约占全部脑血管病的60%~80%,因此加强对脑梗死危险因素的研究,并及时预防和治疗,对降低疾病的发病率、致残率和病死率有较大的意义。纤维蛋白原(fibrinogen,Fg)是冠心病、脑卒中和周围动脉疾病的重要危险因素[1],血糖(blood glucose,BG)水平与脑梗死的关系密切。Iwashita等所作的一项前瞻性流行病学研究发现老年人血清总胆固醇(total cholesterol,TC)升高与脑梗死的发生呈正相关[2]。研究表明,化学修饰的LDL,尤其氧化低密度脂蛋白(oxidatively modified LDL,ox-LDL)是致动脉粥样硬化的重要原因[3]。本研究旨在评价ox-LDL、血糖、血脂、Fg等危险因素与缺血性脑血管病的相关性,并找出与缺血性脑血管病关系最为密切的危险因素。
1 对象与方法
1.1 研究对象
93例随机入选者均为2009年1月-2010年6月本院神经内科住院患者,其中男54例,女39例,比例为1.38∶1,年龄40~95岁,平均年龄(66.8±10.3)岁。所做检查及治疗均征得患者或家属知情同意。
入院后进行详细的病史询问、完善神经系统体检及头颅CT检查证实。入组标准:(1)急性或亚急性脑梗死患者;(2)入选者病灶均位于小脑幕上;(3)临床诊断符合1995年全国第四届脑血管学术会议通过的《各类脑血管疾病诊断要点》标准[4];(4)为首次发病或过去发病后未留下神经功能缺损者。
病例排除标准:(1)近期(6个月内)急性冠状动脉综合征、合并周围血管性疾病、大动脉炎、血液病、出血性疾病、脑血管畸形、结核、肿瘤、甲状腺疾病、免疫性疾病、严重心、肺、胃肠道、肝、肾等疾患者以及其他系统性疾病者,为减少研究对象带来的误差脑静脉血栓患和脑血管炎者同时排除;(2)感染、发热患者;(3)近1个月服用降脂药、抗纤溶药、华法令等抗凝药、抗氧化剂以及有应用类固醇药物史者;(4)1个月内有特殊治疗史者;(5)发病后已经溶栓治疗者;(6)不能配合本研究的患者。
1.2 脑部梗死灶体积的测定
CT常规扫描所有病例均先行CT平扫排除脑出血,并在发病(4±2.5)d再次复查头颅CT。根据发病后此时头部CT计算此次发病的责任病灶梗死体积,按如下公式[5]计算:梗死体积T(mL)=π/6×L(最大长轴)×S(短轴)×SIice(层面厚度)(cm)。
1.3 脑梗死患者的神经功能评分 采用临床神经功能缺损程度评分标准(1995)进行评分。
1.4 脑梗死患者血清中各项可能的相关因素的检测
(1)将入选后的病例进行编号,于入院第2 d早晨采空腹静脉血进行血液生化检测和凝血功能测定,测定血糖、血TC、血TG、血LDL、血HDL以及血纤维蛋白原数值;(2)患者另一份血清按编号(此序号与前述病例编号相同)放入-80℃冰箱保存。待样本采集结束后一起测定ox-LDL(采用酶联免疫吸附测定方法),试剂盒购自徐州夏斯生物试剂公司。
1.5 统计学处理 采用SPSS15.0软件包,计量资料平均数采用均数±标准差(±s)表示,单个因变量与多个自变量间的分析采用多元线性逐步回归分析方法(stepwise),两定量变量之间的相关关系采用直线相关分析。检验水准取为P<0.05认为差异有统计学意义。
2 结 果
2.1 入选者的一般情况
总病例数93例,男女之比为1.38∶1,平均年龄(66.8±10.3)岁。男性:≤65岁27例,>65岁27例,共计54例;女性:≤65岁15例,>65岁24例,共计39例。
2.2 不同梗死体积下各临床指标的平均水平 从表1得出随着梗死体积的增加,TG、LDL、HDL、BG水平均呈递增趋势,TC、Fg、ox-LDL水平呈递减趋势。
2.3 以梗死体积为因变量进行多元线性回归分析(stepwise)具有统计学意义的自变量有ox-LDL、Fg和TC,P<0.05(表2)。从表3知道被排除的变量为BG、HDL、TG、LDL。
表1 不同梗死体积下各临床指标的平均水平(±s)

表1 不同梗死体积下各临床指标的平均水平(±s)
指标 梗死体积≤5 cm3 5~15 cm3 ≥15 cm3 21 33 39 93 TC(mmol/L) 3.02±1.62 4.88±1.30 5.69±1.07 4.75±1.03 TG(mmol/L) 2.46±1.01 2.09±1.08 1.68±0.81 2.00±0.65 LDL(mmol/L) 3.58±0.71 3.11±1.04 3.10±0.87 3.18±0.86 HDL(mmol/L) 1.34±0.51 1.21±0.42 1.09±0.59 1.23±0.50 BG(mmol/L) 6.09±1.97 5.61±1.04 5.40±1.61 5.63±1.50 Fg(g/L) 2.55±0.21 3.41±0.82 4.27±0.73 3.31±0.83 ox-LDL(mg/L) 0.71±0.12 0.80±0.12 0.92±0.08 0.81±0.合计n 14

表2 以梗死体积为因变量时的回归分析
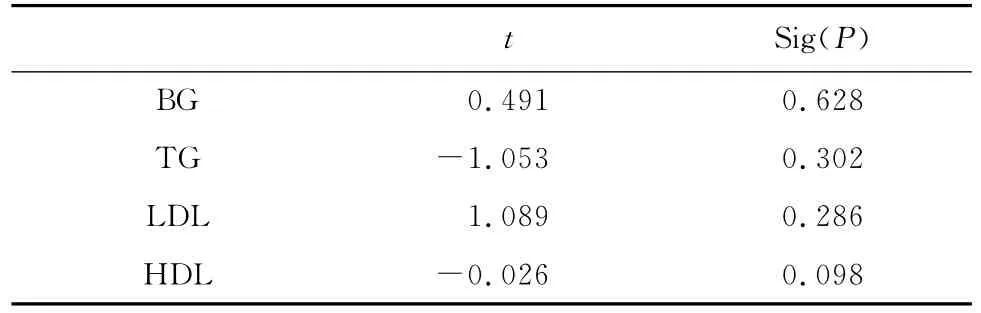
表3 以梗死体积为因变量回归分析时被排除的变量
2.4 不同神经功能评分下各临床指标的平均水平
从表4得出随着神经功能评分的增加,TG、LDL、HDL、BG水平均呈递增趋势,TC、Fg、ox-LDL水平呈递减趋势。
表4 不同神经功能评分下各临床指标的平均水平(±s)
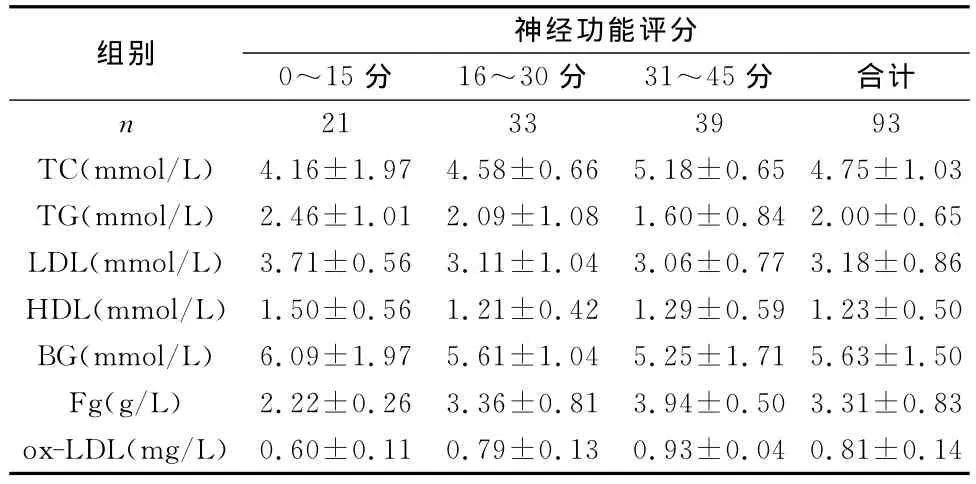
表4 不同神经功能评分下各临床指标的平均水平(±s)
组别 神经功能评分0~15分 16~30分 31~45 21 33 39 93 TC(mmol/L) 4.16±1.97 4.58±0.66 5.18±0.65 4.75±1.03 TG(mmol/L) 2.46±1.01 2.09±1.08 1.60±0.84 2.00±0.65 LDL(mmol/L) 3.71±0.56 3.11±1.04 3.06±0.77 3.18±0.86 HDL(mmol/L) 1.50±0.56 1.21±0.42 1.29±0.59 1.23±0.50 BG(mmol/L) 6.09±1.97 5.61±1.04 5.25±1.71 5.63±1.50 Fg(g/L) 2.22±0.26 3.36±0.81 3.94±0.50 3.31±0.83 ox-LDL(mg/L) 0.60±0.11 0.79±0.13 0.93±0.04 0.81±0.分 合计n 14
2.5 以神经功能评分为因变量进行多元线性回归分析(stepwise) 具有统计学意义的自变量为ox-LDL,P<0.01(表5)。表6显示回归分析中被排除的变量为Fg、TC、TG、LDL、BG、HDL。

表5 以神经功能评分为因变量时的回归分析
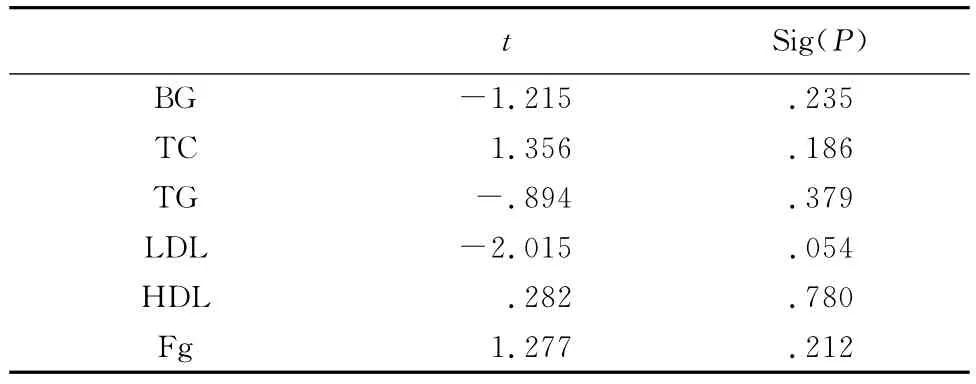
表6 以神经功能评分为因变量回归分析时被排除的变量
2.6 对脑梗死体积和神经功能评分的相关性分析二者存在正相关(r=0.834,P<0.01)。
3 讨 论
Iwashita等的研究发现降低胆固醇在预防男性高胆固醇血症患者发生脑梗死中具有重要作用,HDL-C降低、糖尿病、高血压均为脑梗死的独立预测指标[2]。国外前瞻性试验研究显示胆固醇水平和缺血性卒中有正相关,而且显示血浆胆固醇水平和总的脑卒中风险之间没有确切的关系[6,7]。本组资料显示TC与脑梗死体积呈正相关,而与脑梗死患者的神经功能评分没有相关性,说明其仅反映脑梗死患者病情的一部分,不能作为脑梗死患者病情严重程度的预测指标。
方晓霞等研究显示血浆oxLDL水平与NIHSS评分呈正相关[8],Uno等的临床研究亦显示血浆ox-LDL水平与脑梗死的体积以及中风后的严重程度有关[9],这与本研究结果一致。韦立新、张维维等研究认为ox-LDL主要存在粥样斑块肩部,不稳定斑块中,特别是巨噬细胞中含量较多[10,11]。提示脑梗死患者中升高的ox-LDL主要来自粥样斑块,特别是不稳定斑块,脑梗死面积越大,受累及的血管越大,造成血流障碍的斑块就要越大,其中所含有的ox-LDL就越多,ox-LDL有可能可以用来预测病变的严重程度。本研究发现,ox-LDL与脑梗死体积、神经功能评分均有相关性,有显著统计学差异,与此研究结果一致,认为ox-LDL可以作为脑梗死患者病情严重程度的预测指标。
纤维蛋白促进血管内膜吸附脂蛋白,增加脂质在纤维斑块中的聚集[12]。本组资料显示Fg与梗死的体积之间存在正相关,说明Fg是脑梗死的重要危险因素,具有相对独立性,这与王建生等[13]的研究结果一致,但与患者的神经功能评分没有明显关系,因此Fg是否能够全面反映脑梗死患者的病情,是否能够作为脑梗死患者病情严重程度的预测指标,有待进一步的大样本研究。
住院时升高的血糖是梗死后恶化的重要预测指标之一[14]。本组资料并未发现血糖与脑梗死体积或神经功能评分之间存在相关性,其原因可能主要与以下三方面有关:(1)本试验所纳入的患者的入院血糖水平为(5.59±1.32)mmol/L,平均水平都在正常范围。另外,血糖值的离散度也较小;(2)国外所做的有关评估均是大样本;(3)对糖尿病患者死后尸检显示幕下梗死发病率相对较高[15],而本实验所选患者均为幕上性梗死。所以,有关血糖与脑梗死患者梗塞体积和神经功能评分的关系尚需进一步的研究。
综上所述,ox-LDL与患者梗死灶的体积及神经功能评分之间存在正相关,这说明ox-LDL促进脑梗死的发生发展,是脑梗死具有较高独立性的危险因素,可以作为脑梗死患者病情严重程度的预测指标之一。
1 Mazoyer E,Drouet L,Soria C,et al.Risk factors and outcomes for Atherothrombotic disease in French patients:the RIVAGE study.Risque Vasculaire Groupd'Etude.Thromb Res,1999,95(4):163-176.
2 Iwashita M,Matsushita Y,Sasaki J,et al.Relation of serum total cholesterol and other factors to risk of cerebral infarction in Japanese men with hypercholesterolemia.Circ J,2005,69(1):1-6.
3 许 斌,张静生.LOX-1介导ox-LDL诱导血管内皮细胞p65的表达.辽宁中医杂志,2006,33(6):667-669.
4 中华神经科学会,中华神经外科学会.各类脑血管疾病诊断要点.中华神经科杂志,1996,29(6):379-380.
5 Pullicino P,Nelson RF,Kendall BE,et al.Small deep infarcts diagnosed on computed tomography.Neurology,1980,30(10):1090-1096.
6 Gorelick PB.Stroke prevention therapy beyond antithrombotics:unifying chanisms in ischemic stroke pathogenesis and implicationsfor therapy:an invited review.Stroke,2002,33(3):862-875.
7 Amarenco P,Tonkin AM.Statins for stroke prevention:disappointment and hope.Circulation,2004,109(suppl 1):III-44-49.
8 方晓霞,周珂.血浆氧化低密度脂蛋白、高敏C反应蛋白与脑梗死的相关性研究.武汉大学学报(医学版),2009,30(2):238-241.
9 Uno M,Kitazato KT,Nishi K,et al.Raised plasma oxidised LDL in acute cerebral infarction.J Neurol Neurosurg Psychiat,2003,74(3):312-316.
10 韦立新,唐庆贺,孙 璐.人体冠状动脉粥样硬化斑块中氧化低密度脂蛋白和新生血管与斑块稳定性的关系.中华病理学杂志,2006,35(3):138-141.
11 张维维,宫剑滨,汪俊军,等.氧化低密度脂蛋白与冠心病病变程度及其他危险因素的关系.医学研究生学报,2009,22(9):951-955.
12 Humphrise SE.Genetic regulation of fibrinogen.Ann N Y Acad Sci,1995,748:461-471.
13 王建生,金梅芳,王国军,等.脑梗死患者中纤维蛋白原水平和颈动脉粥样硬化的相关性研究.中国临床神经科学,2009,17(1):93-94.
14 Davalos A,Cendra E,Ternel J,et al.Deteriorating ischemic stroke:Risk factors and prognosis.Neurology,1990,40(12):1865-1869.
15 Rothrock JF,Clark Wm,Lyden PD.Spontaneous early improvement following ischemic stroke.Stroke,1995,26(8):1358-1360.
