健脾解毒方对二乙基亚硝胺诱导的肝癌大鼠肝组织CCR1和Cyclin D1 mRNA表达的影响*
2013-09-28殷佩浩赵成根范忠泽
张 斌 李 琦 殷佩浩 赵成根 高 虹 范忠泽
1.复旦大学附属中山医院青浦分院肝病科 (上海,201700) 2.上海中医药大学附属普陀医院肿瘤科
原发性肝细胞肝癌 (HCC)早期发病往往缺乏临床症状,造成许多患者从确诊到死亡的时间很短[1]。目前对其发病机制还不清楚,缺乏理想的治疗方法,因而加强肝癌的预防就显得尤为重要。健脾解毒方具有提高免疫、改善脏器功能及抗消化道肿瘤等多种疗效,对许多肝病,尤其对肝癌也有较好的防治效果。近来,越来越多的证据表明,肿瘤相关趋化因子及受体不仅可以促进肿瘤细胞增殖、抑制其凋亡、调节肿瘤血管生成,而且在控制肿瘤迁移、器官选择性转移中发挥了重要作用,尤其是CC趋化因子受体1(CC chemokine receptor 1,CCR1)与肝癌发病密切相关[2,3]。细胞周期蛋白D1(Cyclin D1)是参与细胞周期调控的周期素重要家族成员,在细胞周期G1/S期转换中发挥重要作用,促进肿瘤发生,在细胞增殖调节中起重要作用,已被证实在众多人类恶性肿瘤的发生发展中担当重要角色[4]。为此,本实验采用二乙基亚硝胺 (DEN)诱发大鼠肝癌模型,研究肝组织CCR1及Cyclin D1在诱癌不同时期的表达规律,同时研究健脾解毒方对其的干预作用。
1 材料与方法
1.1 试剂与药品 DEN,0.95 g/ml,纯度99.9% ,美国Sigma公司;Trizol RNA提取试剂,Invitrogen公司;RT-PCR试剂,Promega公司;健脾解毒方由生黄芪、白术、猪苓、八月札、石见穿、野葡萄藤、薏苡仁等组成,经水煎、浓缩及醇沉制成含生药1.75g/ml浓度的中药制剂,高压灭菌,4℃存放备用,由上海中医药大学附属普陀医院制剂室制成。
1.2 实验动物 雄性Wistar大鼠105只,清洁级,体重(100±10)g,动物合格证号:SCXP(沪)2008-0016,购自上海西普尔-必凯实验动物有限公司,所有大鼠分笼饲养于上海中医药大学附属普陀医院实验动物房。
1.3 方法
1.3.1 大鼠肝癌模型制备及标本留取 全部大鼠分为正常组(n=25)、模型组 (n=40)及中药预防组 (简称中药组,n=40)。模型组和中药组大鼠饮用含DEN 80mg/L的饮水,维持DEN摄入量 (8mg·kg-1·d-1)以诱癌,并以普通灭菌水补足不足水量,连续12周后改为自由饮水;中药组大鼠在饮用DEN水的同时予含健脾解毒方生药1.75g/ml的中药汤剂灌胃 (10ml/kg),1次/d,连续12W;正常组大鼠每日给予10ml/kg生理盐水灌胃,1次/d,共12周。于4、8、12、16周时相点,各组随机取5只大鼠剖腹取肝,20周时剩余大鼠全部剖腹取肝,大体观察暴露肝脏及腹水情况,取肝右后叶,存于-80℃备用。
1.3.2 肝组织病理学观察 取大鼠肝脏标本,4%多聚甲醛缓冲液固定24小时,常规石蜡包埋,切片,HE染色,光学显微镜下观察。
1.3.3 RT-PCR检测大鼠肝组织CCR1、CyclinD1 mRNA的表达 取肝组织100 mg匀浆后加入Trizol试剂提取总RNA。以紫外分光光度计测定RNA浓度和纯度,其吸光度A260nm/A280nm在1.9~2.1。逆转录总反应体系为20μl,置PCR仪25℃ 10分钟,40℃ 60分钟,85℃ 5分钟结束。然后取逆转录后的cDNA 1μl在50μl PCR体系中扩增。PCR所用引物和探针由上海博谷生物技术有限公司合成 (见表1)。所有基因荧光定量PCR按25 μl反应体系进行。样品管和内参管均设两个复管。反应条件为:95℃ 30秒变性,95℃ 5秒,60℃ 30秒,40个循环。反应结束后,ABI7300 SDS Software自动分析荧光信号并将其转换Ct值。Ct值取3个复管的平均值。每个样本靶基因 (检测基因)的相对mRNA表达水平,直接用样品各自的内参照GAPDH表达来标准化加入的初始RNA量。每个样品靶基因的相对mRNA表达水平可以用以下公式计算:相对mRNA表达=2-△Ct,其中△Ct值=靶基因Ct值-GAPDH Ct值。

表1 RT-PCR引物和探针序列
1.4 统计学方法 所有数据采用SPSS 11.0软件统计分析,计量资料以均数±标准差表示,采用单因素方差分析,两组间均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般状况 正常组大鼠生长状态良好,体重增加显著,皮毛光滑,大便和小便无异常;模型组大鼠活动少,精神萎靡,胡须下垂,喜睡少动,体重增加减少,甚至较前下降,皮毛欠光滑,尿色黄,有腹泻;中药组大鼠一般状态明显好于模型组。至20周实验结束时,正常组大鼠无死亡及腹水形成,模型组死亡率为42.5% (17/40),中药组死亡率为17.5%(7/40)(P<0.05)。模型组、中药组大鼠的腹水发生率分别为87.5%(7/8)、44.4%(8/18)(P<0.05),正常组大鼠没有腹水形成,中药组的腹水发生率与模型组比较差异有显著性意义
2.2 各组大鼠体重和肝脾指数 见表2。
表2 各组大鼠体重和肝脾指数的比较(±s)

表2 各组大鼠体重和肝脾指数的比较(±s)
与模型组比较,a P<0.01,b P<0.05
组别 n 体重(g) 肝指数(g/kg)脾指数(g/kg)正常组 5 429.4±7.50a 24.15±2.16a 2.37±0.21a模型组 3 271.67±4.04 122.84±5.83 5.25±0.46中药组 5 309.1±23.28a 96.17±6.62a 4.23±0.53b
2.3 病理组织学检查 20周时各组大鼠肝病理情况进行比较,其中正常组:肝小叶结构正常,无界面性炎症及纤维化,肝条索排列规整,以中央静脉为中心呈放射状排列,肝细胞无变性、坏死;模型组:肝细胞异型性增生明显,大部分增生肝细胞出现核异质变,细胞核仁普遍增大,细胞成倍增大,染色质粗糙,出现癌变细胞,同时呈典型的柱状及腺管样癌巢结构,且周围组织肝细胞异型性明显,伴癌细胞浸润,并可见不同程度的脂肪变性,部分区域有出血、坏死及静脉癌栓,周围的肝组织内尚可见微小癌卫星灶,癌周组织细胞水肿、嗜酸性变、脂肪变性,并有肝细胞增生灶、增生结节及非典型增生结节,呈典型的肝硬化表现;中药组:虽然大鼠肝脏可见癌结节,但与模型组比较,肝细胞变性坏死减轻,肿瘤病灶数显著减少。
2.4 肝组织CCR1 mRNA的表达 见表3。与正常组比较,模型组大鼠CCR1 mRNA均显著上调 (P<0.01);与模型组比较,中药组大鼠除第8周外,其余各周CCR1 mRNA均显著下调 (P<0.01)
表3 各组大鼠肝组织CCR1mRNA表达水平的比较(±s)

表3 各组大鼠肝组织CCR1mRNA表达水平的比较(±s)
与模型组比较,a P<0.01
组别 n 肝组织CCR1 mRNA 4W 8W 12W 16W 20W正常组 3 2.53±0.05a 2.63±0.05a 2.54±0.06a 2.58±0.10ia 2.59±0.03a模型组 3 5.95±0.04 7.54±0.04 4.71±0.05 12.12±0.17 6.29±0.02中药组 3 3.96±0.02a 8.59±0.04a 3.32±0.11a 8.13±0.09a 3.53±0.04a
2.5 肝组织CyclinD1 mRNA的表达 见表4。与正常组比较,模型组大鼠除第4周及8周的Cyclin D1 mRNA表达下调外,其余均出现显著上调,第16周达到最高峰。与模型组比较,中药组大鼠第4周、8周及12周 Cyclin D1 mRNA的表达上调,16周时出现显著下调 (P<0.01),第20周时两组差异不明显。
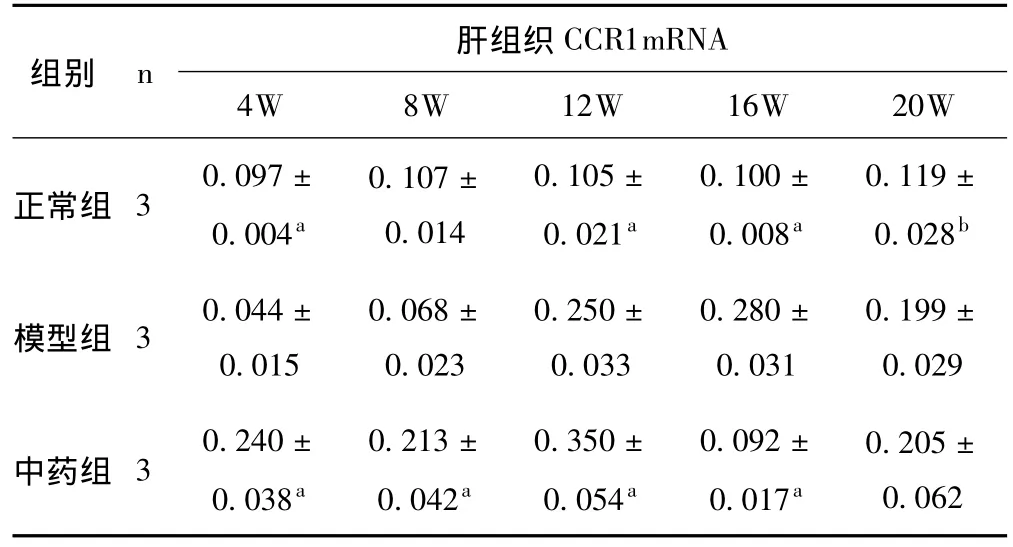
表4 各组大鼠肝组织Cyclin D1 mRNA表达水平的比较
3 讨论
肝癌的发生、发展与六淫外侵、七情失调、饮食所伤、素体不足等多种因素有关,出现痰、瘀、毒等病理产物,并可涉及肝、肾等多个脏腑功能失调。但脾胃的病变,始终是一个关键的因素,肝癌的形成大多由于脾气不足,运化不能,湿浊内蕴或肾气亏损,气化失司,湿浊内聚。湿浊蕴结体内,日久郁而化热,湿热蕴结下注,浸淫肠道导致肠道气血运行不畅,湿热瘀滞凝结而成肿块。中药复方是根据中医理、法、方、药的理论组方并经过实践确定下来的有效方剂,是中医治疗肿瘤的主要手段之一。健脾解毒方是根据中医学整体观念和辨证论治的原则,将清热解毒、祛瘀散结、健脾理气等治法有机结合起来的中药组方,由生黄芪、白术、猪苓、八月札、石见穿、野葡萄藤、薏苡仁等组成,具有健脾理气、化湿解毒的作用。本研究结果发现,中药组大鼠的病死率为17.5%,16周后腹水发生率为42.42%,而模型组病死率为42.5%,腹水发生率为87.5%,两者有显著差异,表明健脾解毒方可以有效预防肝癌的发生和发展,这点也得到病理研究结果的证实。
趋化因子超家族是一组结构相近、以刺激引导白细胞移动为主要作用的细胞因子,是一类细胞因子样的具有趋化作用的分泌型小分子蛋白质 (8~10kD),根据其氨基端半胱氨酸残基的数量级空间排列不同分为C、CC、CXC和CX3C四类。趋化因子可以增强淋巴细胞免疫反应,参与淋巴器官发育、树突状细胞成熟,调节T细胞分化,调节黏附分子整合素的表达,激活白细胞,产生炎性介质,介导炎症反应;也可以调控血管生成,影响肿瘤细胞和造血细胞生长,并参与细胞的颗粒外分泌、基因转录、丝裂效应及凋亡等[5~7]。CCR1为CCL3和Rante两种化学趋化因子的共享趋化因子受体,CCR1为细胞膜受体,在恶性肿瘤细胞中可存在于细胞浆。CCL3与CCR1结合后发生一系列生理病理功能。与多种恶性肿瘤进展、转移及侵袭密切相关,阳性或高水平表达者进展快、易发生转移、侵袭潜力强及预后差,也与肝癌发病密切相关。国内有学者对肝癌组织及9种肝癌细胞株趋化因子受体表达谱进行了研究,发现肝癌细胞表达多种趋化因子受体,其中CCR1高表达与肝癌侵袭密切相关,受相关配体RANTES、MIP-1α刺激后侵袭转移能力明显增强[2]。Wu等[5]研究发现,CCR1在HCC中高表达,认为可以作为一个肿瘤转移研究的靶点。本研究结果表明CCR1的上调是肝癌的重要发病机制之一,同时健脾解毒方延缓肝癌发展可能与其下调CCR1的表达有关。
Cyclin D1是Cyclins家族中调节细胞G1/S期转换的关键蛋白,由染色体上的11q13编码,即CCND1,为一明确的原癌基因,其基因和编码蛋白的异常,以及与多种肿瘤相关基因的协同作用可促使细胞恶性转化;Cyclin D1表达失控时,将引起细胞增殖周期失调,细胞失控性生长形成肿瘤。在G1期Cyclin D1与相应的细胞周期蛋白依赖激酶 (CDK)结合,使pRB磷酸化,驱使细胞通过检测点,加速细胞周期进程[8]。某些原癌基因如Ras基因可与Cylin D1相互作用,以促进细胞的转化,过量Cyclin D1可导致细胞失去对生长因子的依赖,使细胞周期G1期缩短,使细胞生长对有丝分裂原和黏附信号的需求降低,最终引发肿瘤[9],CyclinD1不仅是肿瘤发生的早期事件,而且参与了肿瘤的新生血管形成及肿瘤的浸润转移。肿瘤的侵袭和转移可被癌基因调节。有的癌基因可通过编码血管生成因子或通过刺激肿瘤细胞间接产生血管生长因子促进肿瘤血管形成,从而影响肿瘤的转移及预后。肝癌的发生与G1/S期检测点缺陷有关[10~11]。本研究结果表明,cyclin D1的表达上调与肝癌形成有关,同时健脾解毒方有阶段性抑制cyclin D1表达的作用,但是总体上对cyclin D1的下调作用并不明显,可能不是健脾解毒方作用的主要靶点。
[1] SIA D,VILLANUEVA A.Signaling pathways in hepatocellular carcinoma[J] .Oncology,2011,81(Suppl)1:18-23.
[2]王晓颖,樊嘉,周俭,等.CCR1趋化因子受体在人肝癌组织中表达及其临床意义[J].中华肝胆外科杂志,2006,12(2):101-104.
[3] WU XF,FAN J,WANG XY,et al.Downregulation of CCR1 inhibits human hepatocellular carcinoma cell invasion [J] .Biochemical and Biophysical Research Communications,2007,355(4):866 -871.
[4] FU M,WANG C,LI Z,et al.CyclinD1:normal and abnormal functions[J] .Endocrinology,2004,145(8):5439 -5447.
[5] SCHWARZ MK,WELLS TN.New therapeutics that modulate chemokine networks[J] .Nat Rev Drug Discov,2002,1:347 -358.
[6] KUWADA Y,SASAKI T,MORINAKA K,et al.Poteential involvement of IL-8 and its recptors in the invasiveness of pancreatic cancer cells[J] .Int J Oncol,2003,22:765 -771.
[7] CARDONES AR,MRUAKAMI T,HWANG ST,et al.CXCR4 enhances adhesion of B16 tumor cells to endothelial cells in vitro and in vivo via beta(1)integrin [J] .Cancer Res,2003,63:6751 -6757.
[8] SIMILE MM,MIGLIO MR,MURONI MR,et al.Down-regulation of c-myc and Cyclin D1 genes by antisense oligodeoxy nucleotides inhibits the expression of E2F1 and in vitro growth of HepG2 and Morris 5123 liver ancer cells[J] .Carcinogenesis,2004,25(3):333 -441.
[9] KONG S,AMOS CI,LUTHRA R,et al.Effects of cyclinD1 polymorphism on age of onset of hereditary nonpolyposis colorectal cancer[J] .Cancer Res,2000,60(2):249 -252.
[10] MOGHADDAM SJ,HAGHIGHI EN,SAMIES S,et al.Immunohisto-chemical analysis of p53,cyclinD1,RB1,c-fos and N-ras gene expression in hepatocellular carcinoma in Iran [J] .World J Gastroenterol,2007,13(4):588 -593.
[11] DAS SK,SHIMOTO T,NAZAWA K.Growth inhibition of human hepatic carcinoma HepG2 cells by fucoxanthin is associated with down-regulation of cyclin D [J].Biochim Biophys Acta,2008,1780(4):743 -749.
