恩替卡韦联合苦参素片治疗HBeAg阳性慢性乙型肝炎52例疗效观察
2013-09-28龚钰清盛国光
龚钰清 盛国光
1.湖北中医药大学2009级博士研究生班(湖北武汉,430065) 2.湖北医药学院附属太和医院感染科3.湖北省中医院肝病中心
笔者采用恩替卡韦联合苦参素片治疗52例HBeAg阳性慢性乙型肝炎 (CHB)取得了较好的效果,报道如下。
1 资料与方法
1.1 一般资料 入选102例CHB患者均为十堰市太和医院感染科2010年9月-2011年12月门诊及住院患者,诊断符合2000年西安会议修订的慢性乙型肝炎的诊断标准[1]。同时需具备以下条件:①HBeAg阳性;②HBV DNA≥105copies/ml;③ALT≥正常值上限2倍以上;④以前未行抗病毒治疗;⑤排除甲、丙、丁、戊和庚型肝炎病毒的感染;⑥排除由药物、酒精和其他因素所致的肝功能异常;⑦排除心、肺、肾脏、血液系统及肿瘤等疾病;⑧患者及家属均签署知情同意书。
102例患者随机分为治疗组和对照组。治疗组52例,其中男42例,女10例,年龄在20~45岁,平均 (32.2±5.6)岁;对照组50例,其中男41例,女9例,年龄在19~52岁,平均 (35.1±4.5)岁。两组患者的年龄、性别、病程和病情比较,差异无显著性意义 (P>0.05),具有可比性。
1.2 治疗方法 治疗组患者给予恩替卡韦 (上海中美施贵宝制药有限公司生产,1次/d,0.5 mg/次)联合苦参素片 (山东齐都药业有限公司生产,0.2g/次,3次/d)口服,疗程均1年。对照组患者单纯应用恩替卡韦,其剂量、服法和疗程均同治疗组。
1.3 标本收集方法及检测项目 治疗前及治疗后第48周分别抽血检测:病毒学指标 (乙肝病毒标志物、HBV DNA定量),T细胞亚群、肝功能及肝纤维化3项指标 [HA(透明质酸、LN(层粘蛋白)、PCⅢ (Ⅲ型前胶原)]。
1.4 检测方法 HBV DNA定量测定采用荧光定量PCR法(最低检测下限值为500copies/ml);血清肝纤维化指标检测采用放射免疫 (RIA)法;肝功能试验采用Beckman全自动生化分析仪;外周血T细胞亚群采用 FACScalibur流式细胞仪(美国BD公司生产)检测。
1.5 统计学方法 采用SPSS 13.0进行统计学分析,计量资料采用t检验,计数资料采用χ2检验。
2 结果
2.1 两组患者治疗前后ALT水平及复常率情况 见表1。
表1 两组患者治疗前后ALT检测水平及复常率比较(±s)
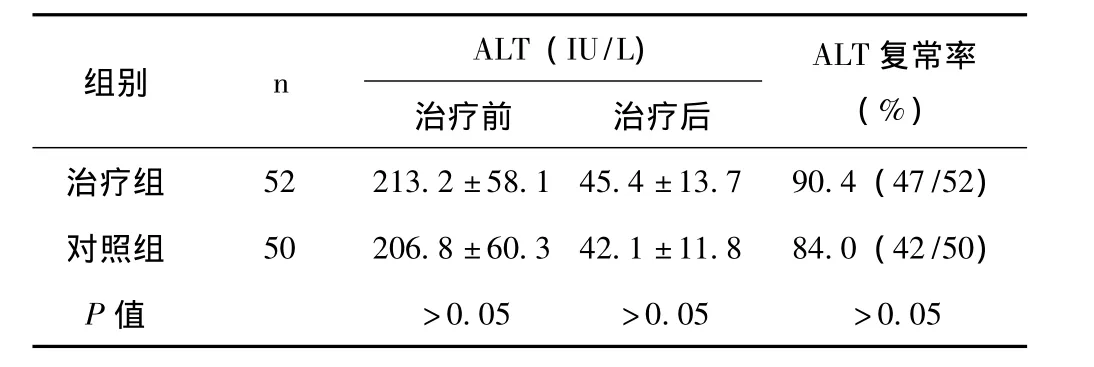
表1 两组患者治疗前后ALT检测水平及复常率比较(±s)
组别 n ALT(IU/L)治疗前 治疗后ALT复常率(%)治疗组 52 213.2±58.1 45.4±13.7 90.4(47/52)对照组 50 206.8±60.3 42.1±11.8 84.0(42/50)P值 >0.05 >0.05 >0.05
2.2 两组患者治疗前后HBV DNA定量水平 见表2。
表2 两组患者治疗前后HBV DNA定量水平比较(±s)

表2 两组患者治疗前后HBV DNA定量水平比较(±s)
组别 n HBV DNA(lg copies/ml)治疗前 治疗后治疗组52 7.2±1.9 3.3±0.9对照组 50 7.3±1.8 5.4±1.2 P值 >0.05 <0.05
从表2中可以看出,治疗组患者治疗后HBV DNA定量水平较对照组明显下降 (P<0.05)。
2.3 两组患者治疗前后病毒学指标变化比较 见表3。
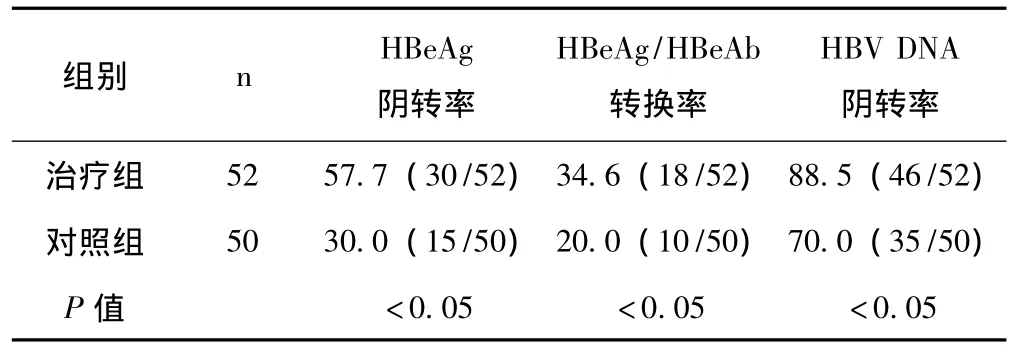
表3 两组患者治疗前后病毒学指标变化比较 (%)
2.4 两组患者治疗前后外周血T细胞亚群变化情况 见表4。
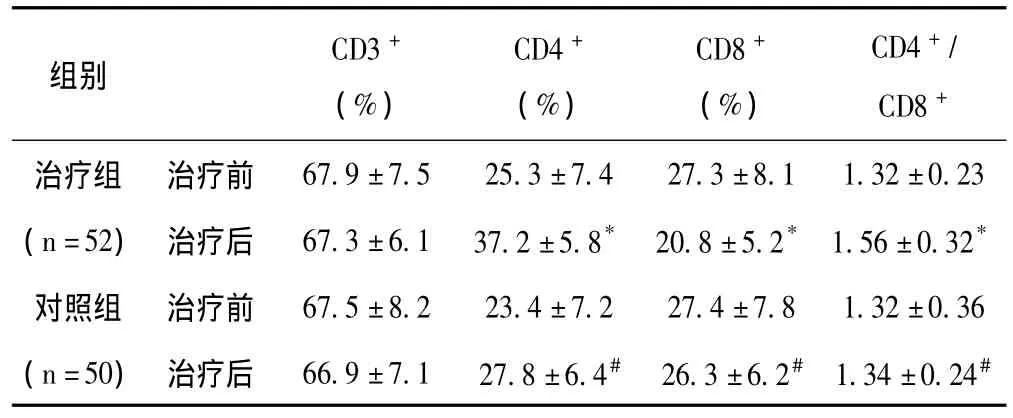
表4 两组患者治疗前后T细胞亚群变化比较
从表4中可以看出:治疗组在疗程结束后CD4+T淋巴细胞百分率以及CD4+/CD8+比例明显上升,CD8+T淋巴细胞百分率下降,同治疗前比较,差异有显著性意义 (P<0.05);而对照组CD4+T淋巴细胞百分率和CD4+/CD8+比例也有所升高,但同治疗前比较,差异无显著性意义 (P>0.05)。
2.5 两组患者治疗前后肝纤维化3项指标变化情况 见表5。
表5 两组患者治疗前后肝纤维化3项指标变化比较 (±s,μg/L)
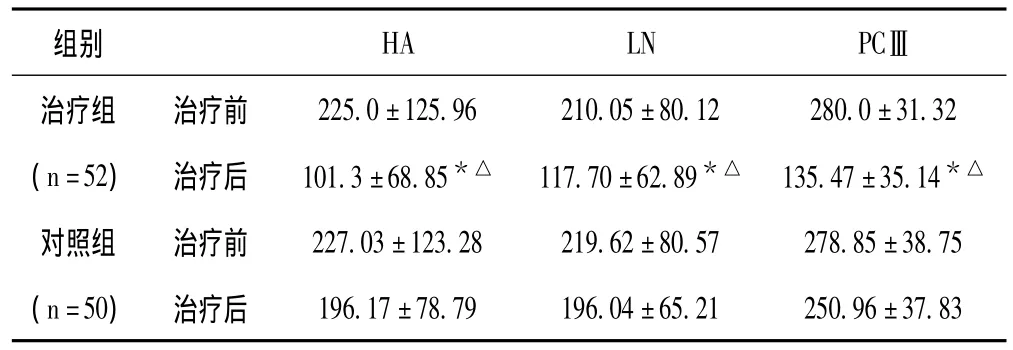
表5 两组患者治疗前后肝纤维化3项指标变化比较 (±s,μg/L)
与本组治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05
组别 HA LN PCⅢ225.0±125.96 210.05±80.12 280.0±31.32(n=52) 治疗后 101.3±68.85*△ 117.70±62.89*△ 135.47±35.14*△对照组 治疗前 227.03±123.28 219.62±80.57 278.85±38.75(n=50) 治疗后治疗组 治疗前196.17±78.79 196.04±65.21 250.96±37.83
从表5中可以看出,治疗组患者治疗后肝纤维化3项指标均明显下降,经统计学处理,差异有显著性意义 (P<0.05);对照组患者治疗后肝纤维化3项指标虽有所下降,但经统计学处理差异无显著性意义 (P>0.05)。
2.6 两组患者不良反应 两组患者均未出现过敏反应和肾功能损害。治疗组1例和对照组两例出现头晕、腹部不适等,均不影响治疗,未停药。
3 讨论
CHB治疗的总体目标在于最大限度地长期抑制或清除HBV,阻止病程进展,减轻肝细胞炎症坏死及肝纤维化,从而改善乙型肝炎患者的生活质量和延长存活时间[2,3]。其治疗方案主要有抗病毒治疗和抗肝纤维化治疗。恩替卡韦是新一代抗HBV鸟嘌呤核苷类似物。其在体内磷酸化后成为具有活性的三磷酸盐,而后与HBV DNA多聚酶的底物三磷酸脱氧鸟嘌呤核苷竞争,从而抑制乙肝病毒多聚酶的活性,包括多聚酶的启动、基因组逆转录负链的形成、HBV DNA正链的合成等,在动物模型和人体临床试验中有很强的抗HBV活性,疗效优于拉米夫定和阿德福韦[4]。目前恩替卡韦广泛地应用于CHB的抗病毒治疗。
苦参素是从苦豆子及苦参根中提取的生物碱。研究表明,苦参素具有较好的改善CHB患者肝功能、抗肝纤维化[5]、改善肝脏微循环、促进肝细胞再生、抑制HBV复制和免疫调节作用。其作用机制是苦参素能明显地提高人体的免疫功能,调动人体B细胞产生大量的抗HBV抗体[6],并可直接刺激细胞产生干扰素 (IFN);苦参素也能对抗免疫抑制剂的作用,恢复并促进受抑制的细胞产生IFN,抑制细胞分泌HBsAg和HBeAg,刺激机体产生高浓度IFN以及提升白细胞[7],阻断肝细胞凋亡,干扰病毒的合成[8]。
我们采用恩替卡韦联合苦参素片治疗HBeAg阳性CHB,结果提示两药联合运用有增强抗病毒疗效的作用。同时发现治疗组在治疗后CD4+T淋巴细胞百分率、CD4+/CD8+比例明显上升,CD8+淋巴细胞百分率下降,同治疗前比较,差异均有显著性意义 (P<0.05);治疗组患者治疗后肝纤维化3项指标明显下降。以上结果提示:恩替卡韦与苦参素片联合治疗可以改善CHB患者CD4+、CD8+T淋巴细胞比例,并能纠正CD4+/CD8+T淋巴细胞比例的失衡,有良好的免疫调节和抗肝纤维化作用,值得临床进一步推广。
[1]中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎的诊断标准[J].中西医结合肝病杂志,2001,11(1):56-60.
[2] MELIS S A KO,ANNA SFL.Antiviral options for the treatment of chronic hepatitis B [J] .J Antimicrob Chemoth-er,2006,57(6):1030-1034.
[3]徐道振.病毒性肝炎临床实践 [M].北京:人民卫生出版社,2006:351-355.
[4]罗玮敏,张迎春,刘中景.恩替卡韦治疗慢性乙型肝炎的早期临床观察[J].临床肝胆病杂志,2008,24(1):26-28.
[5]王俊学,王国俊,蔡雄,等.氧化苦参碱及甘草甜素对小鼠肝细胞凋亡的影响[J].第二军医大学学报,1999,20(4):222-224.
[6]周红燕,张波,汪铮.苦参素治疗慢性乙型肝炎相关细胞因子的变化[J].传染病信息,2009,22(4):230.
[7]秦莉.苦参素胶囊抗病毒治疗慢性乙型肝炎的量效关系[J].中医研究,2009,22(7):25.
[8]余进胜,陈惠文,马美红,等.慢性乙肝患者苦参素治疗前后C3、C-反应蛋白水平与 HBV DNA含量变化 [J].现代医院,2009,9(5):28.
