丙戊酸钠血清浓度接近或超过治疗浓度范围上限患者的肝功能、血常规结果分析
2013-09-27刘立丽闫素英首都医科大学宣武医院药剂科北京100053
曾 艳,刘立丽,闫素英(首都医科大学宣武医院药剂科,北京 100053)
丙戊酸钠(sodium valproate, VPA)是广谱抗癫痫药物,是新诊断特发性全面性癫痫的一线药物且唯一的首选药物。它是与其他药物联合治疗特发性全面性癫痫的首选药物,也可用于症状性部分性癫痫的药物治疗[1]。丙戊酸钠治疗癫痫的有效浓度范围是50 ~ 100 μg·mL-1,超过100 μg·mL-1常被视作中毒浓度,部分医疗机构将丙戊酸钠> 100 μg·mL-1定为血药浓度检测危急值。但是丙戊酸钠血清浓度超过100 μg·mL-1时,患者是否就会发生严重的不良反应,达到所谓的中毒呢?由于肝脏毒性和血液系统的不良反应是丙戊酸钠主要的不良反应,且文献报道其与药物剂量相关,本文通过回顾性分析癫痫患者丙戊酸钠血清浓度接近或超过有效浓度范围高限患者的同期肝功能及血常规检查的各项重要指标,了解丙戊酸钠血清浓度水平较高时,患者肝功能及血液系统的情况,为丙戊酸钠的安全应用提供参考。
1 对象与方法
1.1 研究对象
本研究选择诊断为癫痫,口服丙戊酸钠,2011年1月1日- 2012年10月30日在首都医科大学宣武医院监测丙戊酸钠血清浓度(规律服药1周以上,晨起用药前抽静脉血测定),结果> 90 μg·mL-1的患者为研究对象。
1.2 药品、试剂与仪器
丙戊酸钠糖衣片(规格:0.2 g/片,湖南省湘中制药有限公司);丙戊酸钠缓释片(德巴金缓释片,规格:0.5 g/片,杭州赛诺菲民生制药有限公司);丙戊酸钠糖浆(德巴金糖浆,规格:12 g:300 mL,杭州赛诺菲民生制药有限公司)。
AxSYM-雅培全自动免疫分析系统(美国雅培公司);丙戊酸检测试剂盒(美国雅培公司)。
1.3 方法
回顾性收集研究对象的年龄、性别、丙戊酸钠用法用量等一般性资料及同期肝功能、血常规的各项重要指标。肝功能指标包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(GGT)、乳酸脱氢酶(LDH)、总胆红素(TBIL)、白蛋白(ALB);血常规指标包括白细胞计数(WBC)、中性粒细胞计数(NEUT)、中性粒细胞百分率计数(NEUT%)、红细胞计数(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、血小板计数(PLT),进行统计分析。
剔除在测定丙戊酸钠浓度同期未进行肝肾功能、血常规检查,其他数据缺失或合并其他可能影响肝功能、血常规疾病者。使用SPSS13.0统计软件进行数据处理和分析。
2 结果
2.1 一般资料
共70名患者纳入研究,其中,男性43名,女性27名,年龄5 ~ 78岁,丙戊酸钠的剂量为7.1 ~ 51.3 mg·kg-1,其中19名患者日剂量> 30 mg·kg-1;丙戊酸钠血清浓度为90.7 ~ 159.9 μg·mL-1;34名患者单用丙戊酸钠治疗癫痫,36名患者联用其他抗癫痫药物。大部分患者未述明显不适,18.6%(13/70)的患者主诉出现恶心、头晕、嗜睡、手颤抖、反应迟钝等不适症状。将70名患者按血清浓度值分成3组,具体见表1。
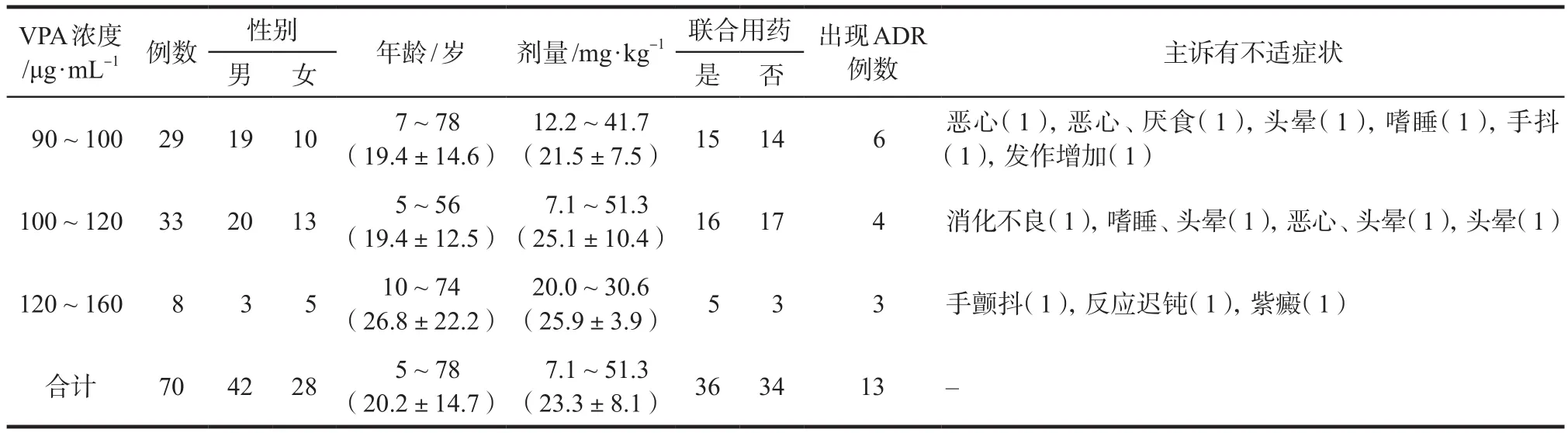
表1 患者的一般资料Tab 1 Characteristics of patients with valproate serum concentrations above 90 μg·mL-1
2.2 肝功能及血常规指标的异常情况
2.2.1 肝功能 34.8%(24/69)的患者肝功能指标出现异常,其中20例患者属于肝酶的轻度增高(低于正常范围上限的2倍),1例GGT超过正常范围的2倍且合并ALT、AST值高于正常范围,1例白蛋白低于正常范围,胆红素均未见异常。肝功能各项指标的异常情况按血药浓度水平分组情况见表2,丙戊酸钠血药浓度90 ~ 100 μg·mL-1组、100 ~ 120 μg·mL-1组和120 ~160 μg·mL-1组肝功能指标出现异常的比例未见显著性差异(χ2检验,P> 0.05)。
2.2.2 血常规 63.5%(33/52)的患者血常规指标出现异常,其中3例白细胞低于正常范围,12例中性粒细胞减少(均属于轻度减少,> 1.0×109·L-1),31例中性粒细胞百分比低于正常范围;3例出现轻度贫血(HGB 90 ~ 110 g·L-1),4例红细胞绝对值低于正常范围,4例红细胞压积低于正常范围;5例患者血小板数低于正常范围,其中1例血小板数低于50×109·L-1,且同时出现白细胞、红细胞的减少。血常规各项指标异常情况按血药浓度水平分组情况见表3。由于血清浓度120 ~ 160 μg·mL-1组的例数过少,故将血清浓度120 ~ 160 μg·mL-1组和100 ~ 120 μg·mL-1组合并,和血清浓度90 ~ 100 μg·mL-1组对血常规指标出现异常的比例进行比较,结果未见显著性差异(χ2检验,P>0.05)。
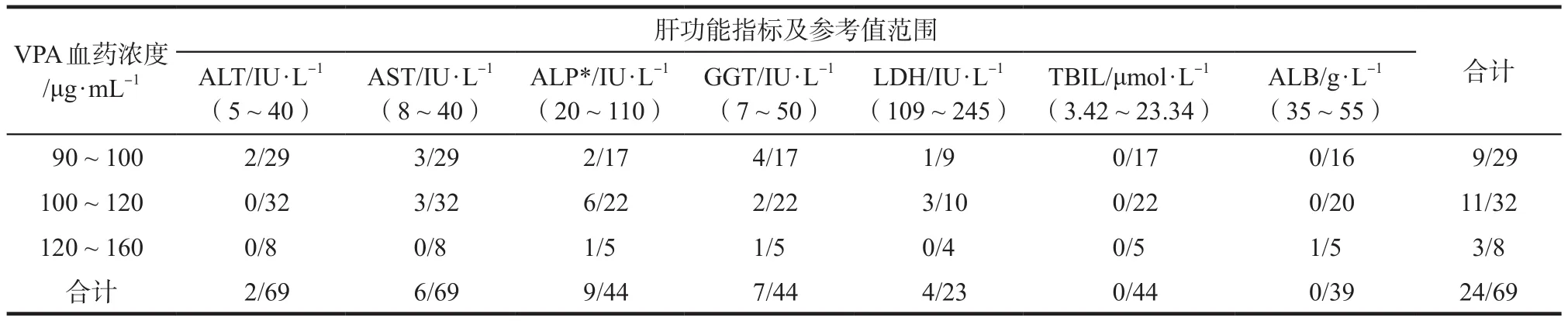
表2 患者肝功能指标异常情况的分组比较. 例Tab 2 Comparison of frequency of abnormal laboratory results of liver function among three concentration groups. case
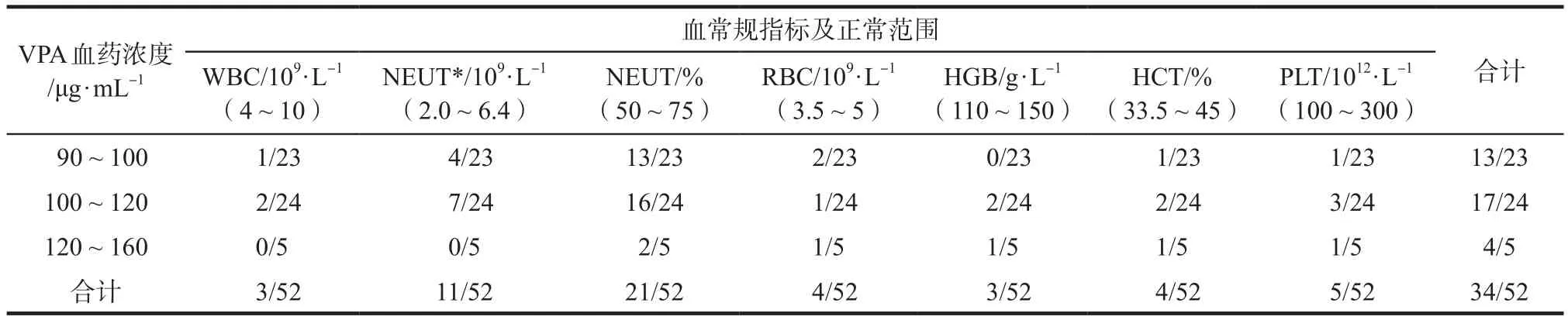
表3 患者血常规指标异常情况的分组比较. 例Tab 3 Comparison of frequency of abnormal laboratory results of haemogram among three concentration groups. case
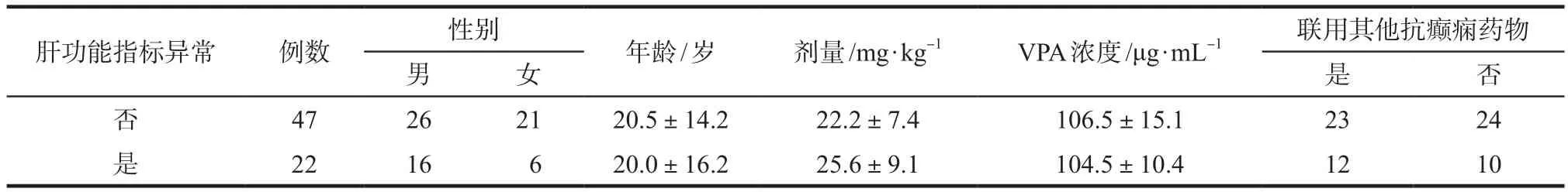
表4 按肝功能指标是否异常进行分组比较Tab 4 Comparison of characteristics of patients with and without abnormal laboratory results of liver function
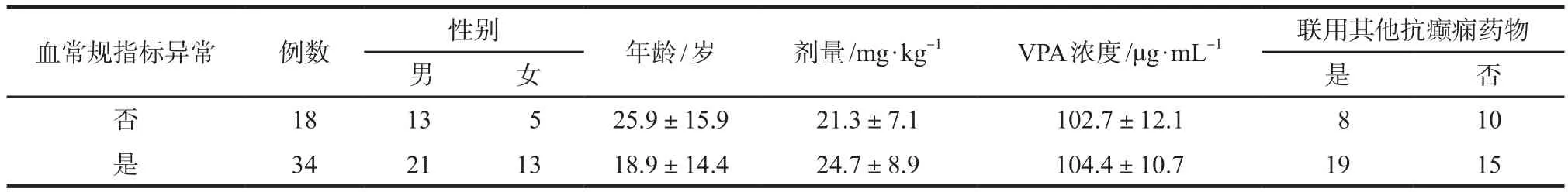
表5 按血常规指标是否异常进行分组比较Tab 5 Comparison of characteristics of patients with and without abnormal laboratory results of haemogram
2.2.3 肝功能指标正常及异常患者和血常规指标正常及异常患者的一般资料的分组比较 分别将是否出现肝功能指标异常的患者和是否血常规指标异常的患者的年龄、性别、丙戊酸钠剂量、丙戊酸钠浓度等资料进行比较,见表4、表5。肝功能指标是否出现异常的两组患者性别、年龄、丙戊酸钠剂量、浓度、联用其他抗癫痫药物的比例均未见显著性差异,血常规指标是否出现异常的两组患者性别、年龄、丙戊酸钠剂量、浓度、联用其他抗癫痫药物的比例也均未见显著性差异。计数资料使用χ2检验,计量资料使用t检验。
2.3 其他检验指标的异常情况
有10例出现其他检验指标异常,包括4例纤维蛋白原低于正常水平(1例合并血小板减少),2例血氨高于正常范围(1例合并ALP、LDH偏高,1例未合并肝功能异常),4例叶酸水平低于正常水平。
3 讨论
3.1 丙戊酸钠的肝脏毒性及血液系统毒性
肝脏毒性是丙戊酸钠纳入黑框警告的一类不良反应。根据WHO乌普萨拉国际监测中心1963 - 2003年的ADR监测数据,按照引起致命性肝损害的例数对药物进行排名,丙戊酸钠居于第三位(仅次于对乙酰氨基酚、曲格列酮)[2]。丙戊酸钠对肝脏的不良反应主要表现为肝酶(ALT、AST、LDH等)的升高,且与剂量相关,如果合并胆红素和其他肝脏指标的升高,往往预示着肝脏出现了更严重的问题[3]。在19个临床试验中,血清转氨酶异常的发生率在0 ~ 44%,总计1197名患者的平均发病率为11%[4]。Cepelak I等[5]观察使用丙戊酸钠和卡马西平的儿童癫痫患者肝酶(ALT、AST、GGT)的变化,发现丙戊酸钠主要导致AST升高,而卡马西平导致GGT升高[5]。有关丙戊酸钠的肝毒性的机制有较多的假说,但广泛为大家所接受的是丙戊酸钠的某些活性代谢物(如2-丙基-4-戊烯酸)对肝脏产生毒性。通过体外实验,Ji Q等[6]发现丙戊酸钠能显著抑制HepG2细胞的存活,使细胞培养液中ALT、AST、LDH的活性增加,均存在浓度依赖关系,亦可使HepG2细胞中与脂肪转运和脂肪酸代谢相关的细胞色素P450 1 A1(CYP1A1),ATP结合的cassette转运体G1(ABCG1)和肉碱软脂酰转移酶1(CPT1A)的mRNA的表达水平升高,这些基因的高表达可能与丙戊酸钠的肝毒性相关。
丙戊酸钠对造血系统具有一定的抑制作用,可表现为血小板减少、贫血、红细胞肥大、白细胞减少、全血细胞减少等。在一项丙戊酸钠单药治疗癫痫的临床研究中,约有27%的患者用药后血小板数≤75×109·L-1,其中半数停药后恢复正常,半数继续治疗血小板也恢复至正常[7]。常与剂量相关,高剂量时容易发生。在一项丙戊酸钠单药治疗的双盲临床试验中,丙戊酸钠高浓度组(n= 96,目标浓度 80 ~150 μg·mL-1)发生血小板减少(PLT < 75×109·mL-1)的患者为30名(31%);低浓度组(n= 47,目标浓度25 ~50 μg·mL-1)没有患者发生血小板减少[8]。丙戊酸钠导致血小板减少,可能与血小板生成减少或体内产生了相应的IgM抗体有关。丙戊酸钠不仅可能引起血小板数目下降,还可减少血小板的聚集,减少纤维蛋白原等,增加患者出血的风险[9]。丙戊酸钠罕有引起粒细胞缺乏或中性粒细胞减少的报道[10]。但也有研究发现中性粒细胞绝对数减少的患者为26.7%(n= 45)[11]。丙戊酸钠引起白细胞减少的机制还不明确,未能从患者体内检测到针对粒细胞的抗体[10]。还有研究者提出假说,丙戊酸钠有可能减弱中性粒细胞的吞噬作用和氧化能力,降低癫痫患者的免疫能力[12]。
3.2 丙戊酸钠高浓度的确定
对于丙戊酸钠的血药浓度究竟达到多高,才会出现明显的不良反应,缺乏明确统一的观点。湖南省湘中制药有限公司生产的丙戊酸钠糖衣片的说明书中提到:“血药浓度超过120 μg·mL-1时可出现明显的不良反应”,而杭州赛诺菲民生制药有限公司生产的丙戊酸钠缓释片的说明书中提到:“如果血药浓度水平一直维持在150 μg·mL-1以上,则需要降低剂量”。 在临床应用中,丙戊酸钠治疗某些特殊类型的疾病,有效浓度范围的上限需要超过100 μg·mL-1,如某些复杂部分性发作或继发性强直阵挛发作有效浓度范围是80 ~ 150 μg·mL-1,而治疗急性躁狂时的有效浓度范围为50 ~ 125 μg·mL-1[13]。我院自开展丙戊酸钠血清浓度监测以来,患者血清浓度超过100 μg·mL-1均作为危急值上报临床;血清浓度超过90 μg·mL-1时,会在报告中出现“警惕中毒”字样。我院2011年1月1日- 2012年10月30日共监测丙戊酸钠血清浓度约3500例次,丙戊酸钠血清浓度超过90 μg·mL-1者168例(5%),其中绝大多数浓度低于160 μg·mL-1,大部分患者未出现明显中毒症状和严重不良反应。故将丙戊酸钠血清浓度在90 ~ 160 μg·mL-1的患者按血药浓度分成90 ~ 100 μg·mL-1,100 ~ 120 μg·mL-1,120 ~160 μg·mL-1三组,观察患者的肝功能与血常规的整体状态,并进行分组比较。
3.3 结果分析及对临床用药的建议
本研究中,肝功能指标异常以GGT、AST、ALP高于正常范围多见。临床上,ALT和AST可作为肝细胞损伤的指标,而ALP、GGT作为胆汁淤积的指标。但患者未发生肝脏疾病时,这些酶也可能升高,如具有酶诱导作用的卡马西平、苯妥英钠、苯巴比妥、奥卡西平(较弱)、托吡酯(较弱)都可能会升高ALT、AST、ALP、GGT的水平。GGT、ALP对于肝脏疾病的特异性不强,如ALP来源于肝脏和骨骼[14]。本研究中,22例肝酶升高的患者中,有9例联用具有肝药酶诱导作用的抗癫痫药;而ALP高于正常范围未合并其他肝酶指标升高的4名患者年龄均小于18岁,ALP升高可能与骨骼系统活跃有关。本研究未观察到肝酶升高合并PPT升高、白蛋白下降、胆红素升高的病例,提示在这组患者中未出现明显的药物性肝损害。
2例血氨升高患者,其中1例肝功能指标正常,且无明显症状;另1例合并ALP、LDH偏高,纤维蛋白原偏低,但无明显症状。血氨偏高患者,如未出现明显症状,不需进行处理,但如出现低温、嗜睡、呕吐、精神状态的变化等,就需要及时停用丙戊酸钠,接受相应的治疗[7]。
5例血小板数低于正常的患者,除2例转归不详,3例PLT在(55 ~ 89)×109·L-1的患者(其中1例合并纤维蛋白原减少,1例合并紫癜),临床均采取了审慎态度,降低了丙戊酸钠的剂量,后血小板均恢复正常。临床上,如PLT < 20×109·L-1,可能出现内脏出血,应严格卧床,避免外伤[15]。
本研究中出现中性粒细胞减少、中性粒细胞百分比减少的患者分别为23.0%和42.3%,与某些文献中提到的“罕见中性粒细胞减少”不符,可能与这组患者丙戊酸钠血清浓度较高相关。本研究中9.6%的患者RBC、HGB或HCT低于正常水平,但5例患者中有4名为女性,考虑女性的生理周期可能给检验指标带来了一定的干扰。
有1例患者癫痫发作频率增加。丙戊酸钠浓度过高,可造成癫痫发作,这一点尤其应引起临床注意。对于发作的癫痫患者,应及时监测血药浓度,再决定下一步的治疗方案。
可能是由于纳入研究的对象有限,是否出现肝功能指标异常或血常规指标异常的患者的年龄、性别、剂量、浓度等资料组间均未见显著性差异。
3.4 本研究局限之处
本研究中丙戊酸钠血清浓度在90 ~ 160 μg·mL-1的患者均未出现严重的不良反应;肝功能异常的患者大部分属于肝酶的轻度增高,且未合并临床症状;血常规指标出现异常的患者均属于轻度到中度异常。所以丙戊酸钠血清浓度 > 100 μg·mL-1是否应定义为中毒浓度或危急值还值得商榷。但是丙戊酸钠血清浓度接近或超过100 μg·mL-1时,需要严密监测其不良反应,尤其是肝脏毒性、血小板减少、白细胞减少、血氨升高等。
本研究属于回顾性研究,研究对象纳入的例数较少,且纳入病例时虽然剔除了合并其他可能影响肝功能、血常规疾病者,但缺乏用药前的检验数据,不能完全确定患者肝功能或血常规的异常与丙戊酸钠用药的相关性,故具有一定的局限性。对于高浓度丙戊酸钠对患者肝功能和血液系统的影响还需要开展大样本、前瞻性研究来进一步提供证据。
[1] 中华医学会神经病学分会脑电图与癫痫学组. 抗癫痫药物应用专家共识[J]. 中华神经科杂志,2011,44(1):56-65.
[2] Björnsson E, Olsson R. Suspected drug-induced liver fatalities reported to the WHO database[J]. Dig Liver Dis, 2006, 38(1): 33-38.
[3] Rimmer EM, Richens A. An update on sodium valproate[J].Pharmacotherapy, 1985, 5(3): 171-184.
[4] [英]希恩. C. 斯威曼(Sean C Sweetman)主编,李大魁,金有豫,汤光,等,译. 马丁代尔药物大典[M]. 原著第35版. 北京:化学工业出版社,2009:399-403.
[5] Cepelak I, Zanić Grubisić T, Mandusić A,et al. Valproate and carbamazepine comedication changes hepatic enzyme activities in sera of epileptic children[J]. Clin Chim Acta, 1998, 276(2): 121-127.
[6] Ji Q, Shi X, Lin R,et al. Participation of lipid transport and fatty acid metabolism in valproate sodium-induced hepatotoxicity in HepG2 cells[J]. Toxicol In Vitro, 2010, 24(4): 1086-1091.
[7] Noven Therapeutics, LLC. STAVZOR (valproic acid) capsule,delayed release. [EB/OL]. (2008-08-01)[2013-02-05]. http: //dailymed.nlm.nih.gov/dailymed/lookup. cfm?setid=95a4ddd8-b76a-4128-b2ed-8a36cd5738f9. html.
[8] Beydoun A, Sackellares JC, Shu V. Safety and efficacy of divalproex sodium monotherapy in partial epilepsy: a doubleblind, concentration-response design clinical trial.Depakote Monotherapy for Partial Seizures Study Group[J]. Neurology,1997, 48(1): 182-188.
[9] Angélica Fajardo, Francisco Olmos, Lina Sarmiento. Valproic acid and the risk of perioperative bleeding. Case report and literature review[J]. Rev Colomb Anestesiol, 2013, 41(1): 61-64.
[10] Hui-Chuan Hsu, Hsiang-Kuang Tseng, Shen-Chuan Wang,et al.Valproic acid-induced agranulocytosis[J]. Int J Gerontol, 2009,3(2): 137-139.
[11] Jaeken J, van Goethem C, Casaer P,et al. Neutropenia during sodium valproate treatment[J]. Arch Dis Child, 1979, 54(12):986-987.
[12] Min Zhang, Yi Wang, Xiao-chuan Wang. Valproic acid reduces the ability of neutrophils to fight infection in epileptic patients[J].Bioscience Hypotheses, 2009, 2(5): 316-318.
[13] Abbott Laboratories. DEPAKOTE-divalproex sodium tablet,delayed release [EB/OL]. (2010-5-17)[2013-02-05]. http://dailymed.nlm.nih.gov/dailymed/archives/fdaDrugInfo.cfm?archiveid = 19797. html.
[14] Ahmed SN, Siddiqi ZA. Antiepileptic drugs and liver disease[J].Seizure, 2006, 15(3): 156-164.
[15] 叶任高,陆再英.内科学[M]. 6版. 北京:人民卫生出版社,2006: 458-465.
