可注射神经生长因子缓释制剂的体外释药性能
2013-09-26于海龙项良碧周大鹏田竞毕岩
于海龙,项良碧,周大鹏,田竞,毕岩
可注射神经生长因子缓释制剂的体外释药性能
于海龙,项良碧,周大鹏,田竞,毕岩
目的:观察可注射神经生长因子(NGF)缓释制剂的一般性质和体外释药特征。方法:采用药物微球技术制备的NGF微球,与生物纤维蛋白胶混合形成NGF复合缓释制剂,并通过体外释放率和PC12细胞活性考察其体外释药性质。结果:体外实验证明,NGF复合缓释制剂可持续释放NGF达7周以上,累积释放率为63.85%,释出的NGF可促进PC12细胞分化,具有较强的生物学活性,出现神经突触样生长。结论:制备可注射NGF缓释制剂,可长期释放NGF,并具有生物活性,可作为补充外源性NGF的良好制剂。
神经生长因子;组织粘着剂;PC12细胞
神经生长因子(nerve growth factor,NGF)是神经再生微环境中的重要成分,可维持神经元存活和促进轴突再生。研究表明轴突伸展需要NGF对于生长锥直接的刺激,局部的NGF可决定神经生长方向[1]。修复周围神经损伤时,补充外源性NGF,可提高修复效果[2-4]。但NGF活性半衰期较短[5],在水溶液中活性丢失快,易受湿度、酸碱度等多种因素的影响,全身应用将被快速灭活,局部穿刺分次给药又无法保证每次释药部位的准确性。药物的微球化技术能维持NGF活性并可持续释放[6],但在实际应用中仍存在一些问题,如微球制剂早期会出现药物突释,局部应用难以固定微球。因此,笔者研究一种可注射NGF缓释制剂,报告如下。
1 材料与方法
1.1 材料
NGF(小鼠2.5 S,商品名为苏肽生,购于舒泰神公司);纤维蛋白胶(购于广州倍绣生物技术有限公司);高速低温离心机(购于上海天美公司)。
1.2 方法
1.2.1 可注射NGF缓释制剂的制备 聚乳酸/乙醇酸共聚物150mg溶于1m L的二氯甲烷溶液中形成油相,NGF 30μg和适量的牛血清白蛋白加入油相,冰浴超声分散均匀后加入10m LPBS溶液(含2%聚乙烯醇),高速匀浆 30 s,800 r/m in,搅拌 4 h,过滤,洗涤,真空冻干。将冻干微球封存于1m L玻瓶,将玻瓶置于60Co源下进行2.5×104G辐照灭菌1 h。将NGF微球放置在纤维蛋白胶的抑胰肽酶溶液中,与凝血酶溶液混合形成凝固物,NGF微球在聚合材料中的最终浓度为10mg/m L。
1.2.2 可注射NGF缓释制剂体外释放NGF曲线的测定 将1m L可注射NGF缓释制剂静置在5m L PBS(pH=7.4)中,放置37℃水浴温箱,分别在 2、4、6、12、24 h,2、4、7、10、14、21、28、35、42、49 d 时取出,高速低温离心机上以1 500 r/m in离心5min后,取上清液2m L放入-20℃冰箱冷冻保存,其余连同沉淀并补充等量的新鲜PBS液后放回缓释装置中。采用ELISA法测定NGF质量浓度,计算每次取样时释放的NGF总量,并绘制微球累积释放曲线。
1.2.3 可注射NGF缓释制剂包裹NGF的生物活性的测定 释放第1、10、28、49天的NGF被用来检测体外NGF活性。PC12细胞能在NGF的刺激下发出突起分化为神经元样细胞,因此可通过计算阳性PC12细胞的比例来考察NGF的活性。将生长良好的PC12细胞接种于预先经鼠尾胶原包被的6孔培养板中,接种密度为2×104/cm2,每孔加入2m L含体积分数为10%马血清和体积分数为5%胎牛血清的DMEM培养基,在37℃、体积分数为5%CO2及饱和湿度条件下培养3 h后随机分组,分为NGF组(阳性对照组)、不含NGF的牛血清白蛋白微球缓释制剂组(阴性对照组)和可注射NGF缓释制剂组(实验组),分别以50 pg/L的NGF、牛血清白蛋白微球的缓释液、可注射NGF缓释制剂2m L替换原细胞培养液,继续培养48 h后,在倒置显微镜随机选取视野,计数100个细胞,并计算每组中细胞最长突起长度大于胞体直径的细胞(即阳性细胞)的比例,阳性细胞比例(%)=阳性细胞数/计数细胞数×100%,每组实验重复3次。
1.3 统计学处理
采用SPSS 18.0软件处理数据,计量结果以(x±s)表示,t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 可注射NGF缓释制剂
NGF微球肉眼观察制备的微囊呈白色疏松粉末。电镜下见微球表面光滑,分散好,彼此间无粘连,粒径大小30~40μm,见图1。利用生物纤维蛋白胶混合前呈液态特性,将NGF微球加入抑胰肽酶溶液中,与凝血酶溶液混合10 s后,发生凝固,3~5m in后更明显,见图2。

图1 扫描电镜观察NGF微球表面特征

图2 可注射NGF缓释制剂凝固后形态(×40)
2.2 可注射NGF缓释制剂体外释放NGF测定结果
可注射NGF缓释制剂可持续释放NGF达49 d。6 h取样,NGF微球可释放包裹NGF总量15%,可注射NGF缓释制剂为5%;前3 d取样,NGF微球累积释放量为21%,可注射NGF缓释制剂为8%,从体外NGF释放曲线来看,可注射NGF缓释制剂可以明显减少药物突释,使药物释放更加平稳,见图3。

2.3 可注射NGF缓释制剂包裹NGF的生物活性测定结果
至第49天时,实验组可注射NGF缓释制剂活性下降不明显,与阳性对照组比较差异无统计学意义,明显大于阴性对照组,有显著性差异(P<0.01),见图 4、表 1。
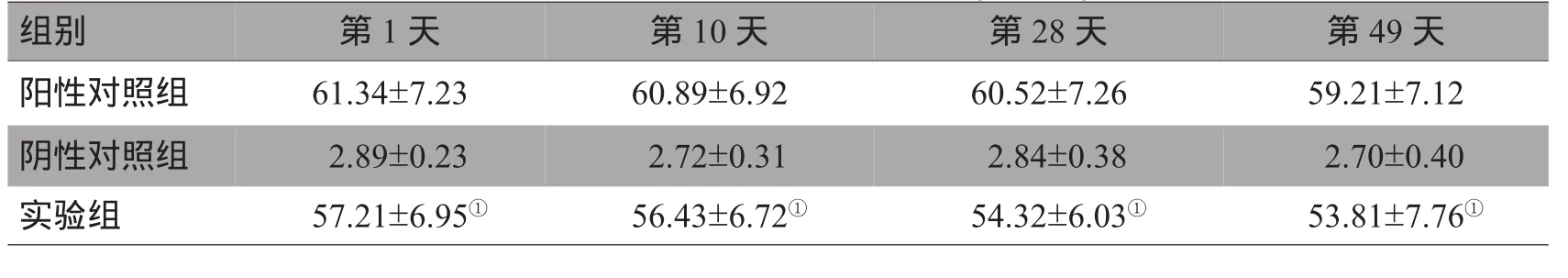
表1 3组阳性PC12细胞比例比较(%,x±s)

图4 阳性对照组(A)、阴性对照组(B)、实验组(C)阳性 PC12细胞(×200)
3 讨论
本研究在体外试验中,NGF复合缓释制剂与DRG共培养时,DRG的神经再生纤维朝NGF复合缓释制剂方向生长密集,这与复合缓释制剂中释放的NGF形成浓度梯度有关。神经损伤后,再生的轴突需要相当长的时间才能生长达到周围靶器官,在靶器官重获神经支配前,肌肉可能已经发生不可逆转的萎缩。而加快神经再生速度是完全恢复神经损伤功能的前提条件,防止其靶器官失神经萎缩。在动物体内实验,本研究应用保留基底膜等结构的化学去细胞异体神经修复神经缺损时,复合缓释制剂缓释的活性NGF可明显提高神经轴突再生的速度。
本研究采用生物纤维蛋白胶与NGF的聚乳羟基乙酸共聚物(poly-lactic-co-glycolic acid,PLGA)微球混合制成NGF复合缓释制剂。纤维蛋白胶是一种可以在体内降解的生物材料,现已有多种生长因子以纤维蛋白胶为载体进行缓释,Bhang等[7]以纤维蛋白胶作为NGF载体,体外持续释放具有生物活性NGF达14 d,局部应用方便,但纤维蛋白胶在体内降解速度比较快,影响生长因子长时间发挥其生物活性。NGF的PLGA微球具有无毒、可生物降解和生物相溶性好等特征,它最大的优势是其降解时间可受分子量和聚合物含量比例的调节,是一种较为理想的载体材料。Camarata等[8]研制了NGF的PLGA微球,它具有明显的缓释性质,体外释药研究检测到微球可持续释放NGF 5周以上,释出的NGF具有较强的生物学活性。但微球存在释药初期突释现象,造成NGF微球突释主要原因是:微球制备过程部分NGF蛋白分子存在于微球表面,或者内部存在孔洞,故而在释放初期,NGF可直接或通过孔洞迅速释放,形成突释。本研究将NGF微球与纤维蛋白胶混合形成复合体,从体外药物缓释实验可证实6 h NGF微球释放从15%降至5%,前3 d从释放30%降至15%左右,生物纤维蛋白胶与NGF微球混合后,可减少NGF微球突释情况,使NGF更平稳发挥其生物活性,并在体内应用更方便,是一种理想的NGF缓释载体。
[1]Huang J,Xiang J,Yan Q,etal.Dog Tibial Nerve Regeneration across a 30-mm Defect Bridged by a PRGD/PDLLA/β-TCP/NGF Sustained-Release Conduit[J].JReconstrmicrosurg,2012,29:77-87.
[2]Xu H,Yan Y,Li S.PDLLA/chondroitin sulfate/chitosan/NGF conduits for peripheral nerve regeneration[J].Biomaterials,2011,32:4506-4516.
[3]Sun H,Xu F,Guo D,et al.Preparation and evaluation of NGF-microsphere conduits for regeneration of defective nerves[J].Neurol Res,2012,34:491-497.
[4]Gravvanis AI,Tsoutsos DA,Tagaris GA,et al.Beneficial effect of nerve growth factor-7S on peripheral nerve regeneration through inside-out vein grafts:An experimentalstudy[J].microsurgery,2004,24:408-415.
[5]TsaiCC,Lu MC,Chen YS,etal.Locally adm inistered nerve growth factor suppresses ginsenoside Rb1-enhanced peripheralnerve regeneration[J].Am J Chin Med,2003,31:665-673.
[6]Xu X,Yu H,Gao S,etal.Polyphosphoestermicroshperes for sustained release of biologically active nerve growth factor [J].Biomaterials,2002,23:3765-3722.
[7]Bhang SH,Jeon O,ChoiCY,etal.Controlled release of Nerve growth factor from fibrin gel[J].J Biomed MaterResA,2007,80:998-1002.
[8]Camarata PJ,Suryanarayanan R,TurnerDA,etal.Sustained nerve growth factor from biodegradable polymer microsphere[J].Neurosurgery,1992,30:313-319.
Preparation and Property of In jected Controlled Release of Nerve Growth Factor
YU Hai-long,XIANG Liang-bi,ZHOU Da-peng,TIAN Jing,BI Yan.Department of Orthopedics,General Hospital of Shenyang M ilitary Area Command ofChinese PLA,Shenyang 110840,China
Objective:To observe the general properties and drug release characteristics of the injected controlled release drug vehiclesof nerve growth factor(NGF)in vitro.Methods:Themicrospheresof NGFwere prepared by drugmicrosphere technology and fixed with fibrin gels tomake the injected controlled release drug of NGF.The NGF released from microsphereswas evaluated by ELISA quantitative determ ination and PC12 cells neurite outgrowth assay.Results:NGFwas detectable from the complicated controlled release drug of NGF forat least7 weeks and the released NGF could stimulate the neuritis growth of PC12 cells.Conclusion:The complicated controlled release drug of NGF can release NGF for long time and maintain the bioactivity of NGF.The drugmay be used asexogenous NGF to improve the regeneration ofnerve.
nerve growth factor;tissueadhesive;PC12 cells
R741;R622.3
A
1001-117X(2013)06-0404-03
DOI10.3870/sjsscj.2013.06.004
沈阳军区总医院骨科沈阳110840
全军医学科学技术研究“十二五”课题(No.CWS11J209);辽宁省科技计划项目(No.2012225019)
2012-12 -06
于海龙
yuhailong118@aliyun.com
