基于HyperScan成像光谱数据的植被叶绿素反演
2013-09-26方圣辉
方圣辉,乐 源,杨 光
(武汉大学遥感信息工程学院,武汉 430079)
0 引言
成像光谱仪是一种可以同时获取图像信息与像元光谱信息的光学传感器。成像光谱技术将传统的二维成像遥感技术和光谱技术结合在一起,具有“图谱合一”的重要特性[1]。地面成像光谱仪器设备在国外起步较早,并且已经取得了很多的成果[2-3]。
植被叶绿素是植被进行光合作用最重要的物质之一,准确估算叶绿素含量对研究植被的生态效应具有重要意义。近年来,高光谱遥感数据由于具有较高的光谱分辨率,在反演植物生化参数时表现出了明显的优势。目前,基于地面与实验室点光谱数据的植被色素反演已经得到了广泛的研究,国内外也有很多基于航空或卫星平台成像光谱数据的植被色素反演方面的研究[4-5]。利用高光谱数据进行植被色素反演的方法可归纳为3类,即半经验方法、统计方法和物理模型方法。本文基于HyperScan成像光谱数据,在植被叶片光谱曲线获取及分析、相关分析以及波段选取的基础上,利用SPAD502仪器获取植被叶片的绿度值,建立了基于叶片绿度值与归一化植被指数(normalized difference vegetation index,NDVI)、简单比值指数(simple ratio index,SR)、绿波段叶绿素指数CIgreen(green chlorophyll index)、土壤调节植被指数(soil-adjusted vegetation index,SAVI)、差值植被指数(difference vegetation index,DVI)、改进的土壤调节植被指数2(modified soiladjusted vegetation index 2,MSAVI2)、三角植被指数(triangular vegetation index,TVI)和叶绿素吸收比值指数(chlorophyll absorption ratio index,CARI)等8 种植被指数的半经验模型并进行叶绿素含量反演实验,取得了较高的反演精度。
1 高光谱反射率图像获取
1.1 成像系统
HyperScan系统是一种地空(包括机载、实验室和现场应用)两用的多功能型高光谱遥感成像系统,整套系统包括高光谱传感器(HyperScan)、440系列惯导系统、一个正弦波逆变器和一台个人电脑(PC)。传感器的光谱范围为389.9~1 006 nm,光谱分辨率为1~1.1 nm,可获取572个波段的数据;曝光时间为 30.0 μs~1.5 s,信噪比为 200。考虑到应用的广泛性,该系统还配置了2种焦距不同的采集镜头(焦距分别为23 mm和12 mm),以获取不同空间分辨率的图像。该系统内部有一个扫描镜,通过开启或关闭扫描镜的运动,系统拥有摆扫和推扫2种成像方式,其中摆扫采用镜面扫描机制,扫描角度为-30°~+30°。光谱仪使用1 276×1 024面阵列CCD作为探测器,探测器像元大小为10.8 μm,每条扫描线对应图像上的1 276个像元。图1(a)为该系统工作时的实况照片,图1(b)为仪器的2种不同的扫描成像方式。

图1 HyperScan系统Fig.1 HyperScan system
1.2 图像获取
HyperScan高光谱遥感成像系统在出厂时已经进行了辐射定标,因此,要实现遥感图像像元亮度值(digital number,DN)到辐亮度的转换,只需使用出厂标定时留下的增益文件进行数据处理。
仪器的辐射定标公式为
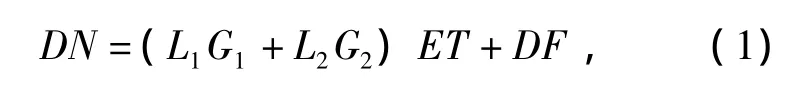
式中:L1为辐射定标后需要得到的辐亮度值(是辐亮度单元的一次衍射);L2为辐亮度单元的二次衍射;G1和G2分别为系统的一次增益和二次增益;ET为积分时间,默认值为100 ms;DF为暗电流。
将式(1)进行变形,可以得到所需的定标公式,即
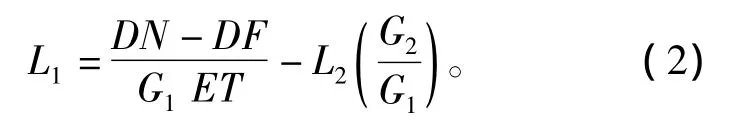
在式(1)中,当波长小于800 nm时,L2=0;当波长大于800 nm时,L2和L1之间的关系为

式中λ为波长。对每一景图像的每一个像元进行上述变换,完成高光谱图像的辐射定标。
在每景图像的采集过程中,均在扫描范围内放置了一块已知反射率的标准白板,用于得到反射率图像。具体处理方法如下:用一个N像元×N像元的窗口遍历图像的第1个波段,计算每个窗口内的和值,取最大的一个,并记下此时窗口的位置和定位白板的位置。本文取N=10像元,对每一个波段图像的每一个像元,通过式(4)计算得到反射率,即
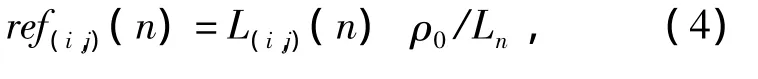
式中:ref(i,j)(n)为第 n 波段的第(i,j)个像元的反射率;L(i,j)(n)为第 n 波段的第(i,j)个像元的辐射亮度;ρ0为标准白板的反射率;Ln为第n波段的10像元×10像元白板的辐射亮度均值。
2 植被叶绿素含量反演方法
2.1 数据获取与处理
本文在实验中所采集叶片的树种主要是武汉地区常见的3种常绿阔叶植被——桂树、栀子和石楠。对同一树种在多棵树上采集树叶,按照从顶层到底层的顺序,分别采集颜色、叶龄等不同的树叶50片;并依次对每片树叶进行编号,利用HyperScan扫描获取叶片的高光谱图像,扫描方式为摆扫。图2为获取的原始图像(右上角的白色部分为采集数据时在图像范围中放置的标准白板)。

图2 叶片原始HyperScan图像Fig.2 Original HyperScan image of leaves
本文使用SPAD502叶绿素仪获取植被的叶绿素值。SPAD值也被称作“绿度”,是一个无量纲的值,是反映植物叶绿素相对含量的指标。研究表明,植被叶绿素含量随SPAD值的增加而增加,呈一定函数变化规律,且达到极显著相关的水平[6]。在获取HyperScan图像的同时,利用SPAD502叶绿素仪测量每片树叶的SPAD值,每片树叶测量10次,大部分叶片10次SPAD测量值之间的差值在0~3.5之间波动,记录其均值作为该叶片的SPAD值。
对原始HyperScan图像进行处理,得到反射率图像。在反射率图像中,取每片树叶中心的一个30像元×30像元大小的窗口,一片叶片共获取900个点;每个点对应一条光谱反射率曲线,计算900条光谱反射率曲线的平均值作为该叶片的光谱曲线。这样,每种实验树种均能得到50组光谱曲线及其对应的SPAD值。图3为使用HyperScan获取的光谱反射率曲线与使用ASD光谱仪获取的同一片栀子叶片光谱曲线的对比图。
2.2 波段选择与模型建立
在利用高光谱数据进行叶绿素含量反演的各种算法中,半经验方法由于其计算过程比较简单、所需数据容易获取等优点,已得到了广泛的研究和应用[7]。本文即采用半经验方法,通过建立叶绿素含量和某些波段组合形成的8种植被指数(见表1)的关系,反演植被叶绿素含量。

表1 本文使用的植被指数Tab.1 Vegetation indices used in this paper
表 1 中:ρnir,ρgreen,ρred分别表示近红外波段反射率、绿波段反射率、红波段反射率;nir,green,red分别表示与 ρnir,ρgreen,ρred相对应的波长值。
本实验选取表1中的8种常用植被指数进行叶绿素含量反演。在这8种植被指数中,NDVI,SR,CI,SAVI,DVI和MSAVI2是2波段植被指数,而TVI和CARI是3波段植被指数。其中SAVI中L的取值需要根据测量土壤的光谱曲线并进行拟合得到;本次实验数据是直接获取叶片光谱,并没有获取土壤的光谱信息,实验中尝试变换L的取值,发现其对叶绿素反演的影响较小,最终本文选取L=1。两种3波段植被指数TVI和CARI的原始定义中包含670 nm的红波段[8],但从实验中单波段相关分析的结果可知,HyperScan获取的植被光谱曲线在670 nm处的反射率与植被SPAD值的相关性形成了一个波谷(即相关性较其他波段要小)。因此本文在使用这两种3波段植被指数进行叶绿素反演时,借用了这些植被指数的形式,但并没有完全严格按照其原始的定义来选取波段,具体的波段在进行相关分析后选取。
HyperScan成像光谱数据的波段较多,光谱分辨率也较高,为了更好地分析窄波段的光谱指数对叶绿素反演效果的影响,对于某种植被指数,在572个波段中任意选取2个波段进行组合,计算该植被指数与对应植被的SPAD值之间的相关系数,生成相关系数图;根据各个植被指数的定义,选取与SPAD值相关性最高的2个波段建立线性模型。在计算2种3波段组合植被指数的相关系数时,为运算方便,本文采取固定绿波段、计算红外波段和红波段组合的植被指数与对应SPAD值的相关系数的方法,绿波段的选取和CI指数中绿波段的选取相一致。根据所选择的波段建立了叶绿素含量反演模型,并对总体模型的精度进行了验证。
2.3 反演模型验证
随着成像光谱仪的光谱波段的增加,数据量也随之增大。为了验证HyperScan的光谱波段的增加是否有利于叶绿素含量反演精度的提高,设计了波段合并实验,通过将HyperScan的光谱波段进行合并,发现随着光谱波段的合并和光谱分辨率的减小,反演模型的精度呈现一定的下降趋势,证明Hyper-Scan成像光谱数据的波段的增加有利于叶绿素含量反演精度的提高。
3 实验结果与分析
3.1 波段相关性分析
为了提高叶绿素含量反演的精度,在选择具体

图3 HyperScan与ASD数据对比Fig.3 Comparison between HyperScan and ASD Data
与ASD测量的光谱反射率数据相比,HyperScan数据有明显的区别。在波长为550 nm附近的反射峰值更加明显,大于700 nm的近红外波段反射率更高,小于500 nm处以及红边反射率与ASD数据基本一致,只是红边位置相对ASD的左移;整条光谱曲线在波长小于700 nm时比较平滑,在大于800 nm的近红外波段开始光谱曲线的平滑性减小,呈现出明显的锯齿状的反射坪,说明大于800 nm时光谱曲线的噪声较大。为了提高植被叶绿素含量反演的精度,尽量避免使用波长大于800 nm处的反射率值。HyperScan数据与ASD数据的不同,使得在利用HyperScan数据进行叶绿素含量的反演时,不能完全利用适合于ASD这种地面点光谱仪器所获取光谱数据的反演方法,而是要对HyperScan数据的反射率光谱进行一定的分析,选取适合于HyperScan数据的光谱波段。的植被指数之前,首先分析了3种植被光谱曲线与SPAD值之间的单波段相关系数,分析结果如图4所示。
3种植被呈现出相似的相关特性,在520~650 nm的绿波段和红波段以及在700~730 nm的近红外波段的相关系数较高,在小于500 nm和大于750 nm的波段处相关系数较低,同时在675 nm附近有一个相关系数先减小后增加的过程。因此,利用绿波段、红波段和近红外波段组合进行叶绿素含量反演,相对其他波段组合会有更高的精度。总体的相关系数同3种植被的一致,同时受到3种植被相关系数的影响,其取值介于相关系数较高的栀子、桂树和相关系数较低的石楠之间。表2列出了各植被指数与对应SPAD值之间相关系数最大的值以及对应的波段。
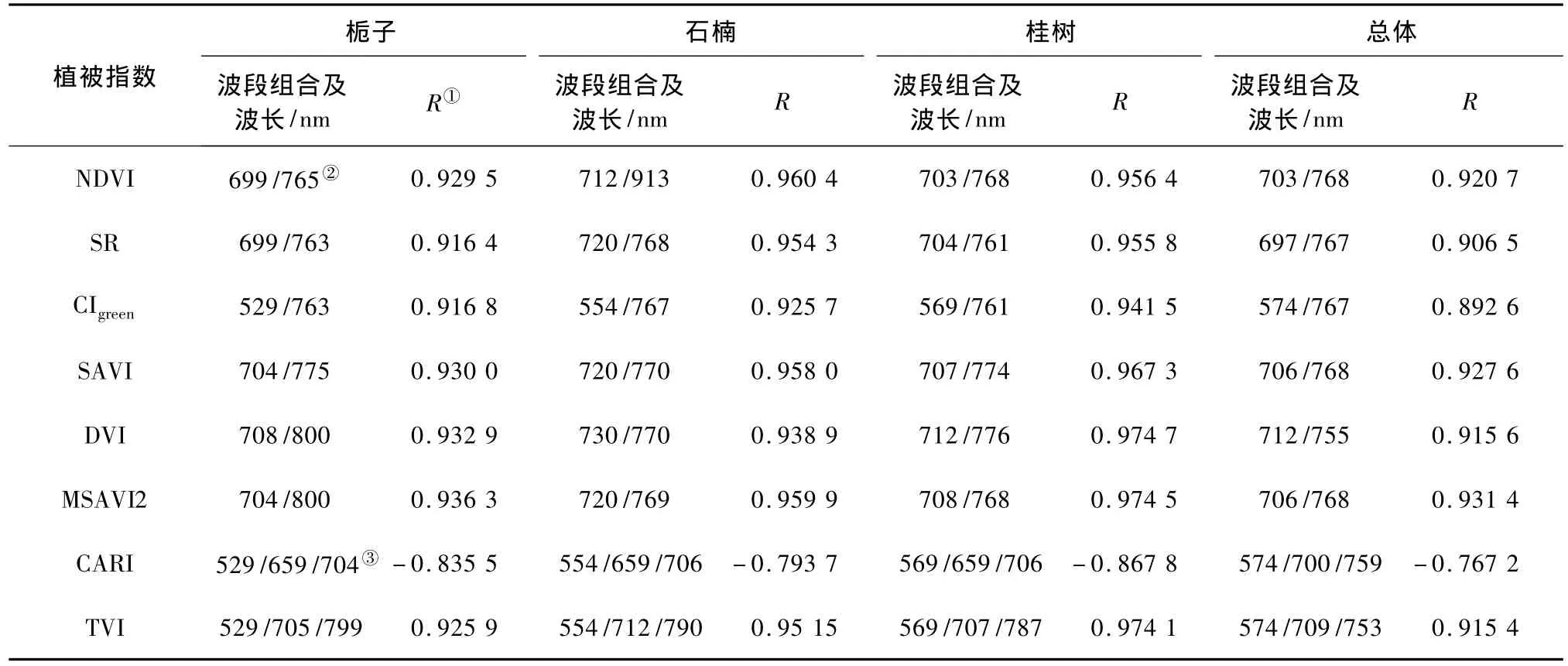
表2 波段选择与相关系数Tab.2 Band selection and correlation coefficient
对于某种植被来说,不同植被指数的波段选择具有相似性,例如栀子的波段选取基本上集中在530 nm,700 nm,770 nm和800 nm等处的波段。在这些波段中,530 nm和700 nm处的波段在单波段相关分析中相关性较高;700 nm处在红边波段,与传统的地面点光谱数据研究中应用的植被指数的定义有一定区别,但还是在植被指数定义的范围之中;而770 nm和800 nm处的波段在单波段相关分析中相关性并不高,但在多波段相关性分析中,经过波段组合,其相关性也超过了单波段相关分析。
8种植被指数中,2种3波段的植被指数最终选择的波段组合与原始定义有一定差别。除CARI呈现出负相关特性并且相关系数较其他植被指数偏小以外,其他植被指数均呈现出较高的相关特性(其中最大值为桂树的DVI指数,R=0.974 7;最小值为栀子的CI指数,但R>0.9)。8种植被指数中,SAVI,DVI,MSAVI2和TVI这4种植被指数相关系数略大于NDVI,SR和CI,明显大于CARI。总体的相关系数均小于单一植被的相关系数,这说明对于HyperScan数据来说,混合植被的叶绿素反演精度会低于单一植被的叶绿素反演精度。
3.2 模型建立与验证
利用波段分析得到的敏感波段进行叶绿素含量反演模型的建立与验证。由3种单一植被数据组成的总体数据共有150组,其中用于波段分析的数据共120组,余下的30组作为模型验证数据。这30组数据是从每种植被数据中随机选出10组组合而成的。图5示出总体数据的建模(左)与验证(右)图形。
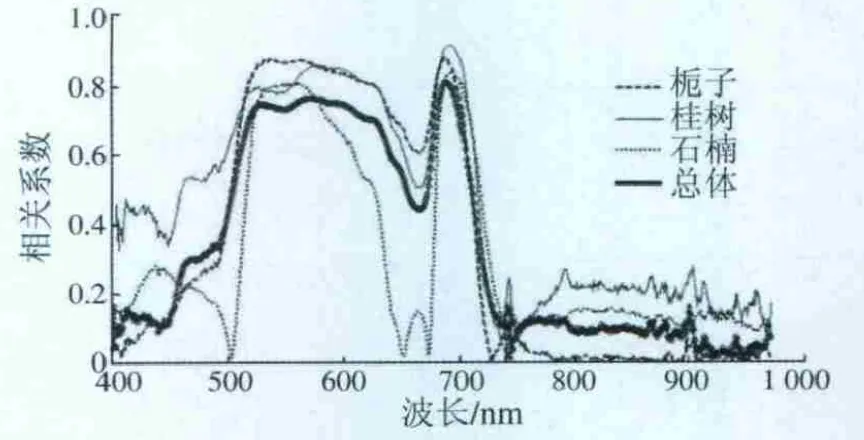
图4 单波段相关系数Fig.4 Correlation coefficient of single band
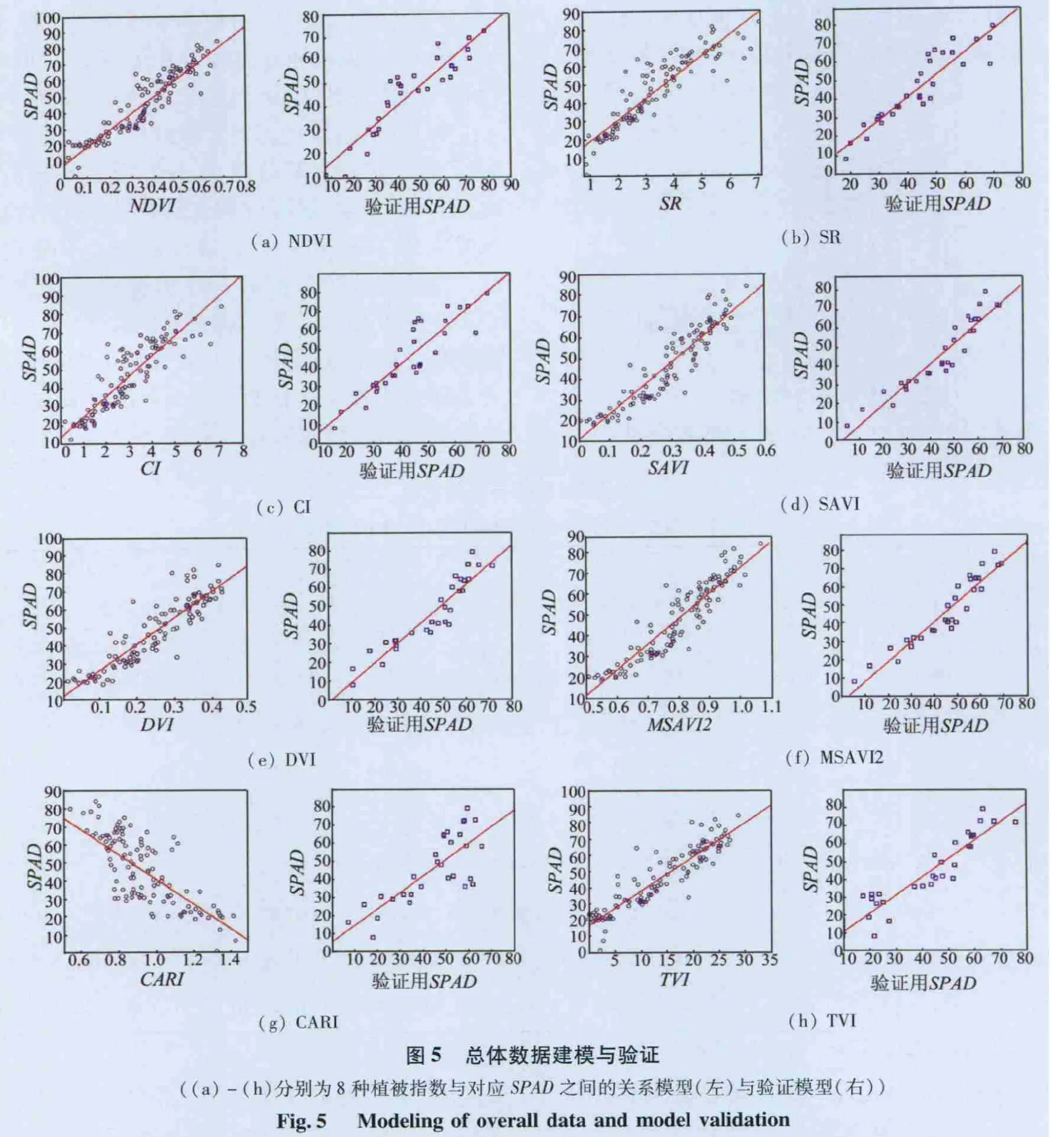
图 5(a)- (h)分别为 NDVI,SR,CI,SAVI,DVI,MSAVI2,CARI和 TVI与对应 SPAD 之间的关系模型与验证模型,其具体的模型参数在表3中列出。

表3 模型参数Tab.3 Model parameters
从表3可以看出,在8种植被指数的模型中,反演精度最高的是SAVI和MSAVI2(决定系数接近0.9),CARI精度较低(决定系数只有 0.6),其余各植被指数模型精度则普遍较高(决定系数均大于0.8 而小于0.9)。
3.3 波段合并实验
高光谱数据在提高光谱分辨率的同时,也使得数据量急剧增大,这对数据获取、存储与处理提出了一定的要求。为了探究利用HyperScan高光谱数据进行叶绿素反演是否需要如此高的光谱分辨率的问题,本文进行了波段合并实验——通过合并相邻波段数据,研究模型的决定系数和均方根误差随着合并波段数目增加而产生的变化情况。具体实验过程是:以建立模型时选取的波段为中心波段,将相邻波段数据分别进行3,5,7,…,直到21个波段相加并取其均值;再利用均值计算对应的植被指数,建立模型。图6是波段合并实验的结果图,图6(a)和(b)分别示出合并波段数与模型的决定系数R2和均方根误差RMSE之间的关系。

图6 波段合并实验结果Fig.6 Experimental results of band combination
由于CARI指数的结果与其他指数相差较大,为了更直观的显示波段合并对反演模型的影响,图6中并没有显示CARI指数,但CARI指数的变化趋势与其他植被指数是一致的。
由图6可以看出,随着HyperScan数据波段的不断合并,除DVI指数外,其他指数的模型精度均呈单调下降趋势。在合并波段数为7-15时,精度下降趋势较快;当合并波段增加至17波段时,精度下降趋势减小,模型精度趋于稳定。但DVI指数的模型精度呈先减小、后增大的趋势。
3.4 叶绿素含量反演
利用3.2中建立的总体模型,对桂树的Hyper-Scan图像进行了叶绿素含量的反演,统计了50片叶片影像范围中的叶绿素含量的均值,并与实测值进行了比较。图7显示了部分叶片的叶绿素含量反演结果图,图7(a)—(h)分别表示NDVI,SR,CI,SAVI,DVI,MSAVI2,CARI和 TVI等 8 种植被指数的叶绿素含量反演结果。
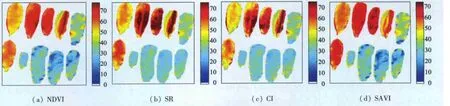
图7-1 桂树数据叶绿素含量反演结果Fig.7-1 Inversion results of HyperScan data
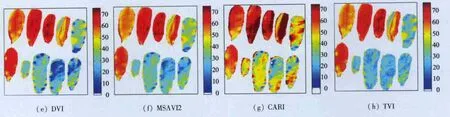
图7-2 桂树数据叶绿素含量反演结果Fig.7-2 Inversion results of HyperScan data
从图7可以看出,在8种植被指数中,CARI模型的反演精度较差,表现在同一片叶片反演的SPAD值变化范围较大;除模型反演精度较差的CARI之外,其余7种植被指数反演的同一片叶片SPAD值的变化范围不大。图7中第一行左起第4片叶片出现了左右两边叶绿素值不一致的现象,经过观察原始图像发现,这是由于图像扫面瞬间因叶片被风吹动导致部分叶片背面向上所致。尽管在提取光谱时避开了这些区域,但进行图像的叶绿素含量反演时无法避开这些区域;为了减小对实验结果的影响,人为去除了被风吹动叶片的反演结果。对叶绿素含量反演误差进行了统计(表4)。
从表4可以看出,对整景图像而言,SAVI,DVI,MSAVI2和TVI这4种植被指数的叶绿素含量反演精度较高;NDVI,SR和CI次之;CARI的反演精度最低(反演的平均误差超过了30%),其余7种植被指数的反演平均误差均在15%以内。
4 结论
本文利用HyperScan采集不同植被叶片的高光谱图像数据,采用 NDVI,SR,CI,SAVI,DVI,MSAVI2,TVI和CARI等8种植被指数反演模型进行植被叶绿素含量反演实验,同时进行了波段合并实验,并比较了在逐步合并波段的情况下各种模型的反演精度。实验结果表明:
1)在本文选取的植被指数中,2波段植被指数反演叶绿素含量精度普遍高于3波段植被指数。
2)波段合并的实验表明,随着波段的逐步合并,模型的反演精度逐渐下降;因此,光谱分辨率较高的高光谱图像数据更适合于植被叶绿素含量反演。
3)本文中的反演模型精度普遍较高,说明利用地面高光谱图像进行叶片叶绿素反演是可行的,且采用叶片内光谱反射值的均值进行叶片的叶绿素含量反演有很高的反演精度。
4)由于HyperScan数据本身的特点,导致了红边的位置与一般的地面点光谱仪(ASD)数据有一定的不同,同时在波长大于800 nm处的反射率曲线呈现明显的锯齿状,因此在相关性分析的基础上进行了波段的选择,并且没有选择波长在800 nm以上的波段;这也导致了选择的特征波段与传统的地面点光谱仪器的特征波长有所不同,但是所选择的波段仍然是在植被指数所定义的范围中的,除了2种3波段的植被指数的形式与原始定义的形式有一定的差别,其余的植被指数均与原来的定义一致。
[1]童庆禧,薛永祺,王晋年,等.地面成像光谱辐射测量系统及其应用[J].遥感学报,2010,14(3):409-422.Tong Q X,Xue Y Q,Wang J N,et al.Development and application of the field imaging spectrometer system[J].Journal of Remote Sensing,2010,14(3):409-422.
[2]Borregaard T,Nielsen H,Nrgaard L,et al.Crop- weed discrimination by line imaging spectroscopy[J].Journal of Agricultural Engineering Research,2000,75(4):389-400.
[3]Monteiro S T,Minekawa Y,Kosugi Y,et al.Prediction of sweetness and amino acid content in soybean crops from hyperspectral imagery[J].ISPRS Journal of Photogrammetry and Remote Sensing,2007,62(1):2-12.
[4]Rock B N,Hoshizaki T,Miller J R.Comparison of in situ and airborne spectral measurements of the blue shift associated with forest decline[J].Remote Sensing of Environment,1988,24(1):109-127.
[5]Ustin S L,Gitelson A A,Jacquemoud S,et al.Retrieval of foliar information about plant pigment systems from high resolution spectroscopy[J].Remote Sensing of Environment,2009,113(s1):s67-s77.
[6]李 辉,白 丹,张 卓,等.羊草叶片SPAD值与叶绿素含量的相关分析[J].中国农学通报,2012,28(2):27-30.Li H,Bai D,Zhang Z,et al.Correlation analysis between SPAD value and chlorophyll content of leaf of leymus chinensis[J].Chinese Agricultural Science Bulletin,2012,28(2):27-30.
[7]Steele M,Gitelson A A,Rundquist D.Research Note:Nondestructive estimation of leaf chlorophyll content in grapes[J].American Journal of Enology and Viticulture,2008,59(3):299-305.
[8]Broge N H,Leblanc E.Comparing prediction power and stability of broadband and hyperspectral vegetation indices for estimation of green leaf area index and canopy chlorophyll density[J].Remote Sensing of Environment,2001,76(2):156-172.
[9]Bannari A,Morin D,Bonn F,et al.A review of vegetation indices[J].Remote Sensing Reviews,1995,13(1/2):95-120.
[10]Peng Y,Gitelson A A.Application of chlorophyll- related vegetation indices for remote estimation of maize productivity[J].Agricultural and Forest Meteorology,2011,151(9):1267-1276.
