低温固体氧化物燃料电池电解质材料
2013-09-25吴天植辛显双王绍荣占忠亮
韩 达,吴天植,辛显双,王绍荣,占忠亮
(中国科学院上海硅酸盐研究所,上海 200050)
低温固体氧化物燃料电池电解质材料
韩 达,吴天植,辛显双,王绍荣,占忠亮
(中国科学院上海硅酸盐研究所,上海 200050)
低温化是固体氧化物燃料电池(SOFC)发电技术的重要发展趋势。SOFC工作温度的降低不仅可极大地降低材料及制备成本,更重要的是可极大地提高其长期运行的稳定性。电解质是SOFC的核心部件,可以采用电解质薄膜化或新型电解质材料来降低SOFC的工作温度。本文概述了目前被广泛研究的低温SOFC的电解质材料,并从其结构及性能出发,重点阐述了它们各自的优点和局限性。
低温SOFC;新型电解质;离子电导率
1 前言
固体氧化物燃料电池(SOFC)是一种全固态能量转换装置,通过电化学氧化还原反应将燃料化学能直接转化成电能,具有发电效率高、环境友好、燃料适应性广和高温余热可回收等优点,在家庭热电联供、便携式电源、汽车辅助电源和大型分布式电站等领域具有广阔的应用前景。SOFC单体电池由致密的氧化物电解质和多孔陶瓷阴阳极构成,单体电池与集流层、连接体、密封材料等构成重复单元,这样的重复单元相互串联组成大功率电池堆。根据工作温度区间的不同,SOFC大致可以分为高温型(900~1 000℃)、中温型(700~850℃)和低温型(400~600℃)。高温工作不仅提高了SOFC材料成本,而且带来了其稳定性问题,阻碍了实际应用。随着工作温度的降低,合金氧化速度大大下降,价格低廉的不锈钢合金可以用作单电池间的连接体材料。此外,低温化可以降低电池多层陶瓷结构的热应力,减缓电极材料的老化速度,提高电池输出功率的长期稳定性。
电解质是SOFC最核心的部件,其荷电输运特性和热膨胀性质不但直接影响电池的工作温度和电能转换效率,还决定了与之相匹配的阴极和阳极材料以及相应制备技术的选择。一般而言,SOFC电解质材料需要具备以下条件:
1)离子电导率高:可降低电解质隔膜的欧姆电阻;
2)可以忽略的电子电导率:可减小电池内短路电流;
3)在氧化和还原气氛下都具有较好的稳定性;
4)机械强度高:在燃料电池工作条件下不易发生电解质开裂等现象。
氧化钇稳定氧化锆(YSZ)是研究最充分并得到实际应用的固体电解质材料,800℃时氧离子电导率为0.026 S/cm,10 μm厚电解质隔膜的内阻仅仅为0.038Ω·cm2。Souza等构建的中温阳极支撑10μm厚YSZ电解质薄膜电池在800℃获得了1.9W/cm2的最大输出功率[1]。不过,600℃时YSZ氧离子电导率只有0.002S/cm,10 μm厚YSZ电解质薄膜电阻高达0.5 Ω·cm2,而要获得1W/cm2的最大输出功率,电池总内阻应低于0.3Ω·cm2。可见,YSZ已不符合高性能低温SOFC对电解质材料的要求。目前,可用于低温SOFC的固体电解质材料主要有镓酸镧基电解质、氧化铈基电解质、氧化铋基电解质和质子导体电解质等体系。
2 镓酸镧基电解质
钙钛矿型氧化物(基本分子式为ABO3)具有四方对称结构,使得氧离子在晶格中快速扩散成为可能,而且该结构比较稳定,能够容忍A位和B位离子半径的较大变化,同时,通过A位和B位的低价离子取代可以引入大量的氧空位。因此,在探寻新的氧离子导体研究中,钙钛矿结构氧化物受到人们越来越多的关注。一般认为,氧离子沿BO6八面体的(110)边走最直接的直线路径跳跃到最邻近的空位,也就是穿过由2个A位离子和1个B位离子构成的三角形瓶颈区域DAAB(见图1),可见,BO6八面体的倾斜度直接影响着氧离子迁移过程,晶体对称性增加,BO6八面体倾斜度降低,瓶颈区域增大,迁移就变得相对容易。
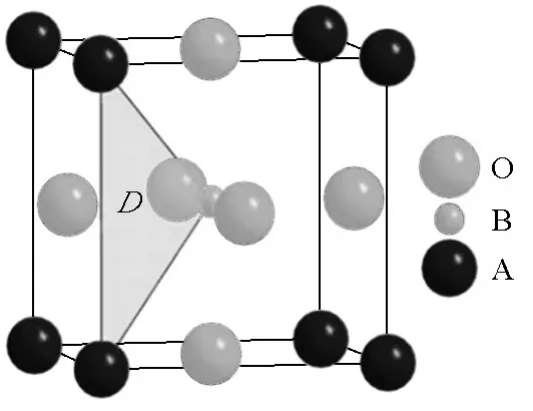
图1 钙钛矿结构中氧离子迁移模型Fig.1 Migration pathway of the oxide-ion in perovskite oxides
在钙钛矿结构镧系氧化物LaBO3(B为Al、Ga、In、Sc、Lu)和稀土元素镓酸盐中,LaGaO3晶胞自由体积大,结构容忍因子高,具有最大的氧离子电导率和氧离子迁移数以及最小的氧离子迁移活化能,因而成为研究得较多的钙钛矿结构氧离子导体。La3+的离子半径为0.106 nm,与之相近的碱土金属离子有 Ca2+(0.100 nm)、Sr2+(0.116 nm)和 Ba2+(0.136 nm)。实验显示,Sr2+掺杂效果最佳,随着Sr2+掺杂量的增加,La1-xSrxGaO3氧离子电导率上升,但掺杂量超过一定量后,氧空位团簇和杂质相等因素导致电导率反而下降。Ga3+的离子半径为0.062 nm,在研究的B位掺杂离子Mg2+、In3+和Al3+中,Mg2+的离子半径(0.072 nm)与之相近,对氧离子电导率的提升效果也最为显著。另一方面,理论计算显示掺杂离子在提高晶格中氧空位浓度的同时也增加了氧离子迁移活化能,使得氧离子穿越DAAB三角形瓶颈区域更加困难[2]。
Huang等研究了800℃不同Sr2+和Mg2+掺杂量时La1-xSrxGa1-yMgyO3(LSGM)固体电解质的氧离子电导率[3],其在x=0.2、y=0.17时的氧离子电导率高达0.17S/cm。La1-xSrxGa1-yMgyO3电导率与温度的关系如图2所示,电导率活化能为0.80 eV,600℃时的氧离子电导率为0.03S/cm,是YSZ在同等温度下电导率的20倍。为了进一步提高离子电导率,Ishihara等尝试在B位掺入铁、钴、镍、铜和锰等离子,由于Fe3+(0.064 nm)、Co3+(0.061 nm)和Ni3+(0.060 nm)离子半径与Ga3+(0.062 nm)相近,因此可以在LaGaO3晶格中稳定存在并提高氧离子电导率,它们的最佳掺杂量分别为3%、8.5%和7%[4]。
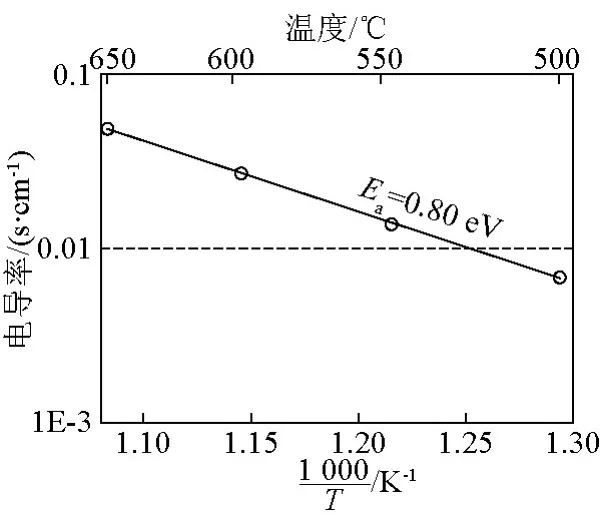
图2 LSGM电导率和温度的关系Fig.2 Conductivities as a function of temperature for LSGM
作为固体电解质材料的一个重要要求是尽可能低的电子或者空穴载体浓度和电导率,Baker、Yamaji和Kim等研究了La1-xSrxGa1-yMgyO3的电子和空穴导电行为以及氧离子迁移数[5~7],研究结果显示,在10-25~1 atm(1 atm=101 325 Pa)这样一个很宽的氧分压范围内,其电子或者空穴电导率要比离子电导率低2~3个数量级。进一步研究表明即便在1 000℃高温下LSGM在10-23~1 atm氧分压范围内氧离子迁移数都可以达到0.99。可见,LSGM基本上是一个纯的离子导体,作为燃料电池的电解质隔膜产生的内短路电流完全可以忽略不计。
从荷电输运特性以及其在氧化和还原性气氛下的热稳定性等角度考虑,LSGM都是一种很有应用前景的低温固体电解质材料,不过,LSGM在实际应用过程中也遇到一些困难。首先,LSGM成分复杂,化学窗口比较窄,在合成中很容易产生LaSrGaO4和LaSrGa3O7等杂质相,导致其电导率下降,这也是文献中电导率差异较大的原因。其次,LSGM与常用SOFC电极材料化学相容性差,导致其薄膜化比较难以实现。LSGM会与传统阳极材料氧化镍在高温下发生化学反应,生成LaSrGaO3、LaSrGa3O7、LaSrGa(Ni)O4−δ和 LaNiO3等导电性较差的杂质相,也会与目前常用的钙钛矿结构阴极如La1-xSrxMnO3(LSM)和La1-xSrxCo1-yFeyO3(LSCF)等在高温下发生金属原子互扩散,生成导电性或者催化活性较差的化合物,或者在电解质隔膜内引入电子导电性。
针对LSGM高化学反应活性和不易薄膜化等问题,解决方法主要有3种:一是在LSGM电解质与电极之间引入La0.4Ce0.6O2-δ(LDC)过渡层,阻止其界面扩散和化学反应等行为。Bi和Lin以及Guo等利用高温共烧结技术开发出了基于LDC阻隔层的LSGM薄膜电解质电池,750℃时最大输出功率可以达到1.1 W/cm2[8~10]。二是采用一体化电池结构,也就是首先采用高温共烧结技术获得“多孔-致密-多孔”的LSGM复合膜,其中致密电解质层厚度为10~20 μm,再利用化学液相浸渍技术将阴极和阳极电催化薄膜低温沉积于多孔LSGM层的孔内壁,避免LSGM与电极活性材料之间的界面扩散和化学反应,这样的单电池在550℃下可以获得超过1 W/cm2的最大输出功率[11,12]。三是利用物理和化学气相镀膜技术沉积电解质薄膜,这些技术主要包括射频溅射、磁控溅射和脉冲激光薄膜沉积等。由于电解质薄膜低温处理即可致密,无需高温烧结,因此可以完全避免金属原子在电极-电解质界面的互扩散行为,Ishihara等采用脉冲激光镀膜技术开发的LSGM薄膜电池在600℃下可以获得1.9 W/cm2的最大输出功率[13]。
3 氧化铈基电解质
氧化铈是面心立方萤石结构,铈离子位于氧离子构成的简单立方点阵中心位置,配位数为8,而氧离子则占据铈离子形成的四面体中心位置,配位数为4。纯氧化铈电导率非常低,600℃时的氧离子电导率约为1×10-5S/cm,但是当用异价离子如二价碱土金属离子或者三价稀土金属离子部分取代CeO2中的Ce4+时,为了保持电荷平衡,晶格内就会产生一定的氧空位,因此,掺杂氧化铈的氧离子电导率便大大提高。
实验发现,碱土金属氧化物CaO和SrO掺杂可以显著降低氧化铈电解质的电导活化能,并提高氧离子电导率,但是BaO和MgO在氧化铈晶格中的溶解度较小,对其电导性能影响很不明显。另一方面,稀土氧化物在氧化铈晶格中的溶解度要比碱土金属氧化物大很多,相应地,氧离子电导率也要高得多。一定温度下掺杂氧化铈的氧离子电导率主要取决于掺杂离子的性质和浓度,其中,掺杂离子半径常常起着决定性的作用。掺杂离子半径与Ce4+离子半径越接近,由掺杂所造成的点阵弹性应变能越小,氧空位传输的迁移活化能越低,氧离子电导率也就越高。Sm3+的离子半径为0.096 nm,Gd3+的离子半径是0.094nm,它们与Ce4+的离子半径(0.094nm)最为接近,所以氧化钆掺杂氧化铈(GDC)和氧化钐掺杂氧化铈(SDC)在所有掺杂氧化铈电解质中具有最高的氧离子电导率。500℃时10%Sm2O3掺杂CeO2和10%Gd2O3掺杂CeO2的氧离子电导率分别为5×10-3S/cm和3.8×10-3S/cm[14]。
除了掺杂离子半径对电导率有影响外,掺杂离子浓度对氧化铈基固体电解质的氧离子电导率也有着非常重要的影响。一般而言,当掺杂离子浓度比较低时,氧空位相对独立,电导率会随着掺杂量的增加和氧空位的增多而上升;而当掺杂离子浓度过高时,原本相对自由的氧空位会相互缔合,造成有效氧空位载流子浓度降低。因此,掺杂氧化铈体系的电导率随掺杂离子浓度的变化会出现最大值。实验证明,掺杂量在10%~20%时一般可得到最高的电导率。
由于掺杂氧化铈固体电解质在低温下具有较高的氧离子电导率,其薄膜电解质电池因而展示了良好的电性能,比如,600℃时最大输出功率超过1 W/cm2[15],但是掺杂氧化铈作为电解质隔膜也存在两方面的缺点。首先,在SOFC阳极侧的低氧分压条件下,掺杂氧化铈中的四价铈离子会部分被还原为三价铈离子,在电解质隔膜内引入电子电导,形成内短路电流,造成电池输出电压下降,这也是其作为电解质时电池开路电压比理论值低很多的原因。其次,四价铈离子在向三价铈离子的转变过程中,离子半径由原先的0.094 nm增大到0.097 nm,这种晶格膨胀会使材料机械性能变差,单电池结构和性能的长期稳定性也会受到影响[16]。不过,工作温度越低,氧化铈基电解质电子电导产生的负面影响也就越小,故而氧化铈基薄膜电解质电池适合在600℃或者更低温度下工作。实验发现,即便在400~500℃下,单电池的开路电压也只有0.95 V,远远低于约1.1 V的理论值,这也在很大程度上限制了电池的能量转换效率。为了抑制氧化铈基固体电解质的电子导电性,提高其在还原性气氛下的结构稳定性,Maricle等提出了双掺杂的思路。实验证实,在GDC固溶体中共掺杂少量的Pr[17],电解质有效区域显著扩大,其低氧分压临界值可以降低两个数量级。此外,在掺杂总量相同时,双掺杂体系往往要比单掺杂体系具有更高的氧离子电导率,这是由于共掺杂能够产生更多的自由氧空位。解决还原性气氛下四价铈离子向三价铈离子转变问题的另一思路是在掺杂氧化铈电解质的阳极或者阴极侧添加一个纯氧离子导体阻隔层,这个纯氧离子导体可以是氧化锆基电解质,也可以是氧化铋基电解质,该阻隔层的厚度因纯氧离子导体类别不同而有所差异。实验证明,该方法对于切断电子传导回路具有一定的效果,不过,由于掺杂氧化铈与氧化锆或氧化铋基电解质在高温下会发生界面扩散或者化学反应,因而只能采用低温镀膜技术沉积电解质薄膜。
4 氧化铋基电解质
氧化铋是一个多晶型氧化物,纯Bi2O3在室温下为单斜结构的α相,加热到730℃则转变为面心立方结构的δ相。由于Bi2O3的熔点为825℃,δ-Bi2O3仅在730~825℃这样一个很窄的温度区间内存在。而高温δ相在降温过程中,又会在650℃和640℃分别析出β相和γ相,在此过程中会伴随着巨大的体积变化,使得材料的机械性能受到很大破坏。δ相为阴离子缺位萤石型结构,具有25%的本征无序氧空位,也就是说氧离子只是随机占据75%的氧亚晶格(见图3)。同时,铋离子极强的极化能力促使氧离子瓶颈通道增大,氧离子迁移相对容易。因此,δ相具有非常高的氧离子电导率,730℃时的氧离子电导率高达1 S/cm,比同等温度下的YSZ要高出近两个数量级。为了能在低温下获得稳定的δ相并克服相变过程因体积变化而产生的机械应力,等价或者异价离子常常用来部分取代铋离子,稀土金属离子掺杂及其与高价态离子的共掺杂可以将δ相稳定到α→δ的相变温度以下。
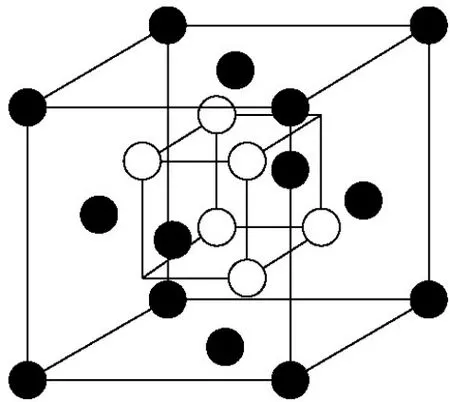
图3 δ-Bi2O3晶胞示意图Fig.3 Unit cell of δ-Bi2O3
另一种与Bi有关的电解质材料是钒酸铋(Bi4V2O11),其结构中同样含有很高的氧空位浓度,通过合适的掺杂后也可以将其高电导率γ相稳定在室温。在掺杂钒酸铋氧化物中,Cu掺杂的钒酸铋(BICUVOX)具有最高的电导率[18]。虽然铋基氧化物有很高的氧离子电导率,但是从应用的角度来看,这种电解质材料并不适合作为SOFC的电解质。铋基电解质的问题主要有3个方面:a.在低氧分压下铋会被还原,使材料中出现电子电导;b.铋基电解质高的热膨胀系数使得能与其匹配的电极很少;c.铋基电解质的热稳定性和相结构的长期稳定性也还有待考察。
5 质子导体电解质
1980年,Iwahara[19]等人发现当气氛中有水蒸气存在的时候,某些掺杂钙钛矿型氧化物在高温会表现出质子传导的特性。后来的实验和理论分析认为,其质子形成和传导机理分为4步[20,21]:a.首先通过低价离子掺杂引入氧空位(见式1);b.水蒸气在其表面解离出质子和OH-离子;c.由于化学吸引力,解离出的质子同晶格氧进行结合,产生质子缺陷(OH∙O),而OH-可以直接占据氧空位形成质子缺陷(见式2);d.质子在两个相邻的晶格氧之间实现迁移,即OH....O→O...H...O→O....HO(见图4)。

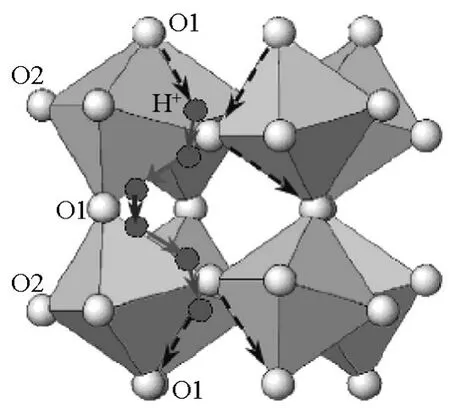
图4 ABO3结构中质子迁移示意图Fig.4 Schematic illustration for proton migration in ABO3
同YSZ、SDC和LSGM等氧离子导体相比,质子导体具有更小的电导活化能,在低温下即具有很高的电导率。在所有钙钛矿型质子导体氧化物中,掺杂铈酸钡具有最高的电导率,但是它在酸性气氛下(CO2、SO2、H2O)不稳定,会逐渐分解为BaCO3、CeO2或Ba(OH)2,阻碍了其应用。为了解决这个问题,人们通过引入一些氧化物进行掺杂,例如Nb2O5、Ta2O5和SnO2等,通过部分取代钙钛矿结构中的CeO2调节氧化物的Lewis酸性,从而增加BaCeO3材料的化学稳定性。但是,相对于未掺杂这些氧化物的BaCeO3系材料来说,这些氧化物的引入通常会使材料的质子传导率降低一个数量级左右。
掺杂BaZrO3基氧化物由于在H2O或CO2存在的气氛中具有很高的稳定性,因此也受到了人们的重视。但是其质子传导率很低,同时,BaZrO3难以烧结的性质也限制了它的应用。近期对BaZr0.8Y0.2O3-δ(BZY20)[22]的研究证实,如果能够通过选择合适的电解质制备方法如脉冲激光沉积等,最大限度地排除该电解质材料中晶界部分对质子传导的不利影响,就将会得到在低温下具有优越的质子传导率以及良好稳定性的电解质材料,在工作温度低至350℃的时候依然可以达到0.01 S/cm的质子传导率。超细粉体的合成可以提高其烧结活性,并由此来提高该材料的质子传导率。Yamazaki等用溶胶凝胶法合成掺杂BaZrO3粉体[23],烧成后的电解质在450℃时质子电导率可达1×10−2S/cm。同时,人们发现通过添加一些过渡金属氧化物,如CuO、ZnO、NiO以及Li的氧化物等,这些氧化物与BaZrO3基钙钛矿形成固溶体,可以提高材料的烧结性能。此外,另有报道表明,BaZr0.7Pr0.1Y0.2O3−δ(BZPY10)与BZY20相比,因为Pr的掺入而具有更好的烧结活性,同时也没有明显降低BZY20本身的电导率。其在1 600℃烧结5 h后可以得到致密度很高的电解质膜,晶粒尺寸大于1 μm,600℃时的质子电导率为1×10-2S/cm[24]。
一些A2(B'B'')O6和A3(B'B'')O9类型的复杂钙钛矿结构氧化物也被发现具有质子传导性[21]。例如BaCa1/3Nb2/3O3(BCN),通常被写作 Ba3CaNb2O9[25]。当增加Ca离子浓度并降低Nb离子浓度的时候,则产生了氧空位,并由此得到了一种经典的高温质子传导材料Ba3Ca1.18Nb1.82O8.73(BCN18),其在700℃时分别具有2×10−3S/cm和1.8×10−4S/cm的晶粒电导和晶界电导。Ba2(Ca0.79Nb0.66Ta0.55)O6−δ在650℃也具备了6.1×10−4S/cm的质子电导率,此外,类似的材料还有Sr2Sc1+xNb1-xO6-x及其类似氧化物。
具有质子传导性质的材料还包括稀土掺杂的正铌酸镧(LaNbO4)和正钽酸镧(LnTaO4,Ln可为La、Nd、Gd)[26],该类材料的质子传导率并不高,比如1 mol%Ca和2 mol%Sr掺杂的LaNbO4(LN)在600℃和湿氢环境下电导率仅为2×10−4S/cm,但是具有很高的化学稳定性。此外,一些A2B2O7[27]烧绿石型结构的材料也被报道具有质子传导率。比较常见的是Y掺杂的La2Zr2O7,它的优点是在CO2和水蒸气环境下有很好的稳定性,不足的是质子电导率太差,600℃时的质子电导率仅为3×10−4S/cm。与Y稳定的La2Zr2O7相对应的是钙稳定的La2Ce2O7,该材料具有更高的电导率,但是由于Ce的存在,其化学稳定性不如Y掺杂的La2Zr2O7基电解质材料。
6 结语
本文简述了目前常用的几种低温SOFC电解质材料:具有钙钛矿结构的LSGM电解质不仅在低温即具备很高的氧离子电导率,而且在很宽的氧分压范围内离子迁移数接近于1,是目前综合性能最好的一种低温电解质材料;掺杂氧化铈在低温下有着和LSGM相当的离子电导率,但是其四价铈离子在还原气氛中容易被还原成三价铈离子,引入了电子电导,降低了燃料能量转换效率,在掺杂氧化铈电解质阳极或者阴极侧添加阻挡层或是通过共掺杂的方式在一定程度上可以抑制电子传导回路;掺杂氧化铋或掺杂钒酸铋是目前被报道的具有最高离子电导率的电解质材料,但是其稳定性欠佳,到目前为止还一直没有得到应用;除了氧离子导体外,质子导体也可以作为SOFC的电解质材料。与氧离子相比,质子具有更低的迁移活化能,更适合作为低温SOFC的电解质材料,目前所要解决的问题主要是在保持其高质子电导率的同时,提高其化学稳定性。
[1]Souza S D,Visco S J,Jonghe L C D.Reduced-temperature solid oxide fuel cell based on YSZ thin-film electrolyte[J].Journal of Electrochemical Society,1997,144:35-37.
[2]Souza R A D,Maier J.A computational study of cation defects in LaGaO3[J].Physical Chemistry Chemical Physics,2003(5):740-748.
[3]Huang K,Goodenough J B.A solid oxide fuel cell based on Srand Mg-doped LaGaO3electrolyte:The role of a rare-earth oxide buffer[J].Journal of Alloys and Compounds,2000,303-304:454-464.
[4]Ishihara T,Akbay T,Furutani H,et al.Improved oxide ion conductivity of Co doped La0.8Sr0.2Ga0.8Mg0.2O3perovskite type oxide[J].Solid State Ionics,1998,113-115:585-591.
[5]Baker R T,Gharbage B,Marques F M B.Ionic and electronic conduction in Fe and Cr doped (La,Sr)GaO3[J].Journal of Electrochemical Society,1997,144:3130-3135.
[6]Yamaji K,Horita T,Ishikawa M,et al.SOFC V[J].Electrochemical Society,1997,97:1041.
[7]Kim J H,Yoo H I.Partial electronic conductivity and electrolytic domain of La0.9Sr0.1Ga0.8Mg0.2O3[J].Solid State Ionics,2001,140:105-113.
[8]Bi Z,Yi B,Wang Z,et al.A high-performance anode-supported SOFC with LDC-LSGM bilayer electrolytes[J].Electrochemical and Solid-State Letters,2004(7):105-107.
[9]Lin Y,Barnett S A.Co-firing of anode-supported SOFCs with thin La0.9Sr0.1Ga0.8Mg0.2O3-δelectrolytes[J].Electrochemical and Solid-State Letters,2006(9):285-288.
[10]GuoW,LiuJ,ZhangY.Electricalandstabilityperformanceofanodesupported solid oxide fuel cells with strontium-and magnesiumdoped lanthanum gallate thin electrolyte [J].Electrochimica Acta,2008,53:4420-4427.
[11]Zhan Z,Han D,Wu T,et al.A solid oxide cell yielding high power density below 600 ℃[J].RSC Advances,2012(2):4075-4078.
[12]Zhan Z,Bierschenk D M,Cronin J S,et al.Areduced temperature solid oxide fuel cell with nanostructured anodes[J].Energy&Environmental Science,2011(4):3951-3954.
[13]Ishihara T,Yan J,Shinagawa M,et al.Ni-Fe bimetallic anode as an active anode for intermediate temperature SOFC using LaGaO3based electrolyte film[J].Electrochimica Acta,2006,52:1645-1650.
[14]Steele B C H.Appraisal of Ce1−yGdyO2−y/2electrolytes for IT-SOFC operation at 500℃ [J].Solid State Ionics,2000,129:95-110.
[15]Shao Z P,Haile S M.A high-performance cathode for the next generation of solid-oxide fuel cells[J].Nature,2004,431:170.
[16]Wang S,Katsuki M,Hashimoto T,et al.Expansion behavior of Ce1−yGdyO2.0−0.5y−δunder various oxygen partial pressures evaluated by HTXRD[J].Journal of Electrochemical Society,2003,150:952-958.
[17]Maricle D L,Swarr T E,Karavolis S.Enhanced ceria—a lowtemperature SOFC electrolyte[J].Solid State Ionics,1992,52:173-182.
[18]Vanier R N,Mairesse G,Abraham F,et al.Double substitutions in Bi4V2O11[J].Solid State Ionics,1994,70/71:248-252.
[19]Iwahara H,Esaka T,Uchida H,et al.Proton conduction in sintered oxides and its application to steam electrolysis for hydrogen production[J].Solid State Ionics,1981(3-4):359-363.
[20]Nowick A S,Du Y.Influence of drying temperature on propertiesof Ni-MgOcatalysts[J].SolidStateIonics,1995,77:137-142.
[21]Nowick A S,Du Y,Liang K C.Some factors that determine proton conductivity in nonstoichiometric complex perovskites[J].Solid State Ionics,1999,125:303-311.
[22]Fabbri E,Bi L,Pergolesi D,et al.Towards the next generation of solid oxide fuel cells operating below 600℃with chemically stable proton-conducting electrolytes[J].Advanced Materials,2012,24:195-208.
[23]Yamazaki Y,Sanchez R H,Haile S M.High total proton conductivity in large-grained yttrium-doped barium zirconate[J].Chemistry of Materials,2009,21:2755-2762.
[24]Fabbri E,Bi L,Tanaka H,et al.Chemically stable Pr and Y Co-doped barium zirconate electrolytes with high proton conductivity for intermediate-temperature solid oxide fuel cells[J].Advanced Functional Materials,2011,21:158-166.
[25]Kreuer K D.Aspects of the formation and mobility of protonic charge carriers and the stability of perovskite-type oxides[J].Solid State Ionics,1999,125:285-302.
[26]Haugsrud R,Norby T.High-temperature proton conductivity in acceptor-substituted rare-earth ortho-tantalates,LnTaO4[J].Journal of the American Ceramic Society,2007,90:1116-1121.
[27]Knee C S,Nyman B J.Protonic defects in pure and doped La2Zr2O7pyrochlore oxide[J].Solid State Ionics,2008,178:1642-1647.
Electrolyte material progress of low-temperature SOFC
Han Da,Wu Tianzhi,Xin Xianshuang,Wang Shaorong,Zhan Zhongliang
(Shanghai Institute of Ceramics,Chinese Academy of Sciences,Shanghai 200050,China)
Reducing the operating temperature is critically important to promote the widespread implementation of the solid oxide fuel cell(SOFC)technology due to the associated advantages including reduced materials and processing cost as well as enhanced long-term stability.The principal approach to achieve reduction in operating temperature is to reduce the electrolyte thickness and adopt alternative electrolyte materials that exhibit much higher ionic conductivities than the state-of-the-art yttria-stabilized zirconia electrolyte at comparable temperatures.Here,electrolyte materials for low-temperature SOFC,including lanthanum gallate-based,ceriabased,and bismuth oxide-based materials,were briefly reviewed.The structure and specific properties such as effects of dopants,conductivity and chemical compatibility were discussed.The merits and drawbacks of these various electrolytes were also compared.
low-temperature SOFC;new electrolyte;ion conductivity
TB333
A
1009-1742(2013)02-0066-06
2012-11-07
国家重点基础研究发展计划“973计划”资助项目(2012CB215401)
占忠亮(1976—),男,安徽桐城市人,研究员,主要研究方向为固体氧化物燃料电池关键材料和发电系统;E-mail:zzhan@mail.sic.ac.cn
