黄酮化合物的合成
——推荐一个大学有机化学实验*
2013-09-23李厚金朱可佳陈六平
李厚金 朱可佳 陈六平
(中山大学化学与化学工程学院 广东广州 510275)
黄酮类化合物是一类重要的天然有机化合物,具有C6-C3-C6基本母体结构,广泛存在于植物根、茎、叶、花、果实中,对植物的生长、发育、开花、结果以及抗菌防病等有重要作用。黄酮类化合物也是许多中草药的有效成分,具有心血管系统活性、抗菌、抗病毒、抗肿瘤、抗氧化、抗炎镇痛、抗疲劳、抗衰老以及保肝活性,此外还有降压、降血脂、提高机体免疫力等药理活性[1-3],是新药研究开发的重要资源。
近年来,有大量文献报道了黄酮类化合物化学合成的新技术、新方法,然而,其经典合成方法仍然是查尔酮路线和β-丙二酮路线。β-丙二酮路线中的Baker-Venkataraman重排法是目前广泛应用的黄酮合成方法。该方法是将2-羟基苯乙酮类化合物与芳甲酰卤在碱作用下形成酯,然后再用碱处理酯,发生分子内Claisen缩合,形成β-丙二酮化合物;β-丙二酮化合物再经酸催化闭环而成黄酮化合物。该方法路线成熟,收率高,产品也较易纯化[4-6]。
本实验让学生学习和运用Baker-Venkataraman重排法合成一个重要的黄酮化合物2-苯基苯并吡喃酮(图1)。

图1 2-苯基苯并吡喃酮的结构式
1 实验目的
(1) 利用Baker-Venkataraman重排法合成黄酮类化合物。
(2) 熟悉水蒸气蒸馏、减压蒸馏、混合溶剂重结晶等实验操作方法。
(3) 熟练运用薄层色谱检测反应产物的纯度。
(4) 熟悉化合物的熔点测定。
(5) 了解并掌握IR和NMR对有机化合物结构解析的方法。
2 实验原理
黄酮类化合物的合成方法较多,本实验选用Baker-Venkataraman重排法。苯酚和乙酸酐在氢氧化钠溶液中反应生成乙酸苯酚酯,乙酸苯酚酯在氯化铝的作用下发生Fries重排生成邻羟基苯乙酮。将邻羟基苯乙酮与苯甲酰氯在吡啶作用下形成苯甲酸邻乙酰基苯酚酯,然后在KOH/吡啶作用下发生分子内Claisen缩合,生成β-丙二酮化合物,再在冰醋酸/浓硫酸介质中闭环合成,即得到目标产物2-苯基苯并吡喃酮(图2)。
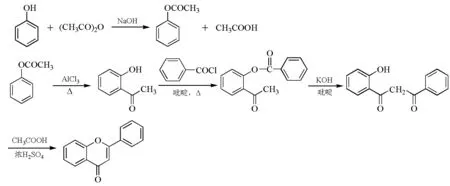
图2 2-苯基苯并吡喃酮的合成路线
乙酸苯酚酯在路易斯酸催化剂(如三氯化铝、三氟化硼、氯化锌、氯化铁、四氯化钛、四氯化锡和三氟甲磺酸盐等)催化下发生Fries重排反应,得到邻位或对位酰基酚。邻、对位产物的比例取决于原料酚酯的结构、反应条件和催化剂的种类等。一般来说,在100℃以下反应温度得到动力学控制的对位产物,在较高反应温度时得到热力学控制的邻位产物。Fries重排的机理至今仍未完全清楚,但目前广为接受的是涉及碳正离子的机理[7]。三氯化铝中的铝原子与酚酯中酚氧进行配位,C—O键断裂,产生酚基铝化物和酰基正离子。酰基正离子可在酚基的邻位或对位发生亲电芳香取代,经水解得到羟基芳酮。邻、对位产物的性质差异较大,一般邻位异构体可以生成分子内氢键,从而随水蒸气蒸出。
苯甲酸邻乙酰基苯酚酯中的甲基在强碱下活泼,可变成碳负离子,进攻分子中的酯羰基,而后发生碳氧键断裂,发生分子内Claisen缩合反应,生成β-丙二酮酯,再在冰醋酸/浓硫酸介质中闭环脱去一分子水,得到2-苯基苯并吡喃酮。
Fries重排反应的可能机理见图3。
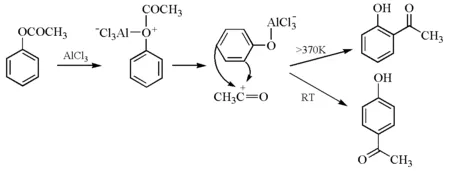
图3 乙酸苯酚酯发生Fries重排反应的可能机理
Claisen缩合反应机理见图4。

图4 苯甲酸邻乙酰基苯酚酯发生Claisen缩合反应机理
3 仪器和试剂
仪器:电磁加热搅拌器,上海申光WRS-1B数字熔点仪,美国 VARIAN公司Mercury-Plus 300核磁共振波谱仪,Nicolet Avatar 330傅立叶变换红外光谱仪。
试剂:苯酚,乙酸酐,邻羟基苯乙酮,苯甲酰氯,吡啶,甲醇,乙醚,1mol/L盐酸,NaOH,KOH,AlCl3,无水Na2SO4,10%乙酸水溶液,冰醋酸,浓硫酸,pH试纸。
4 实验内容4.1 乙酸苯酚酯的制备
将18.8g(0.2mol)苯酚和21.4g(0.21mol)乙酸酐于烧瓶中混合均匀,置于冰水浴中,滴加3滴浓硫酸,振摇,反应立即进行并放出大量的热;分馏出乙酸,再收集194~196℃馏分,得无色透明液体乙酸苯酚酯,收率约90%。
4.2 邻羟基苯乙酮的制备
将12g干燥的氯化钠和28g粉状三氯化铝置于三口瓶中,充分混合均匀,加热至230~250℃,保持1h;于200℃左右在30min内滴加20g(0.148mol)乙酸苯酚酯,滴加完毕后于240~250℃反应10min,冷却后加入60mL 10%盐酸溶液水解;水蒸气蒸馏,馏出物用乙醚萃取,萃取液用无水硫酸钠干燥后回收乙醚;减压蒸馏,收集101~105℃/2000Pa馏分,得淡黄色透明液体邻羟基苯乙酮,收率约40%。
4.3 苯甲酸邻乙酰基苯酚酯
在装有回流冷凝管的50mL圆底瓶中,加入3.4g(0.025mol)邻羟基苯乙酮,4.9g(4mL,0.035mol)苯甲酰氯,5mL干燥并重蒸过的吡啶,约50℃水浴,电磁加热搅拌20min。量取120mL 1mol/L盐酸+50g碎冰,将反应混合液倒入,并不断搅拌;对生成的固体进行抽滤,用5mL冰冷的甲醇洗涤,再用5mL水洗;固体用甲醇-水混合溶剂重结晶(可取10mL甲醇,加热溶解样品,然后补加适量水至饱和溶液),冰浴静置冷却;抽滤后干燥并称重,得苯甲酸邻乙酰基苯酚酯(熔点:87~88℃)。收率可达90%。
4.4 1-邻羟基苯基-3-苯基-1,3-丙二酮
在装有回流冷凝管的100mL圆底瓶中,加入4.8g(0.02mol)苯甲酸邻乙酰基苯酚酯,18mL干燥并重蒸过的吡啶。称取1.7g(0.03mol)KOH粉末,迅速加入反应瓶中;50℃水浴,电磁加热搅拌15min;将反应液冷至室温,加入25mL 10%乙酸水溶液;沉淀经抽滤、洗涤、干燥,称重,得到纯的1-邻羟基苯基-3-苯基-1,3-丙二酮(熔点:117~120℃)。收率约85%。
4.5 2-苯基苯并吡喃酮
在100mL圆底瓶中加入3.6g(0.015mol)用上述步骤制得的1-邻羟基苯基-3-苯基-1,3-丙二酮和20mL冰醋酸,摇匀后加入0.8mL浓硫酸,装上回流冷凝管,沸水浴加热1h;用烧杯称取100g碎冰,将反应混合液倒入烧杯,不断搅拌,至冰全部融解;对固体进行抽滤,用水洗涤至滤液不再呈酸性;干燥,称重,粗品收率可达95%。粗品略带浅黄色,可用石油醚(沸点:60~90℃)-乙酸乙酯重结晶,得到白色针状结晶。

5 讨论
(1) 本实验合成的是天然产物黄酮的母核结构,在进行实验前,可适当安排学生查阅一些文献资料,了解黄酮类化合物的结构、来源、药用、合成等情况,这样既能拓展相关的背景知识,也有助于激发学生的实验兴趣。
(2) 本实验内容包括成酯反应、Fries重排、Claisen缩合等,对学生学习的基础有机化学反应知识可起到很好的巩固作用。实验内容丰富,包括水蒸气蒸馏、减压蒸馏、重结晶、熔点测定、薄层色谱、红外光谱和核磁共振图谱的解析等。
(3) 本实验提供的是黄酮类化合物合成的通用方法,若原料选用取代苯酚和取代的苯甲酰氯,将能得到在苯环上有取代基的黄酮衍生物。取代基可以是OH、CH3、OCH3、Cl、Br等,取代基的数量可以是一个或多个。
(4) 本实验各步骤的收率都较高。反应的实验仪器和试剂要干燥,试剂用量要合适,以甲醇-水、石油醚-乙酸乙酯为混合溶剂进行重结晶时要调至饱和溶液,抽滤时尽量把固体收集齐,减少残留。
(5) 本实验选用结构最简单的苯酚为起始原料,完成本实验全部内容大致需要10h。考虑到邻羟基苯乙酮价格较便宜,如果以邻羟基苯乙酮为起始原料,即直接从实验内容3开始实验,则只需约5h。化合物检测内容(包括薄层色谱、熔点测定、红外光谱、核磁共振谱的测试与解析)可根据具体的实验教学条件和实验学时情况进行合理调整。
参 考 文 献
[1] Alok K V,Ram P.NatProdRep,2010,27:1571
[2] Nigel C V,Renée J G.NatProdRep,2011,28:1626
[3] 延玺,刘会青,邹永青,等.有机化学,2008,28(9):1534
[4] 梁大伟,江银枝.化学研究,2008,19(4):102
[5] 汤立军,张淑芬,杨锦宗,等.有机化学,2004,24(8):882
[6] 杨博,吴茜,李志裕,等.化学通报,2009,72(1):20
[7] Schmid H,Banholzer K.HelvChimActa,1954,37(7):1706
