Kayadiol对子宫内膜癌细胞株HEC-1的影响
2013-09-21李学慧代丽丽张红真
李学慧,代丽丽,董 玫,张 霞,谢 磊,张红真△
(河北医科大学:1.第一医院妇产科;2.基础医学院,河北石家庄050011)
目前化疗已成为治疗中、晚期恶性肿瘤的重要方法,但是现有的绝大多数化疗药物细胞毒作用大、组织特异性差,易产生耐药性等问题一直困扰着临床医生。因此,寻找毒副作用低,抗耐药性强,组织特异性强的化疗药物已成为国内、外研究的热点之一。自天然产物紫杉醇作为抗癌药物应用到临床以来,与其结构相似药物的开发已愈来愈受到重视。有研究报道,日本粗榧果实中分离出的二萜类化合物kayadiol对人白血病细胞K562细胞增殖有抑制作用[1-2]。目前对二萜类化合物的抑瘤活性的研究比较少见,关于kayadiol抑制细胞增殖作用机制的研究更少见报道。本研究将二萜类化合物kayadiol作用于人子宫内膜癌HEC-1细胞株,观测其对子宫内膜癌细胞的生物学影响,并探讨其内在机制。
1 材料与方法
1.1 材料 人子宫内膜癌细胞株HEC-1由日本千叶大学医学部第二生物化学教室提供。实验用化合物kayadiol由河北医科大学药学院天然药物化学教研室提供。四甲基偶氮唑盐(MTT)和顺铂(cisplatin)购自美国Sigma公司;胎牛血清、RPMI1640、胰蛋白酶购自GIBCO公司;TUNEL细胞凋亡原位检测试剂盒(11684795910)购自德国Roche公司;十二烷基硫酸钠(SDS)购自美国Biotec公司;鼠抗人半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)多克隆抗体、鼠抗人 Bax多克隆抗 体 (sc-7480)、羊抗鼠IgG红外荧光二抗及β-actin购自美国Santa Cruz公司;溴化乙锭购自美国Sigma公司。
1.2 方法
1.2.1 体外抑瘤实验 取对数生长期HEC-1细胞,调整细胞浓度为1×105/mL,接种于96孔板,每孔100mL,培养箱中培养24h后,吸出各孔内培养基,加入含有不同浓度kayadiol(1、10、100、μmol/L)的培养基,并设二甲基亚砜(DMSO)溶剂对照组(1、10、100μmol/L的 DMSO)、顺铂对照组(分别为1、10、100μmol/L的顺铂),每孔100μL,每组设3个复孔,继续在培养箱中培养44h后,向各培养孔中加入10mL MTT(5mg/mL),继续培养4h,弃上清液,每孔加入DMSO 150μL,震荡10min,充分溶解蓝紫色结晶。采用酶联免疫吸附测定(ELISA)于492nm波长下测定各孔OD值,计算药物对细胞的抑制率。生存率(%)=(实验组OD值/对照组OD值)×100%。
1.2.2 凋亡细胞原位标记与半定量分析 取对数生长期的HEC-1细胞,接种于8孔培养板,每孔100μL(含1×104个细胞),分别加入终浓度0.1%DMSO和终浓度为10μmol/L的kayadiol 100μL,于培养箱中分别培养12、24h;弃培养液,加入4%多聚甲醛,每孔100μL,于室温培养1h;弃液体,加入通透液每孔100μL,冰浴2min;弃液体,溶剂对照组与kayadiol组加入TUNEL溶液,每孔80μL。溶剂对照组,加入荧光标记的三磷酸脱氧尿苷(dUTP)液,每孔80μL,加盖玻片在暗湿盒中反应1h。弃液体,荧光显微镜下观察,可以使用的激发波长范围为450~500nm,发射波长范围为515~565nm(绿色荧光)。结果根据凋亡阳性细胞分布情况。每张切片拍摄5个阳性视野,每视野计数正常细胞数和带荧光的凋亡细胞数,以阳性细胞所占正常细胞的百分比作为细胞凋亡率(AR)。
1.2.3 Western blot法检测 收集溶剂对照组、顺铂对照组(终浓度为10μmol/L的顺铂作用48h)和kayadiol组(终浓度为10μmol/L kayadiol作用48h)HEC-1细胞,按蛋白提取操作步骤提取细胞总蛋白,BCA法蛋白定量,12%SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)2h,然后将蛋白转移至聚偏氟乙烯膜,用含脱脂奶粉的无蛋白(TBS)封闭缓冲液封闭1h后,分别加入一抗Bax抗体(1∶500)和Caspase-3抗体(1∶700),4℃过夜,加入二抗(1∶5 000),室温孵育1h,双色红外激光成像系统扫描显像,设β-Actin为内参。
1.3 统计学处理 应用SPSS13.0统计软件分析。实验结果以±s表示,两个独立样本组间均数比较用t检验。多组间比较用方差分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 Kayadiol、顺铂对HEC-1细胞增殖的影响 Kayadiol和顺铂对 HEC-1细胞的增殖显示强的抑制活性。1、10、100 μmol/L的顺铂处理HEC-1细胞后,其生存率分别为86.04%、66.33%、37.04%,并呈现较好的剂量依赖关系,与溶剂对照组比较均差异有统计学意义(P<0.05);kayadiol组1、10、100 μmol/L kayadiol处 理 HEC-1 细 胞 后,其 生 存 率 分 别 为69.87%、39.31%、2.76%,并呈现较好的剂量依赖关系,与溶剂对照组比较差异有统计学意义(P<0.01)。顺铂和kayadiol作用后HEC-1细胞生存率比较,见表1。
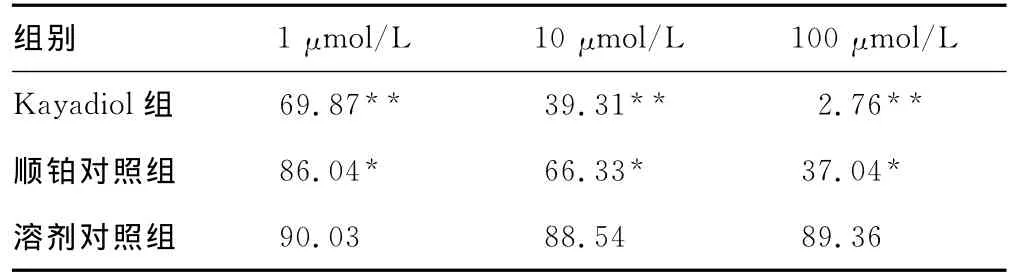
表1 顺铂和kayadiol作用后HEC-1细胞生存率比较(%)

图1 各组HEC-1细胞凋亡情况
2.2 Kayadiol对 HEC-1细胞凋亡的影响 10μmol/L的kayadiol处理HEC-1细胞24h后,TUNEL法检测结果显示,Kayadiol可明显诱导HEC-1细胞的凋亡,具有时间依赖关系,溶剂对照组和Kayadiol组12、24h的 HEC-1细胞凋亡率比较,差异有统计学意义(P<0.01),见表2。荧光显微镜下观察各组HEC-1细胞凋亡情况,见图1。
2.3 Kayadiol对HEC-1细胞中Bax和Caspase-3蛋白表达的影响 Western blot结果提示,经kayadiol处理48h后的HEC-1细胞内的Bax、caspase-3蛋白表达水平显著上调,与顺铂对照组接近,见图2。
表2 溶剂对照组和Kayadiol组12、24h的HEC-1细胞凋亡率比较(±s)
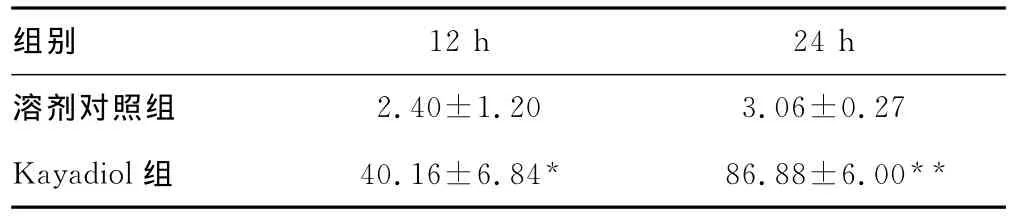
表2 溶剂对照组和Kayadiol组12、24h的HEC-1细胞凋亡率比较(±s)
*:P<0.05,**:P<0.01,与溶剂对照组比较。
组别2.40±1.20 3.06±0.27 Kayadiol组 40.16±6.84* 86.88±6.00 12h 24h溶剂对照组**
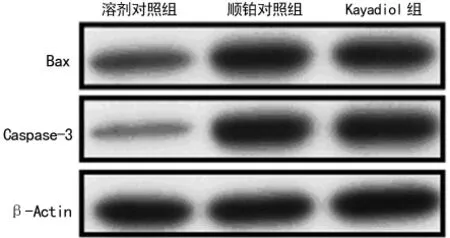
图2 各组HEC-1细胞48h后Bax、Caspase-3蛋白表达
3 讨 论
子宫内膜癌是女性最常见的恶性肿瘤之一,占女性生殖道恶性肿瘤的20%~30%。子宫内膜癌的治疗以手术为主,放疗为辅,化疗主要用于特殊病理类型、细胞分化差或晚期的和复发的子宫内膜癌,旨在降低内膜癌的复发风险[3-4],提高总体生存率。近年来,具有高危因素的子宫内膜癌术后同步放、化疗也开始应用[5-7],同时,国外开展了多项针对早期高危子宫内膜癌术后辅助化疗预防复发的随机对照研究,使早期子宫内膜癌化疗成为目前研究的热点之一。
二萜类化合物中紫杉醇、雷公藤内酯醇等对多种肿瘤细胞的增殖都有抑制作用[8-11]。kayadiol是从日本榧树中分离出的二萜类化合物,潘永梅等[1]报道kayadiol对人白血病细胞K562细胞增殖也有抑制活性。顺铂是广谱抗癌药,为铂的金属络合物,作用似烷化剂,主要作用靶点为DNA,是被证明在铂类药物中最有效的药物。本实验以kayadiol为研究对象,以顺铂为阳性对照,用MTT比色法检测其对人子宫内膜癌HEC-1细胞株体外生长的抑制作用,结果显示经1、10、100 μmol/L 3种不同浓度的kayadiol作用 HEC-1细胞后,HEC-1细胞株生存率与溶剂对照组比较均差异有统计学意义,且呈现剂量依赖关系,以浓度100μmol/L显著(P<0.01),强于顺铂抑瘤效果。
细胞增殖与凋亡平衡的失调和多种癌症的发生、发展有着密切联系[12-14]。凋亡抑制基因过高表达、促凋亡基因突变或缺失,都可使肿瘤发生率增加[15]。本实验用TUNEL法检测了kayadiol处理12、24h后HEC-1细胞的细胞凋亡率,结果显示差异有统计学意义,且具有时间依赖关系,提示kayadiol具有明显诱导HEC-1细胞发生凋亡的活性。Bax蛋白是Bcl-2家族的一种前凋亡蛋白,主要定位于细胞质,一旦受到凋亡因子的诱导,可以向线粒体转位,通过寡聚化在线粒体外膜形成跨膜通道,或者开启线粒体的通透性转换孔,导致线粒体中的凋亡因子释放,从而激活Caspase蛋白导致细胞凋亡。Caspase家族属于半胱氨酸蛋白酶,是细胞凋亡中的关键蛋白酶[16],其中Caspase-3可直接降解胞内的结构蛋白和功能蛋白而引起细胞凋亡。本实验用Western blot法检测kayadiol处理48h后的HEC-1细胞中的Caspase-3和Bax蛋白水平,结果显示:经kayadiol处理后,HEC-1细胞内的Caspase-3和Bax蛋白表达明显上调,提示kayadiol对人子宫内膜癌细胞增殖的抑制作用有可能是通过诱导肿瘤细胞凋亡来实现的。
综上所述,本实验证实kayadiol对HEC-1细胞的增殖具有强的抑制作用,呈时效和量效关系,其抑制HEC-1细胞增殖是通过上调Bax蛋白的表达和激活Caspase-3而引起肿瘤细胞凋亡而实现的。诱导细胞凋亡是一个由多信号诱导、多基因调控和多因子参与的过程,本实验验证的仅仅是诱导凋亡的通路之一,kayadiol是否还通过其他途径诱导凋亡需要进一步研究。
[1] 潘永梅,王建华,曹聪梅,等.日本粗榧果肉中三种二萜类化合物体外抗癌活性研究[J].中药药理与临床,2009,25(2):70-73.
[2] 曹聪梅,董玫,张喜萍,等.日本榧树果实的化学成分研究[J].天然产物研究与开发,2009,21(5):737-739.
[3] Obel JC,Fleming GF.Chemotherapy in endometrial cancer[J].Chin Adv Hematol Oncol,2006,4(4):459-468.
[4] 李静,孔为民.子宫内膜癌化疗进展[J].中华妇产科杂志,2010,45(8):632-636.
[5] 孔为民,李静,李丽英,等.顺铂同步放化疗对子宫内膜癌HEC-1A细胞的抑制作用及其机制的初步研究[J].中华妇产科杂志,2010,45(11):874-877.
[6] 李静,孔为民,李丽英,等.紫杉醇同步放化疗对子宫内膜癌HEC-1A细胞系的抑制作用及其机理的初步研究[J].实用癌症杂志,2010,25(2):114-119.
[7] 于海林,鹿欣.铂类抗癌药物在妇科肿瘤治疗中的应用[J].世界临床药物,2008,29(7):399-405.
[8] 李长华,彭星.紫杉醇与顺铂联合化疗对宫颈鳞癌细胞株HCE1作用的实验研究[J].中华临床医师杂志:电子版,2012,6(8):2037-2042.
[9] 曹飞鳞,郑瑞,周申康,等.低浓度紫杉醇对NK-92MI细胞增殖及细胞毒效应的影响[J].浙江医学,2012,34(6):431-437.
[10]吴妙芳,李晶,谢玲玲,等.紫杉醇在常见妇科恶性肿瘤中的应用[J].临床药物治疗杂志,2012,10(3):27-31.
[11]李鹏,孔北华,刘秋燕,等.雷公藤内酯醇诱导上皮性卵巢癌Caov-3凋亡的实验研究[J].实用妇产科杂志,2005,21(1):24-27.
[12]杨全会,许荣焜.细胞凋亡与肿瘤[J].生理科学进展,2006,37(4):373-378.
[13]欧阳高亮,李祺福.细胞凋亡与肿瘤的发生发展和治疗[J].国外医学:肿瘤学分册,2000,27(5):266-269.
[14]周彩虹,黄启福.凋亡与肿瘤及其治疗进展[J].中国病理生理杂志,2004,20(11):2124-2133.
[15]Steller H.Mechanisms and genes of cellular suicide[J].Science,1995,267(5203):1445-1449.
[16]刘丽君,赵思顺,代秀云,等.Caspase-3在妇科恶性肿瘤中的研究进展[J].中国现代药物应用,2011,5(3):227-228.
