六味地黄汤通过缺氧诱导因子1α途径对5/6肾切除大鼠肾间质纤维化的抑制作用*
2013-09-21何泽云徐文峰曾海飞
唐 群,何泽云,陈 丽,徐文峰,曾海飞
(1.湖南中医药大学,长沙410208;2.湖南中医药大学第一附属医院,长沙410007)
研究指出,肾小管间质部分的慢性氧缺失是促进肾脏疾病进展和纤维化的重要原因[1]。体外实验证明,缺氧可刺激肾小管上皮细胞和间质成纤维细胞向肌成纤维细胞表型转分化,参与肾间质纤维化的发生、发展[2],缺氧主要通过缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)发挥作用[3],后者可调控结缔组织生长因子(connective tissue growth factor,CTGF)表达。现将本研究探讨HIF-1α在慢性肾间质纤维化中的作用以及六味地黄汤对其表达的影响报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级雄性SD大鼠30只,体质量(200±10)g,由湖南中医药大学实验动物中心提供并饲养于湖南中医药大学SPF级动物房。
1.1.2 药物 六味地黄汤(熟地黄24g,山药12g,山茱萸12 g,泽泻9g,茯苓9g,牡丹皮9g)购自湖南中医药大学第一附属医院药剂科。先将药材用相当于药材5倍的自来水浸泡2 h,煮沸后再微火煎熬30min,过滤后收集煎液,原药渣加少量水煎煮,取二煎液。将两煎液混合,于水浴恒温器上浓缩药液至含生药1g/mL。
1.1.3 主要试剂 一抗为兔抗大鼠HIF-1α、CTGF多克隆抗体(美国Santa Cruz),兔二步法检测试剂盒(PV-6001)、二抗为非生物素标记山羊抗兔IgG抗体(北京中杉金桥公司),DAB显色试剂盒(武汉博士德公司),ECL化学发光试剂(美国Pierce公司)。
1.2 方法
1.2.1 造模 SD雄性大鼠适应性喂养1周后随机分为假手术组(10只)、模型组(10只)和六味地黄汤组(10只)。假手术组打开腹腔暴露肾脏后避免牵拉肾脏,不切除肾脏。模型组、六味地黄汤组大鼠均在无菌条件下进行5/6肾切除术,以10%水合氯醛0.30mL/100g腹腔注射麻醉大鼠,常规消毒铺巾,从左腹部切口,打开腹腔,静脉夹夹住肾蒂后迅速切除左肾上下极(切除2/3),以吸收性明胶海绵压迫止血,复位肾脏。1周后进行第2次手术,切除右侧肾脏。右肾摘除术后第2天,六味地黄汤组予以六味地黄汤灌胃(生药含量按公式:人的剂量×0.018×5/kg体质量计算),每天1次,至处死为止;模型组、假手术组以等容积蒸馏水灌胃,给药8周后全部处死,中途死亡的大鼠直接剔除。
1.2.2 标本收集 各组大鼠分别于灌胃第8周后处死,处死前收集24h尿量,酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测24h尿清蛋白(24urinary albumin,24hUAlb)。腹主动脉采血分离血清,酶法测定血肌酐(serum creatinine,Scr)浓度,尿素酶-GLDH 法测定血尿素氮(blood urea nitrogen,BUN)浓度。肾组织分为两部分处理:(1)光镜观察。标本用4%多聚甲醛固定,分别行HE染色、Masson染色及免疫组织化学检测。(2)肾组织取出后立即放入液氮罐中,随后转入-80℃冰箱保存待用。
1.2.3 肾脏组织学检查 肾组织经4%多聚甲醛固定,梯度乙醇脱水、二甲苯透明、石蜡包埋、切片(厚度为3~4μm)后,分别进行HE染色及Masson染色,Olympus显微镜观察并拍照。
1.2.4 免疫组织化学染色 免疫组织化学采用兔二步法检测试剂盒(PV-6001),一抗用兔抗大鼠抗体,一抗及工作浓度:HIF-1α(1∶100)、CTGF(1∶200),二抗用相应羊抗兔抗体,染色呈棕褐色者为阳性染色。
1.2.5 图像分析 Olympus显微镜观察肾组织病理变化并拍照,每张切片随机选取5个视野,用麦克奥迪数码医学分析系统(Motic Med 6.0)进行图像分析。测定视野内免疫阳性细胞的平均灰度值,以灰度值进行定量分析,测得组织细胞平均灰度值愈小,其蛋白水平愈高。
1.2.6 Western blot检测 常规提取蛋白质样品,BCA法进行蛋白质定量。每泳道50μg蛋白,10%十二烷基磺酸钠-聚丙烯酰胺(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳分离后湿转至PVDF膜,封闭,加一抗,一抗及工作浓度:HIF-1α(1∶200)、CTGF(1∶300),4℃孵育过夜。洗膜,加相应二抗(1∶2 000)室温孵育1h,ECL试剂在暗室中发光,X线胶片曝光、显影、定影。扫描测定条带密度值,以与β-actin的比值作为表达强度。
1.3 统计学处理 应用SPSS18.0统计软件进行数据处理,计量资料以±s表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 六味地黄汤对5/6肾切除大鼠肾脏功能的影响 见表1。
2.2 六味地黄汤对5/6肾切除大鼠肾组织形态学的影响HE染色下,假手术组肾小球和肾小管结构清晰,未见明显异常;模型组肾小球系膜细胞明显增生,硬化增多,肾小管明显萎缩、消失,部分肾小管发生代偿性扩张,可见蛋白管型,肾间质纤维化明显,大量淋巴细胞浸润。六味地黄汤组病变程度较模型组明显减轻(图1)。Masson染色下,假手术组肾小球和肾小管仅基底膜染成蓝色,肾间质无明显胶原纤维;模型组肾间质见大量染成蓝色的胶原纤维;六味地黄汤组肾间质可见少量胶原纤维,胶原沉积较模型组明显减轻(图2)。
2.3 六味地黄汤对5/6肾切除大鼠肾组织 HIF-1α、CTGF表达的影响
2.3.1 HIF-1α的表达 假手术组 HIF-1α微量表达,主要在肾皮髓质交界处,模型组和六味地黄汤组肾小管上皮细胞、间质细胞胞质和胞核中均表达增加,肾小球表达不明显(图3)。
表1 3组大鼠肾脏功能检测结果(±s)

表1 3组大鼠肾脏功能检测结果(±s)
*:P<0.05,与六味地黄汤组比较。
组别 n 24hUAlb(mg)BUN(mmol/L) Scr(μmol/L)假手术组 10 3.60±1.40* 6.49±0.98* 59.60±5.82*模型组 7 22.12±1.05* 13.54±1.33* 87.42±6.92*六味地黄汤组9 19.08±2.02 11.66±1.20 77.44±5.68
2.3.2 CTGF的表达 假手术组CTGF表达不明显,模型组和六味地黄汤组肾小管上皮细胞、间质细胞胞质和胞核中CTGF均表达明显增加,肾小球表达不明显(图4)。
2.3.3 肾组织HIF-1α、CTGF表达半定量分析 3组肾组织HIF-1α、CTGF表达在模型组最强,六味地黄汤组次之,假手术组最弱。与六味地黄汤组比较,模型组HIF-1α、CTGF的表达明显升高(P<0.05),见表2。
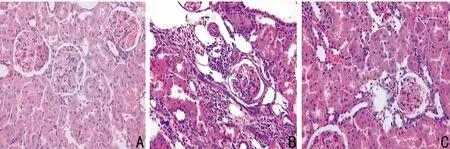
图1 3组大鼠肾脏的病理改变(HE染色,×250)
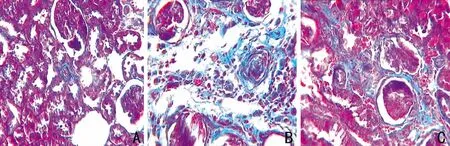
图2 3组大鼠肾脏的病理改变(Masson染色,×250)
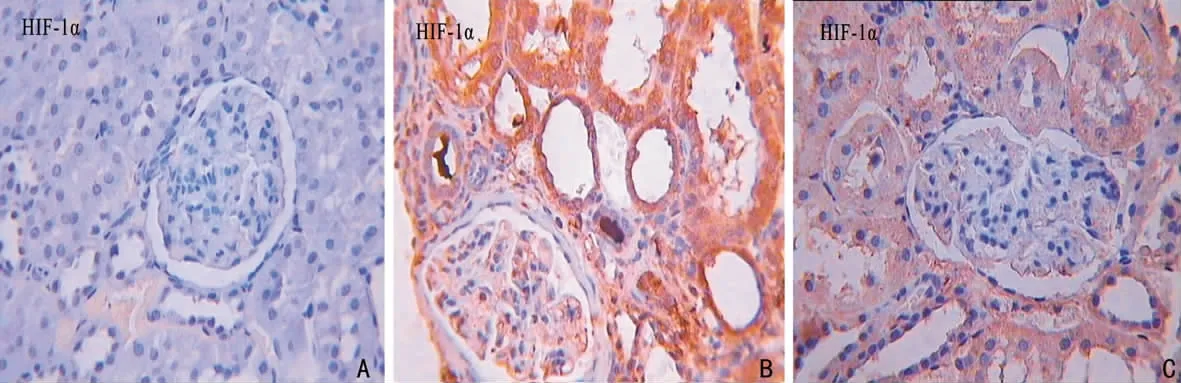
图3 3组大鼠肾组织HIF-1α的蛋白表达水平(IHC,×400)

图4 3组大鼠肾组织CTGF的蛋白表达水平(IHC,×400)
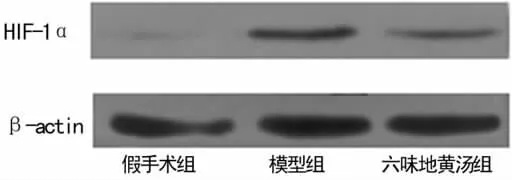
图5 3组大鼠肾组织HIF-1α蛋白表达电泳图
表2 3组大鼠肾组织HIF-1α、CTGF表达的平均灰度值(±s)

表2 3组大鼠肾组织HIF-1α、CTGF表达的平均灰度值(±s)
*:P<0.05,与六味地黄汤组比较。
组别 n HIF-1αCTGF假手术组 10 215.30±24.60* 223.00±21.50*模型组 7 141.00±12.20* 137.60±14.10*六味地黄汤组9 170.70±10.90 184.20±11.40
2.4 六味地黄汤对5/6肾切除大鼠肾组织 HIF-1α、CTGF蛋白水平的影响 与六味地黄汤组比较,模型组HIF-1α、CTGF蛋白表达水平均明显升高(P<0.05)。见图5~8。
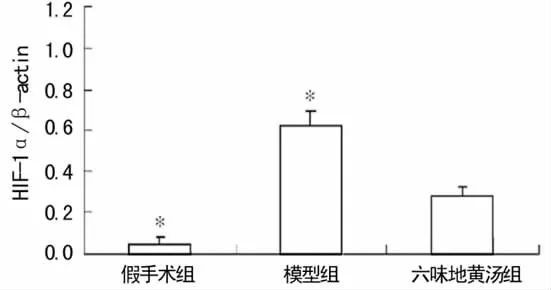
图6 Western blot检测3组HIF-1α的表达
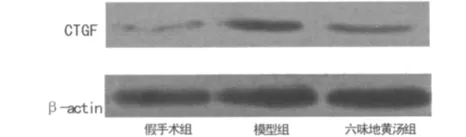
图7 3组大鼠肾组织CTGF蛋白表达电泳图
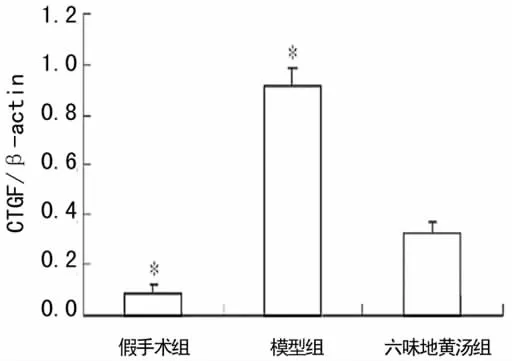
图8 Western blot检测3组CTGF的表达
3 讨 论
HIF-1是1992年Semenza等在低氧诱导的肝细胞癌细胞株Hep3B细胞核提取物中发现的一种蛋白质,是迄今为止发现的惟一能在缺氧状态下发挥活性的特异性转录因子。已有研究表明,缺氧激活的转录因子HIF-1α在纤维化发展中起至关重要的作用[4]。慢性肾衰竭(chronic renal failure,CRF)是各种肾脏疾病持续进展的最终结局,其主要病理学特征为肾小球硬化和肾间质纤维化。慢性缺氧可诱发HIF-1α持续表达,后者上调一系列促纤维化靶基因导致肾间质纤维化。因此,慢性缺氧是引起肾间质纤维化的一个关键因素[5],而 HIF-1α是导致肾间质纤维化的关键因子[6-7]。
5/6肾切除大鼠是目前研究慢性肾脏病进展的理想动物模型。已有研究表明,5/6肾切除的大鼠肾脏组织中存在小动脉病变,这种小动脉病变可导致肾小球后毛细血管血流减少和肾小管间质缺血,而缺血就意味着低氧。Manotham等[8]研究证实,在5/6肾切除大鼠模型中,在发生肾小管纤维化前,肾小管已存在明显的缺氧。Zhang等[9]研究证实,管周毛细血管丢失和肾小管间质缺氧在肾间质纤维化不明显之前的早期阶段(术后第3周)已经很严重,并且持续存在于肾间质纤维化的发展过程中。Zeng等[10]研究发现,HIF-1α在5/6肾切除大鼠肾组织中显著升高,这一结果证实慢性缺氧存在于5/6肾切除模型。俞小芳等[11]研究5/6肾切除大鼠亦发现在早期阶段(术后第1周末),HIF-1α在肾内表达即开始增加,在术后12周仍有持续表达。Kimura等[6]通过应用5/6肾切除的基因敲除小鼠模型证实了HIF-1α具有促进肾纤维化的作用,认为抑制HIF-1α的表达是治疗肾脏纤维化的靶点。此外,CTGF是目前公认的较强的促纤维化生长因子,其表达受 HIF-1α调控[12]。本研究显示模型组存在明显的纤维化,且与假手术组比较,模型组肾组织中HIF-1α、CTGF蛋白表达水平均明显升高,说明HIF-1α可能通过调节CTGF的表达,促进肾间质纤维化。
六味地黄丸是临床上治疗肾阴虚证型慢性肾小球肾炎的有效方剂[13]。其临床疗效肯定,但其作用机制缺乏深入研究。何泽云等[14]研究发现5/6肾切除大鼠在术后8周,留存肾不可避免地发生了间质纤维化。给5/6肾切除大鼠灌胃六味地黄汤8周后,其BUN、Scr的水平明显低于模型组,并能减少留存肾系膜细胞的增生及间质纤维化,使肾切除大鼠生存期延长[15]。蔡惠芳等[16]研究发现,六味地黄丸具有改善5/6肾切除大鼠残肾肾功能的作用,其改善残肾肾功能的作用与六味地黄丸提高肾小球的体积密切相关。李万斌等[17]研究认为,六味地黄丸可能通过促进MMP-2的表达,对抗Ⅳ胶原的过度沉积,减轻硬化程度,达到保护肾脏、延缓肾衰竭进程的积极作用。目前,从缺氧的角度探讨六味地黄汤延缓肾间质纤维化的机制研究尚未见报道,缺氧是导致肾间质纤维化的重要原因,而六味地黄汤具有耐缺氧、抗氧化的作用,为本研究提供了坚实的理论依据。本研究结果显示,与模型组比较,六味地黄汤组HIF-1α、CTGF蛋白表达水平均明显降低,提示六味地黄汤延缓肾间质纤维化的作用机制可能是通过改善缺氧从而抑制HIF-1α的表达,进而下调CTGF的蛋白水平,从而减轻肾间质纤维化。
[1] Fine LG,Norman JT.Chronic hypoxia as a mechanism of progression of chronic kidney diseases:from hypothesis to novel therapeutics[J].Kidney Int,2008,74(7):867-872.
[2] Manotham K,Tanaka T,Matsumoto M,et al.Transdifferentiation of cultured tubular cells induced by hypoxia[J].Kidney Int,2004,65(3):871-880.
[3] Higgins DF,Kimura K,Iwano M,et al.Hypoxia-inducible factor signaling in the development of tissue fibrosis[J].Cell Cycle,2008,7(9):1128-1132.
[4] Copple BL,Bai S,Burgoon LD,et al.Hypoxia-inducible factor-1αregulates the expression of genes in hypoxic hepatic stellate cells important for collagen deposition and angiogenesis[J].Liver Int,2011,31(2):230-244.
[5] Takiyama Y,Harumi T,Watanabe J,et al.Tubular injury in a rat model of type 2diabetes is prevented by metformin:apossible role of HIF-1αexpression and oxygen metabolism[J].Diabetes,2011,60(3):981-992.
[6] Kimura K,Iwano M,Higgins DF,et al.Stable expression of HIF-1alpha in tubular epithelial cells promotes interstitial fibrosis[J].Am J Physiol Renal Physiol,2008,295(4):F1023-1029.
[7] Haase VH.Pathophysiological consequences of HIF activation:HIF as a modulator of fibrosis[J].Ann N Y Acad Sci,2009,1177:57-65.
[8] Manotham K,Tanaka T,Matsumoto M,et al.Evidence of tubular hypoxia in the early phase in the remnant kidney model[J].J Am Soc Nephrol,2004,15(5):1277-1288.
[9] Zhang B,Liang X,Shi W,et al.Role of impaired peritubular capillary and hypoxia in progressive interstitial fibrosis after 56subtotal nephrectomy of rats[J].Nephrology(Carlton),2005,10(4):351-357.
[10]Zeng R,Yao Y,Han M,et al.Biliverdin reductase mediates hypoxia-induced EMT via PI3-kinase and Akt[J].J Am Soc Nephrol,2008,19(2):380-387.
[11]俞小芳,丁小强,朱加明,等.5/6肾切除大鼠低氧诱导因子1α和2α在肾内的表达和定位[J].中华肾脏病杂志,2010,26(9):689-695.
[12]Xu H,Liu X,Ning W,et al.Expression of HIF-1alpha in 5/6-nephrectomized rat models of chronic kidney fibrosis[J].ZhongNan DaXue XuBao,2009,3(4):308-312.
[13]何泽云,徐元美.六味地黄丸治疗肾阴虚型慢性肾小球肾炎的临床研究[J].湖南中医学院学报,2004,24(1):35-37.
[14]何泽云,阳晓.参麦注射液对5/6肾切除大鼠肾脏及腹膜形态结构的影响[J].中国中西医结合杂志,1998,18(9):553-555.
[15]何泽云,陈江华,李晓峰.六味地黄丸对肾切除大鼠肾小球化生的影响[J].湖南中医学院学报,2004,24(2):1-3.
[16]蔡惠芳,谭元生,何泽云,等.六味地黄丸对大鼠5/6肾切除肾功能的影响[J].湖南中医药大学学报,2007,27(2):17-19.
[17]李万斌,何泽云.六味地黄丸延缓5/6肾切除大鼠肾组织纤维化研究[J].中国药师,2009,12(4):411-413.
