一株耐万古霉素粪肠球菌的分离鉴定
2013-09-21黄平容田世成苏建明
黄平容,田世成,苏建明
(湖南农业大学动物医学院,湖南长沙410128)
粪肠球菌属于过氧化氢酶阴性、无芽胞、兼性厌氧的革兰阳性的单个或成链的球菌,也属于能产生细菌素的乳酸菌[1]粪肠球菌。同时也是动物肠道正常菌群之一,常定居于动物肠道、口腔、生殖道,且广泛分布于自然界中,通常不引起感染。自从20世纪80年代,第一株耐万苦霉素粪肠球菌(vancoycin-resistant E.faecalis)被分离鉴定以来,粪肠球菌感染已居院内感染第2位[2]。在欧洲、美国等国家严重威胁着人类公共健康以及养殖业的发展。在中国也已在羊、猪等动物体内分离到致病性粪肠球菌[3-4]。粪肠球菌对许多临床常用抗生素具有固有耐药性,并且能通过基因突变或者从供体菌中通过质粒、转座子、基因盒-整合子系统等获得外源遗传物质,从而产生新的耐药性,给临床治疗带来极大的挑战[5-6]。粪肠球菌通常引起伤口感染、尿道感染、腹腔感染、血流感染等,尤其见于免疫力低下或患有危重基础疾病患者[7-8]。也可导致败血症、心内膜炎等症,病死率达21.0%~27.5%[9]。在兽医临床中,肠球菌引起的畜禽感染也日趋增多[10-12]。
本试验从某猪场送检发病猪脏器中分离出了一株耐万古霉素粪肠球菌。在万古霉素尚未投入使用的养殖业领域,这一结果呼吁急切规范中国兽药使用。
1 材料与方法
1.1 材料
1.1.1 病料 湖南某猪场送至湖南农业大学动物医学院传染病实验室检测的发病商品猪采取的病料。
1.1.2 主要试剂 TSB胰蛋白胨大豆肉汤为Sigma公司产品;药敏纸片及标准菌株ATCC 29212为杭州天和微生物试剂有限公司产品;dNTP、TaqDNA聚合酶、DNA Marker DL 5 000等为宝生物工程(大连)有限公司产品。兔鲜血培养基及其他常规试剂均为分析纯。
1.2 方法
1.2.1 病原分离鉴定 从送检病猪体内取出心、肝、脾、肺、肾、脑等内脏器官及关节液无菌划线接种于兔鲜血培养基上,置于37℃培养24h后挑取单个菌落进行革兰染色、镜检。将可疑菌落分别接种于含65g/L的NaCl和pH9.6的TSB液体培养基中于10℃及55℃进行培养,以进行细菌生长耐受性检验。
1.2.2 生化特性鉴定 生化试验参考《常见细菌系统鉴定手册》[13],用分离菌的纯培养物分别接种于葡萄糖、甘露醇、山梨醇、蕈糖、乳糖、蔗糖、水杨素、七叶苷、精氨酸、VP试验、PYR、400mL/L胆汁、马尿酸盐等生化鉴定管中进行生化试验。
1.2.3 PCR 鉴定 参照文献[14]中已公布的16S rRNA保守区域设计的通用引物,上游引物:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物:5′-CGGTTACCTTGTTACGACTT-3′,预期扩增产物长度为1 500bp,引物由宝生物工程(大连)有限公司合成。
1.2.4 DNA提取 采用常规方法提取细菌基因组,主要步骤如下:取液体培养物1mL置于1.5mL离心管中,10 000r/min离心30s,弃去上清,加入30μL灭菌去离子水,混匀,煮沸灭活5min~10 min,10 000r/min离心30s后吸取上清液,置于-70℃保存备用。
1.2.5 PCR扩增 采用16SrRNA通用引物扩增16SrRNA保守区约1 500bp的目的片段。PCR反应 体 系:10×PCR buffer 5μL,dNTP (2.5 mmol/L)2.5 μL,上、下 游 引 物 各 1 μL(20 μmol/L),Taq酶(2.5U/μL)1μL,模板0.5μL,加超纯水至50μL。反应条件为:95℃5min;94℃30s,59 ℃ 30s,72 ℃ 1min ,35个循环;72 ℃ 7 min。同时用蒸馏水取代模板作为阴性对照。取3 μL PCR产物,进行10g/L琼脂糖凝胶电泳,观察、并用凝胶图像系统拍摄,剩余PCR产物送往上海生物工程有限公司纯化、测序。测序结果进行Blast分析。
1.2.6 药敏试验 无菌取纯化培养物涂布于TSB培养基上,待稍干后,将各种抗生素药敏纸片平贴于其表面,放入37℃培养24h后用游标卡尺量取抑菌圈直径,并采用NCCLS(美国临床实验室标准化委员会)2005版标准进行结果判定。
2 结果
2.1 细菌培养结果
取平板培养物进行革兰染色、镜检,为革兰阳性球菌,多成双球状排列,亦有少数为单个存在;在液体培养基中,多以长链状形态存在。在TSB平板上经37℃恒温培养18h~24h后形成直径0.1mm~1.0mm、灰白色、半透明、表面光滑、圆形、边缘整齐的小菌落。在血平板上能形成β溶血环。
2.2 生化试验结果
将分离纯化菌株接种于生化培养基中,37℃恒温培养24h观察结果。其结果符合肠球菌生化特性(表1)。

表1 分离菌生化特性试验结果Table 1 The results of biochemical test
2.3 PCR鉴定结果
16SrRNA通用引物扩增产物经过含有EB的琼脂糖进行鉴定,能得到明显的约1 500bp的条带(图1),与预期目的片段大小一致。扩增产物测序结果导出序列后进行Blast分析,与已鉴定的粪肠球菌同源性为99%,根据菌种基因组保守区间的差异标准,可确定该菌株为粪肠球菌。
2.4 药敏试验
测定了该菌对米诺霉素(30μg/片)、苯唑青霉素、四环素(30μg/片)、环丙沙星(5μg/片)、红霉素(15μg/片)、左氧氯沙星(5μg/片)、青霉素G(10万单位)、万古霉素(30μg/片)、氯霉素(30μg/片)九种抗生素的耐药性(表2),显示该菌株对于所有本试验测定的药物均耐药,表明该菌已产生多重耐药性,尤其对于临床尚未使用的万古霉素亦为耐药。

图1 PCR扩增结果Fig.1 The results of PCR amplification

图2 16SRNA测序结果Fig.2 The results of 16SRNA sequencing
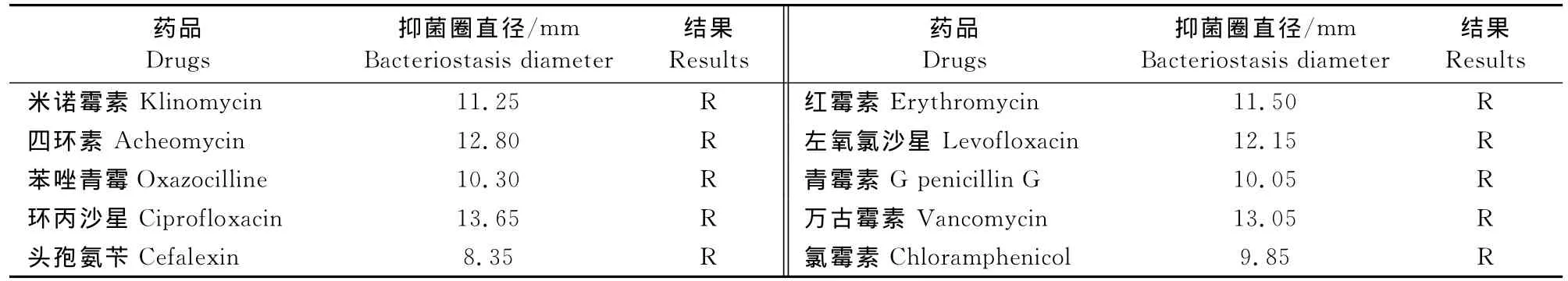
表2 分离株对不同抗菌药的耐药性Table 2 Drug resistance of E.faecalis isolates
3 讨论
粪肠球菌本是温血动物肠道正常菌群,一般情况不会引发疾病[15],所以粪肠球菌感染没有季节性,多是由于宿主免疫力下降,如长途运输、饲料更替、天气变化、断奶、饲养密度过大等因素而导致感染,且多为混合感染[16]。目前,没有任何有效的疫苗或其他预防措施能预防粪肠球菌的感染,这给粪肠球菌病的临床冶疗带来了极大的困难。本试验从临床发病猪肺部分离出粪肠球菌,通过药敏试验测定,该菌株为多重耐药菌株,且对于兽医临床极少使用的万古霉素也表现为耐药。研究表明,粪肠球能从供体细菌基因组中,通过转座子、质粒、基因盒-整合子系统、插入序列等多种方式获得外源基因并整合到自身基因组中,从而表现出相应的表型[5-6]。粪肠球菌耐药基因在细菌间的传播,给养殖业带来巨大的经济损失,并给临床治疗带来极大的因难。然而,许多对兽医临床病原菌的耐药性监测却忽略了粪肠球菌。
兽药在防治动物疾病、提高生产性能、改善畜产品质量方面起着十分重要的作用,但滥用兽药,滥用饲料添加剂,不仅对畜牧养殖业造成严重威胁,污染农产品和生产环境,也可引起二次污染,从而使细菌耐药性不断增加,造成严重的经济损失。本次在湖南地区检出万古霉素耐药粪肠球菌菌株证明了湖南地区存在耐万古霉素粪肠球菌。更重要的是抗生素耐药基因在细菌的传播后,携带耐药基因的细菌,尤其是粪肠球菌可能通过食物链或是其他接触,导致人类感染,给人类健康构成极其严重的威胁。
[1] Fisher K,Phillips C.The ecology,epidemiology and virulence of Enterococcus[J].Microbiology,2009,155,1749-1757
[2] Mannu L,Paba A,Daga E,et al.Comparison of the incidence of virulence determinants and antibiotic resistance between Enterococcus faeciumstrains of dairy,animal and clinical origin[J].Int J Food Microbiol,2003,88(2-3):291-304.
[3] 周 霞,程安春,汪铭书 等.致羔羊脑炎粪肠球菌分离鉴定及毒力因子基因的PCR检测[J].中国兽医学报,2008,28(1):35-39.
[4] 王亚宾,陈丽颖,张红英,等.感染仔猪粪肠球菌不同分离株的鉴定及毒力基因的检测[J],中国兽医学报,2010,30(5):615-619.
[5] Agerso Y,Sandvang D.Class 1intergrons and tetracycline resistance genes in alcaligenes,arthrobacter,and pseudomonas spp.isolated from pigsties and manured soil[J].Appl Environmental Microbiol,2005,71(12):7941-7947.
[6] Yu H S,Seol S Y,Cho D T.Diversity of Tn1546-like elements in vancomycin-resistant enterococci isolated from humans and poultry in korea[J].J Clin Microbiol,2003,41(6):2641-2643.
[7] Nayak R,Khan S A,Watson R H,et al.Influence of growth media on vancomycin resistance of Enterococcus isolates and correlation with resistance gene determinants[J].FEMS Microbiol Lett,2002,214(2):159-163.
[8] Creti R,Imperi M,Bertuccini L,et al.Survey for virulence determinants among Enterococcus faecalis isolated from different sources[J].J Med Microbiol,2004,53(Pt 1):13-20.
[9] Khan S A,Nawaz M S,Khan A A,et al.Molecular characterization of multidrug-resistant Enterococcus spp.from poultry and dairy farms:detection of virulence and vancomycin resistance gene markers by PCR[J].Mol Cell Probes,2005,19(1):27-34.
[10] 单松华,谢爱织,王云云,等.进口鸵鸟的粪肠球菌分离鉴定[J].上海农业学报,1998,14(1):87-89.
[11] 唐正安,张乃芬,胡 燕,等.鹑鸡肠球菌引起败血症3例[J].云南医药,2002,23(5):426.
[12] 陈一资,蒋文灿,胡 滨.对鸭场暴发罕见的粪链球菌病的研究[J].中国兽医学报,2003,23(4):324-325.
[13] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社 ,2001.
[14] Weisburg W G,Barns S M,Pelletier D A,et al.16Sribosomal DNA amplification for phylogenetic study[J].Bacteriology,1991,173:697-703
[15] Wheeler A L,Hartel P G,Godfrey D G,et al.Potential of as a human fecal indicator for microbial source tracking[J].Environ Qual,2002,31,1286-1293.
[16] Singh K V,Nallapareddy S R.Importance of the ebp(endocarditisand biofilm-associated pilus)locus in the pathogenesis of Enterococcus faecalis ascending urinary tract infection[J].J Infect Dis,2007,195(11):1671.
