臭氧氧化降解水中氯霉素的效能
2013-09-16史富丽王志平
史富丽,王志平
(上海临港供排水发展有限公司,上海 201305)
自从1929年发现青霉素以来,抗生素便被广泛地应用于医疗。但抗生素在体内不能完全代谢,导致排泄物中含有未被吸收的抗生素[1-4]。近年来已在地表水源、地下水源甚至饮用水中检出抗生素[5,6]。抗生素类药物在环境中的行为及其可能造成的负面影响引起科学界乃至公众的广泛关注[7,8]。研究表明即使是水中痕量级浓度水平的抗生素,人类长期接触也会引发潜在的副作用,如导致细菌产生抗性基因[9,10]并发生过敏性反应[11]。
臭氧[12]是一种强氧化剂,氧化还原电位和pH值相关。在酸性溶液中E0=2.07 V,氧化性仅次于氟;在碱性溶液中E0=1.24 V,氧化能力略低于氯(E0=1.36 V)。臭氧分解产生的羟基自由基(·OH)是一种更强的氧化剂[13],E0=2.85 V。大量研究证明臭氧对水体中的有机微污染物有很好的去除效果。氯霉素是一种广谱抗生素,由于价格低廉及优良的抗菌性和稳定的药效常用于动物各种细菌性传染病的治疗。但是,氯霉素有严重毒副作用,水中残留氯霉素不仅对动物和人体有直接危害,而且会诱发致病菌的耐药性,易引起人体血中毒,导致不可逆的再生障碍性贫血,对人类健康构成巨大的威胁[14]。本研究以氯霉素为水中抗生素,研究其对臭氧氧化效果、影响因素及对反应机理。
1 材料与方法
1.1 试验材料
氯霉素购自中国药品生物制品检定所,纯度为97.5%,其结构及基本性质如表1所示。有机试剂乙腈(纯度为 99.8%,CALEDON Laboratories Ltd.生产)、甲醇和甲酸(纯度为99.9%,CNW Technologies GmbH生产),以上均为色谱纯。腐殖酸购自上海试剂二厂。其它药剂均为分析纯,购自国药集团化学试剂有限公司。试验用水为Milli-Q超纯水(Milli-Q UV Plus system生产)。试验中所用玻璃器皿在使用前使用酸性重铬酸钾浸泡,然后用自来水洗涤,最后再用超纯水反复冲洗。

表1 氯霉素基本物理化学性质Tab.1 Main Physicochemical Properties of Chloramphenicol
1.2 试验方法
臭氧氧化试验采用半连续流运行方式,试验装置如图1所示。臭氧发生器(DHX-Ⅰ型),原料气为空气,臭氧产量为0.24 mg/min。臭氧反应器由玻璃材料制成,Φ40×600 mm,有效容积为700 mL。臭氧经过反应器底部多孔布气板形成细小气泡与水溶液充分接触,尾气由KI溶液吸收。进行臭氧氧化试验时,先将配好的含一定浓度的氯霉素溶液加入反应器中,通入臭氧,在不同反应时间进行取样(取样瓶中预先加入0.025 mol/L的硫代硫酸钠终止臭氧反应),检测氯霉素浓度的变化。采用H2SO4与NaOH调节溶液pH。
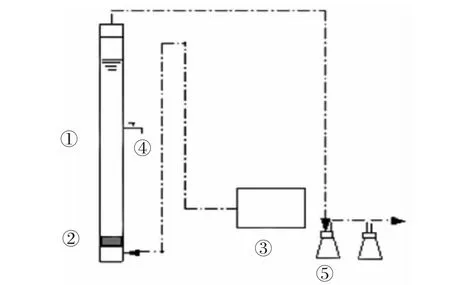
图1 臭氧氧化反应装置示意图Fig.1 Schematic Diagram of Ozonation System
1.3 测试及计算方法
采用液相色谱法测定氯霉素(型号为LC-2010 AHT),采用 Ultimate AQ-C18 色谱柱(5 μm×4.6 mm×150 mm),检测波长为270 nm。流动相为甲酸∶乙腈=70∶30,流速为 1.0 mL/min,柱温为 35 ℃。使用碘量法测定臭氧产量[16]。pH值采用Mettler Toledo pH计测量。TOC采用TOC-V CPH分析仪(TOC 3201)测试。
氯霉素降解率与矿化率(试验中仅对纯水中氯霉素矿化率进行研究)的计算方法如下:

2 结果与讨论
2.1 臭氧氧化氯霉素效果
图2为臭氧氧化氯霉素效果。

图2 臭氧氧化氯霉素效果Fig.2 Degradation and Mineralization Effect of Ozonation on Chloramphenicol
由图2可知氯霉素的浓度随着臭氧化反应时间的进行而降低。而整个去除过程可以分为两个阶段,初始60 s内,氯霉素的去除率达到总去除率的80%以上,在随后的19 min内去除率缓慢降低。氯霉素初始浓度不同其降解率亦不同,高初始浓度下其降解率更大。氯霉素初始浓度为500 μg/L时,臭氧对其降解率为34.6%;而当其初始浓度为50 μg/L时,降解率为27.5%。对于在臭氧氧化初期降解速率明显高于后期的现象可能是由于初始氯霉素浓度较大,则反应速率较大,氯霉素迅速被臭氧氧化。
尽管在20 min内,臭氧对三种不同初始浓度的氯霉素表现出27.5%~34.6%的降解率,但TOC测试结果表明在本试验反应条件下,臭氧氧化过程对氯霉素仅实现约1.0%的矿化率,未被完全矿化分解为二氧化碳和水,被降解的氯霉素应仅是转化为其它中间产物。
2.2 初始pH对臭氧氧化氯霉素的效果影响
在臭氧氧化过程中pH值对水溶液中有机物的降解及去除存在着两方面重要的影响。一方面,pH影响水中臭氧的分解;另一方面,pH影响水中有机物的离解,有机物在不同pH值下的存在状态也可能与其降解率有关。
pH值对水中臭氧的分解及羟基自由基的生成有重要影响。臭氧的分解速度随着水溶液pH的提高而加快。在酸性条件下,臭氧分解缓慢,以分子形态直接氧化有机物。而在碱性条件下,臭氧经OH-离子催化分解生成羟基自由基·OH等活性基团(如式1-6所示)[17],羟基自由基·OH和有机物以非选择性模式反应,与臭氧相比,具有很高的反应速率常数

采用H2SO4与NaOH调节溶液pH值进行臭氧氧化氯霉素试验,结果如图3所示。由图3可知随着pH的增加,臭氧对氯霉素的降解率随之提高。在酸性或者弱酸性条件下,主要是臭氧分子直接参与有机物的氧化反应,其反应能力相对较低。在反应溶液的初始pH值为2.52及5.57的条件下,臭氧对氯霉素的降解率为18.8%和22.4%;而当pH值为8.15和10.24的条件下,臭氧对氯霉素的降解率达到33.4%和52.3%。显然在碱性条件下生成强氧化能力的羟基自由基对氯霉素的降解效果明显强于臭氧分子。在碱性条件下,以羟基自由基为反应体系主要氧化物的臭氧氧化过程对氯霉素的矿化率也明显高于(弱)酸性条件以臭氧分子为主要氧化物的臭氧氧化过程,如图4所示。当pH值为10.24时,其矿化率达到7.9%。在该反应条件下氯霉素的降解率为52.3%,显然即使在强碱性反应条件下,被降解的氯霉素也并未被完全转化为最终产物(二氧化碳和水)。

图3 pH值对臭氧氧化氯霉素效果影响Fig.3 Effect of pH on Ozonation of Chloramphenicol
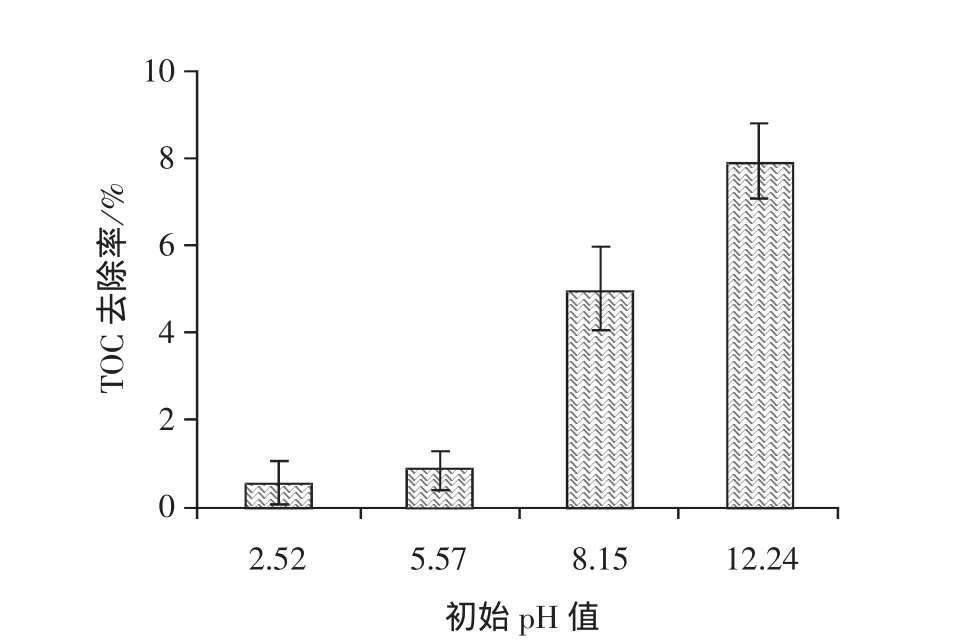
图4 不同pH值条件下臭氧对氯霉素的矿化效果Fig.4 Mineralization Effect of Ozonation on Chloramphenicol under Different pH
对于不同pH条件下氯霉素的臭氧氧化过程,除了pH条件对臭氧的分解产生影响而导致氯霉素的降解率不同外,氯霉素的离解也可能会对其降解率产生影响。在本研究中所涉及的pH范围,氯霉素主要以分子状态存在,不同pH条件下氯霉素的离解可能导致的对其降解率的影响可以忽略不计。为进一步确认碱性条件下氯霉素的高降解/矿化率是由于羟基自由基的氧化作用而引起的,在该反应条件下,加入叔丁醇,考察氯霉素降解/矿化率的变化。叔丁醇是一种很强的羟基自由基捕获剂,它与·OH的反应速率常数为 3.7×109mol-1·L·S-1;而与 O3的反应速率常数为 0.23±0.05 mol-1·L·S-1[19]。对于羟基自由基反应体系而言,加入一定浓度叔丁醇后,有机物的降解率会因为叔丁醇的竞争反应而明显降低,结果如图5所示。加入叔丁醇的反应系统中氯霉素的降解率和矿化率明显下降,并且随着叔丁醇浓度的加大,其对氯霉素的降解及矿化效果的抑制影响随之加强。由上述试验结果可以证实,羟基自由基的生成是提高氯霉素降解率及矿化率的本质原因。
2.3 腐殖酸对臭氧氧化氯霉素效果影响

图5 pH为10.24条件下叔丁醇对臭氧氧化氯霉素的影响Fig.5 Effect of t-butanol on Ozonation of Chloramphenicol at pH=10.24
在实际水体中,天然有机物以mg/L至数十mg/L存在,天然有机物的存在势必对水中微量有机污染物的臭氧氧化过程造成影响。本研究以腐殖酸作为天然有机物的代表,模拟实际水环境的有机背景成分,研究其对臭氧降解微量氯霉素的影响,结果如图6所示。不同浓度的腐殖酸对臭氧氧化氯霉素效果产生了不同的影响。当腐殖酸浓度低于0.7 mg/L(DOC)时,腐殖酸对臭氧氧化氯霉素效果有所促进,且促进作用随着腐殖酸浓度的提高而提高。在腐殖酸浓度达到1.0 mg/L(DOC)时,未对臭氧氧化氯霉素效果产生明显影响(氯霉素降解率29.5%)。而随着腐殖酸浓度的进一步提高,发现氯霉素降解率逐渐减弱。当腐殖酸浓度为5.0 mg/L时,氯霉素降解率仅为12.9%。
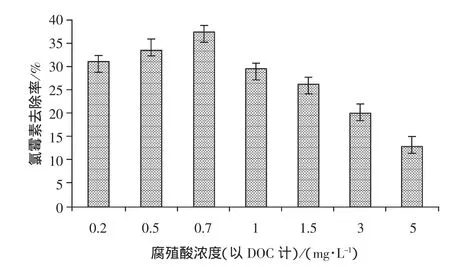
图6 腐殖酸对臭氧氧化氯霉素效果影响Fig.6 Effect of Humic Acid on Ozonation of Chloramphenicol
腐殖质的分子结构复杂,Staehelin等[17]认为,腐殖质分子中含有多种可参与臭氧分解链式反应的活性点(官能团)。这些活性点的某些部分可以与臭氧分子直接作用(如反应式7、8),又可以充当臭氧分解链式反应的引发剂(如反应式9)、促进剂(如反应式10、11)和终止剂(如反应式12)。在不同浓度腐殖酸存在下,其表面对臭氧分解及羟基自由基生成起不同作用的基团浓度应有所不同,推测可能在较低浓度腐殖酸存在时,腐殖酸促进羟基自由基生成的表面基团占主导;当有1 mg/L腐殖酸存在时,可能腐殖酸表面起引发、促进羟基自由基生成的基团与起抑制作用的基团浓度相当,因而体现出无表观影响。而当有更高浓度的腐殖酸存在时,可能是其表面起终止自由基反应的表面基团占主导,臭氧被腐殖酸消耗后未被引发、促进生成羟基自由基,从而导致氯霉素降解率的降低。

3 结论
(1)反应 20 min,臭氧对 50 ~ 500 μg/L 的氯霉素的降解率达到27.5%~34.6%,高氯霉素初始浓度下具有更高降解率。在反应初始的1 min内,氯霉素降解率约占总降解率的80%。在该反应时间内,仅有约1.0%的氯霉素被矿化。
(2)高pH条件有利于臭氧氧化水中氯霉素,其机理在于具有强氧化能力的羟基自由基的生成。当pH为10.24时,初始浓度为200 μg/L的氯霉素的降解率与矿化率分别达到52.3%和7.9%。
(3)腐殖酸对臭氧氧化氯霉素的影响与腐殖酸的浓度有关。本试验条件下腐殖酸浓度低于0.7 mg/L(DOC)时促进了臭氧对氯霉素的氧化;腐殖酸浓度为1.0 mg/L(DOC)时,未对氯霉素降解效果产生明显影响。而腐殖酸浓度的进一步提高抑制了氯霉素的降解。
[1]赵琦,何小娟,唐翀鹏,等.药物和个人护理用品(PPCPs)处理方法研究进展[J].净水技术,2010,29(4):5-10.
[2]石璐,周雪飞,张亚雷,等.环境中药物及个人护理品(PPCPs)的分析测试方法[J].净水技术,2008,27(5):56-63.
[3]贾仁勇,夏四清,张善发.两种MBR工艺处理含抗生素污水效果及反应器内微生物群落结构[J].净水技术,2011,30(5):28-33,39.
[4]Sarmah A K,Meyer M T,Boxall A B.A global perspective on the use,sales,exposure pathways,occurrence,fate and effects of veterinary antibiotics(VAs)in the environment[J].Chemosphere,2006,65:725-759.
[5]Watts C D,Craythorne M,Fielding M,et al.The Third European Symposium on Organic Micropollutants[M].Oslo,Norway:1983.
[6] Ye Z Q,Weinberg H S.Trace analysis of trimethoprim and sulfonamide,macrolide,quinolone,and tetracycline antibiotics in chlorinated drinking water using liquid chromatography electrospray tandem mass spectrometry[J].Analytic Chemistry,2007,79:1135-1144.
[7]Hirsch R,Ternes T a,Haberer K,et al.Occurrence of antibiotics in the aquatic environment[J].The Science of Total Environment,1999,225:109-118.
[8] Golet E M,Xifra I,Siegrist H.Environmental exposure assessment of fluoroquinolone antibacterial agents from sewage to soil[J].Environmental Science and Technology,2003,37:3243-3249.
[9]Turnidge J.Antibiotic use in animals-prejudices,perceptions and realities[J].Journal of Antimicrobial Chemotherapy,2004,53:26-27.
[10]Schwarz S,Kehrenberg C,Walsh T R.Use of antimicrobial agents in veterinary medicine and food animal production[J].Int J Antimicrob Agents,2001,17:431-437.
[11]Webb S,Ternes T,Gibert M,et al.Indirect human exposure to pharmaceuticals via drinking water[J].Toxicology Letters,2003,142:157-167.
[12]邓秋农,沈光辉,袁仁涛,等.臭氧技术的现状及发展趋势[J].净水技术,2001,20(3):7-10.
[13]张林生,杨广平,王薇.臭氧化法在水处理中的应用[J].净水技术,2003,22(1):9-11,31.
[14]胡顶飞,沈建忠.氯霉素类抗生素残留分析[J].中国兽药杂志,2001,35(5):55-57.
[15]Mónica Cecilia Vargas Mamani,Felix Guillermo Reyes Reyes,Susanne Rath.Multiresidue determination oftetracyclines,sulphonamides and chloramphenicol in bovine milk using HPLCDAD[J].Food Chemistry,2009,117:545-552.
[16]Bader H,Hoigné J.Determination of ozone in water by the indigo method[J].Water Research,1981,15:449-456.
[17]Staehelin J,Hoigné J.Decomposition of ozone in water in the presence of organic solutes acting as promoters and inhibitors of radical chain reactions[J].Enviro.Sci.Technol.,1985,19:1206-1213.
[18]Staehelin J,Hoigné J.Decomposition of ozone in water:rate of initiation by hydroxide ions and hydrogen peroxide[J].Enviro.Sci.Technol.,1982,16(10):676-681.
[19]Hoigné J,Bader H.Rate Constants of reactions of ozone with organic and inorganic compounds in water:Part I.non-dissociating organic compounds[J].Water Res.,1983,17:173-185.
