HPLC-ELSD法同时测定复方丹参片中4种皂苷的含量
2013-09-15叶秋雄王德勤覃仁安
吴 笛 叶秋雄 王德勤 覃仁安
(广州白云山和记黄埔中药有限公司现代中药研究院,广州,510515)
复方丹参片由丹参、三七、冰片3味中药组成,三七为其主要成分之一。《中华人民共和国药典》2010年版一部[1]复方丹参片项下有皂苷类成分的薄层色谱鉴别方法,以三七皂苷 R1、人参皂苷 Rg1、人参皂苷Rb1为检测指标,但缺乏皂苷类成分的含量测定,不能全面反映复方丹参片的质量。文献[2-7]显示,三七、复方丹参片中单体皂苷含量测定的方法有薄层扫描法、高效液相色谱法,但薄层扫描法在定量分析的准确度、精密度、稳定性等方面均存在不足,目前薄层扫描法定量已被淘汰;HPLC-UV法因皂苷类成分的紫外吸收均为末端吸收,使用紫外检测器检测时,往往灵敏度低,基线易发生漂移,梯度洗脱时更易发生基线漂移,不利于检测。蒸发光散射检测器(ELSD)是一种质量型检测器,其响应与被测物质的质量成正比,而不依赖于被测物质的光学性质,只要样品的挥发性低于溶剂的挥发性即可被检测,尤其适用于流动相有紫外吸收干扰、梯度洗脱时的基线漂移影响的情况,克服了紫外检测器的不足。我们采用HPLC-ELSD法建立复方丹参片中皂苷类成分含量测定的新方法,旨在完善复方丹参片的质量标准,以更好地控制复方丹参片的质量。
1 仪器、试剂与试药
1.1 仪器 美国戴安公司Dionex UltiMate 3000高效液相色谱仪;美国奥泰公司Alltech 3300 ELSD检测器;色谱柱:Waters Symmetry C18(4.6mm ×250mm,5μm),Waters Sunfire C18(4.6mm ×250mm,5μm),Ecosil C18(4.6mm ×250mm,5μm),Merck Purospher STAR RP -18e(4.6mm ×250mm,5μm),Agilent TC - C18(4.6mm×250mm,5μm),Inertsil ODS -3(4.6mm ×250mm,5μm),Phenomenex Luna 5u C18(2)(4.6mm ×250mm,5μm),Phenomenex Gemini 5u C18110A(4.6mm ×250mm,5μm),Diamonsil C18(2)5u(4.6mm ×250mm,5μm);电热数字显示恒温水浴锅(上海一恒科学仪器有限公司);Sartorius BT214D分析天平(万分之一);Sartorius CP225D分析天平(十万分之一)。
1.2 试剂 乙腈为色谱纯,购于美国TEDIA公司;甲醇为分析纯;水为蒸馏水,购于广州屈臣氏食品饮料有限公司。
1.3 试药 对照品三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd均购于中国药品生物制品检定所,纯度大于98%;复方丹参片样品共14批,其中4批由广州白云山和记黄埔中药有限公司提供,其他购于各地药店。
2 方法与结果
2.1 色谱条件 以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,水为流动相B,按表1进行梯度洗脱,流速1.0mL·min-1;柱温25℃;蒸发光散射检测器漂移管温度50℃,载气流速1.5L·min-1。理论板数按三七皂苷R1峰计算应不低于4000。

表1 梯度洗脱程序
2.2 对照品溶液的制备 取三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd对照品适量,精密称定,加甲醇制成每 1mL 各含 20.56μg、80.64μg、80.48μg、20.12μg的溶液,即得。
2.3 供试品溶液的制备 取本品10片,除去糖衣或薄膜衣,研细,取约1.2g,精密称定,精密加入甲醇60mL,称定重量,放置过夜,置80℃水浴上回流2h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.4 阴性样品溶液的制备 按照处方比例称取除去三七的其他药材适量,按照复方丹参片的制法和供试品溶液的制备方法制备阴性对照溶液,即得。
2.5 测定法 分别精密吸取对照品溶液5μL、20μL,供试品溶液10μL,阴性样品溶液10μL,注入液相色谱仪,测定,用外标两点法对数方程计算复方丹参片中各指标成分的含量。对照品、复方丹参片样品和阴性样品的色谱图见图1,阴性样品在各指标成分相应的保留时间处无干扰。
2.6 方法学考察
2.6.1 线性关系、检测限(LOD)和定量限(LOQ)取三七皂苷R1、人参皂苷Rg1、人参皂苷 Rb1、人参皂苷Rd对照品适量,精密称定,加甲醇制成每1mL各含0.514mg、2.016mg、2.012mg、0.503mg 的溶液,作为储备液。取储备液,稀释为7个不同浓度,按上述色谱条件进行HPLC分析。以对照品浓度的常用对数为横坐标,相应的峰面积的常用对数为纵坐标,得到各指标成分的线性回归方程和线性范围。逐步稀释对照品溶液,按信噪比3和10分别计算各指标成分最低检测限(LOD)和最低定量限(LOQ)。结果见表2。

图1 对照品(A)、复方丹参片样品(B)和阴性样品(C)的色谱图
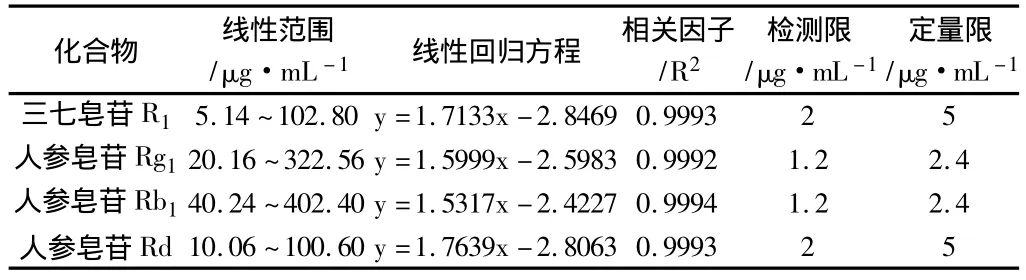
表2 线性关系、检测限(LOD)和定量限(LOQ)
2.6.2 精密度 日内精密度:每3h 1次,以对照品溶液连续进样5次,计算得三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd峰面积积分值的RSD分别为 1.14%、0.52%、0.48%、0.31%,符合要求。日间精密度:每天3次,以对照品溶液连续进样3d,计算得三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd峰面积积分值的RSD分别为2.29%、0.96%、2.13%、2.89%,符合要求。
2.6.3 重复性 取同一样品6份,每份称取约1.2g,精密称定,按上述供试品溶液的制备方法平行制备供试品溶液,进样测定,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd含量的RSD分别为0.77%、0.73%、0.80%、1.61%,显示该法重复性良好。
2.6.4 稳定性 取“重复性”下同一供试品,0、3、6、9、12、24h连续进样6次,记录24h内峰面积,计算得三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd峰面积积分值的 RSD 分别为 3.67%、3.08%、3.75%、3.23%,显示各指标成分在样品溶液中至少24h内保持稳定。
2.6.5 加样回收率 取已知含量的同一批次样品约1.2g,精密称定,精密加入高、中、低三个剂量的三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd对照品,共9份,分别制备供试品溶液,按上述色谱条件进行分析。结果显示:各指标成分的加样回收率均在95% ~105%之间,符合要求,见表3。

表3 加样回收率实验结果
2.7 耐用性 取同一供试品溶液,分别使用Waters Symmetry C18、Waters Sunfire C18、Ecosil C18、Merck Purospher STAR RP -18e、Agilent TC -C18、Inertsil ODS -3、Phenomenex Luna 5u C18(2)、Phenomenex Gemini 5u C18110A、Diamonsil C18(2)5u共9根不同厂牌的色谱柱在上述色谱条件下进行检测,记录色谱图并计算各指标成分的含量。结果显示:在不同色谱柱上各目标化合物均能得到良好分离,含量测定结果误差在允许范围内。
2.8 样品测定 取不同厂家的复方丹参片样品分别制备供试品溶液,按上述色谱条件进行HPLC分析,测定各指标成分的峰面积并计算含量。结果见表4。
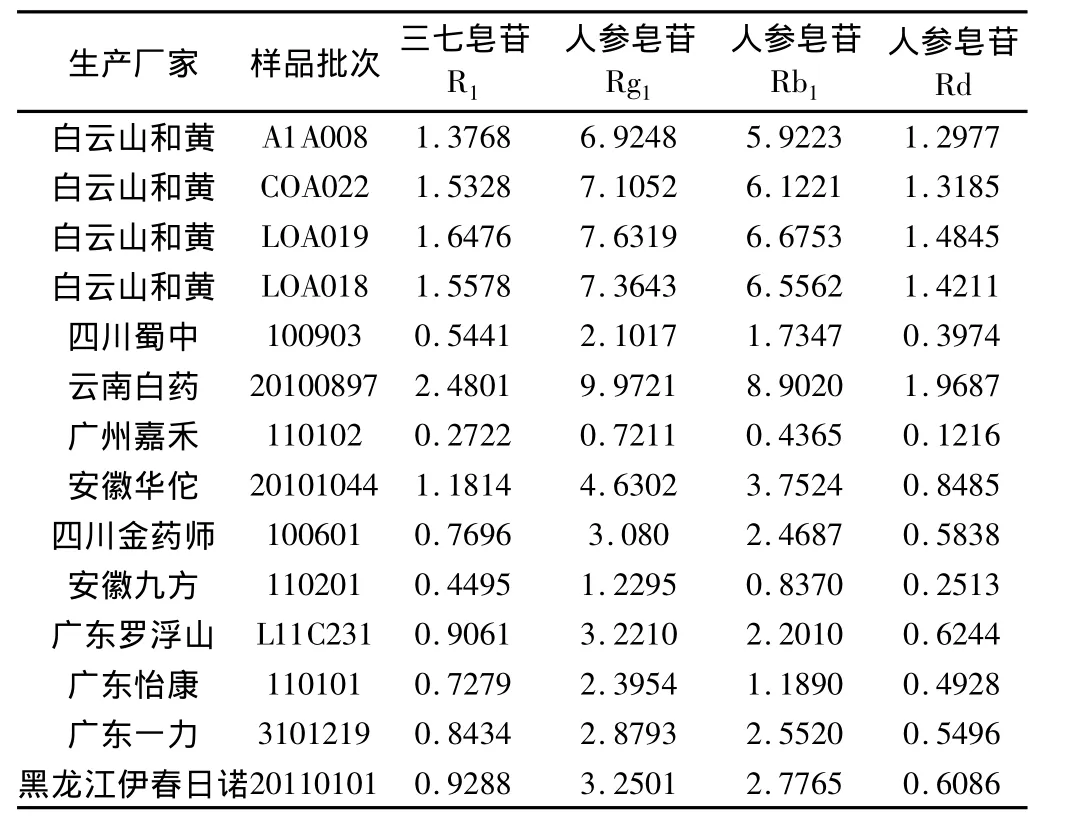
表4 复方丹参片中4种皂苷的含量(mg·g-1,n=3)
3 讨论
据文献[8]报道,三七中的皂苷类活性成分包括人参皂苷 Rg1、Rg2、Rb1、Rb2、Rb3、Rc、Rd、Re、Rh1、F2及三七独有的三七皂苷 R1、R2、R4、R5、Fa、Fc、Fe 等。对复方丹参片的甲醇提取液进行HPLC分析,显示人参皂苷Rg1、人参皂苷Rb1含量最高,其次为人参皂苷Rd、三七皂苷R1,其他皂苷类含量极低(见图1),故选择人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd、三七皂苷R1作为含量测定的检测指标。
我们在预实验阶段曾使用紫外检测器对复方丹参片中皂苷类成分进行检测,参照《中华人民共和国药典》2010年版一部[1]三七项下皂苷类的含量测定方法选择203nm为检测波长,流动相用乙腈-水系统进行梯度洗脱,结果显示基线严重漂移,杂质干扰严重,各指标成分分离较差,经反复摸索也难以得到理想结果。后选用蒸发光散射检测器进行检测,结果显示基线平稳,杂质干扰极小,各目标峰峰形尖锐、分离良好,故选择采用HPLC-ELSD法对复方丹参片中皂苷类成分进行检测。
考虑到所建立的含量测定新方法应具有普遍适用性,对9根不同厂牌色谱柱进行了详细考察,结果显示各指标成分在9根色谱柱上均分离良好,含量测定结果误差极小,说明此方法普适性较好。
因选择作为检测指标的皂苷类化合物结构类似,在多种溶剂中的溶解性趋向一致,故选择与《中华人民共和国药典》2010年版一部[1]三七项下皂苷类含量测定方法一致的甲醇作为样品提取溶剂。
对样品提取方式进行了考察,结果显示:超声处理15min、30min、45min、60min、静置过夜、静置过夜后80℃水浴回流1h得到供试品中4个指标成分的总含量均基本一致,而静置过夜后80℃水浴回流2h、3h得到供试品中4指标成分的总含量明显高于其他6种处理方式。考虑到操作的简便性,样品的提取选择静置过夜后80℃水浴回流2h。
对提取溶剂甲醇的用量进行了考察,结果显示,甲醇用量为60mL时,4指标成分的总含量最高,故选择用60mL甲醇提取、制备样品。
[1]国家药典委员会.中华人民共和国药典一部[S].北京:中国医药科技出版社,2010:904 -905,11.
[2]傅秋生,许小红.HPLC法测定三七总皂苷中3种皂苷的含量[J].解放军药学学报,2009,25(1):84 -86.
[3]张国华,李绍平,万建波,等.RP-HPLC法测定三七总皂苷注射液中9种皂苷的含量[J].安徽医药,2005,9(9):664 -665.
[4]周迎春,赵怀清,梁宁,等.高效液相色谱法同时测定三七总皂苷中人参皂苷Rg1、Re、Rb1与三七皂苷R1含量[J].沈阳医科大学学报,2003,20(1):27 -29.
[5]郑义,陆辉.三七总皂苷的测定及提取工艺的优化研究[J].南京晓庄学院学报,2008,5(3):56 -58.
[6]杨晓静,刘明华,刘田云.不同厂家复方丹参片的三七皂苷R1含量比较研究[J].中国医院用药评价与分析,2011,11(2):151 -153.
[7]乔春玲,官金梅,丁艳芬.不同产地三七皂苷的HPLC指纹图谱与含量的比较研究[J].现代中药研究与实践,2011,25(5):25 -27.
[8]鲍建才,刘刚,丛登立,等.三七的化学成分研究进展[J].中成药,2006,28(2):246 -251.
