不同激素对补血草器官分化的影响
2013-09-15温银元冯文新尹美强王计平王玉国
温银元,冯文新,尹美强,赵 娟,王计平,王玉国
(山西农业大学农学院,山西太谷030801)
补血草(Limonium sinuatum)是白花丹科补血草属(Limonium Mill.)多年生或2年生草本植物,是目前天然干花类中作切花批量生产的花之一[1]。此外,其还具有观赏与药用价值[2],可作为一种新兴的朝阳产业。补血草一般采用种子繁殖,但其遗传性十分特殊,具有大量的不孕枝,又具有同型杂交不孕的特性,种子结实率较低,限制了专业化生产的发展,因此,利用组织培养技术进行快繁为国内外市场提供种苗尤为重要[3-6]。关于补血草的组织培养国内外已有报道[7-15],但未见有以花梗为外植体进行组织培养的研究。
本试验以补血草幼嫩带节花梗为材料,在离体条件下研究不同激素对花梗愈伤组织的诱导、不定芽分化、继代培养及生根的影响,建立和优化离体再生体系,旨在为补血草快速繁殖、种质资源保存及遗传转化提供有效的途径和技术。
1 材料和方法
1.1 植物材料
以台湾引进的补血草(Limonium sinuatum)的幼嫩带节花梗为试验材料。
1.2 愈伤组织的诱导
将补血草幼嫩花梗剪成长2 cm左右的带节小段,剪去叶片,无菌条件下,用70%酒精浸泡30 s、无菌水冲洗3次;然后用0.1%HgCl2溶液浸泡8 min,无菌水冲洗5次,吸干表面水分后接种于MS培养基(附加不同浓度配比的2,4-D和6-BA);暗培养3 d后在光下培养,温度(25±2)℃,20 d时观察、记录愈伤组织的出愈率以及愈伤组织的质量(大小、颜色、紧实程度),选择适宜的激素配比。光照时间16 h/d,光照强度为3 000~4 000 lx。
1.3 诱导不定芽的分化
将愈伤组织接于附加不同浓度配比6-BA和NAA的MS培养基上,观察、记录愈伤组织芽的分化率以及芽的生长状况,选择适宜的激素配比。光照时间16 h/d,光照强度3 000~4 000 lx,温度( 25±2)℃。
不定芽诱导率=产生不定芽的愈伤数/接种愈伤数×100%;平均每块愈伤组织诱导不定芽数=产生的不定芽总数/产生不定芽的愈伤数。
1.4 继代培养
将分化的小苗转接到继代培养基上培养,根据芽分化数和芽增殖率筛选适合补血草分化生长的最适激素配比和培养条件。
1.5 生根培养
继代培养产生大量的丛生芽,转入不同无机盐质量浓度( 1/4 MS,1/2 MS,MS)且含有不同浓度IBA的培养基(蔗糖质量浓度为20 g/L)中,根据苗的生根率、株平均根数和根长来选择适宜的激素配比和培养条件。
生根率=生根植株数/接种株数×100%。
2 结果与分析
2.1 不同激素对补血草花梗愈伤组织诱导影响
由表1可知,在不同激素配比的培养基中,补血草花梗都不同程度地形成愈伤组织,其诱导率、出愈速度、愈伤组织的色泽和质地都各不相同,而在不含任何激素的MS培养基中几乎不能诱导出愈伤组织。单独附加6-BA或2,4-D时,愈伤组织出愈率均很低,但2,4-D诱导愈伤组织频率高于6-BA;2种激素配合使用时,6-BA质量浓度为 0.5,1.0 mg/L,2,4-D质 量浓 度为1.0,1.5,2.0 mg/L的6个配比愈伤组织出愈率均可达80%左右,出愈速度较快,产生的愈伤组织质量较好;当6-BA质量浓度为1.5 mg/L时,各配比的出愈率都很低,出愈速度较慢,产生的愈伤组织质量较差。
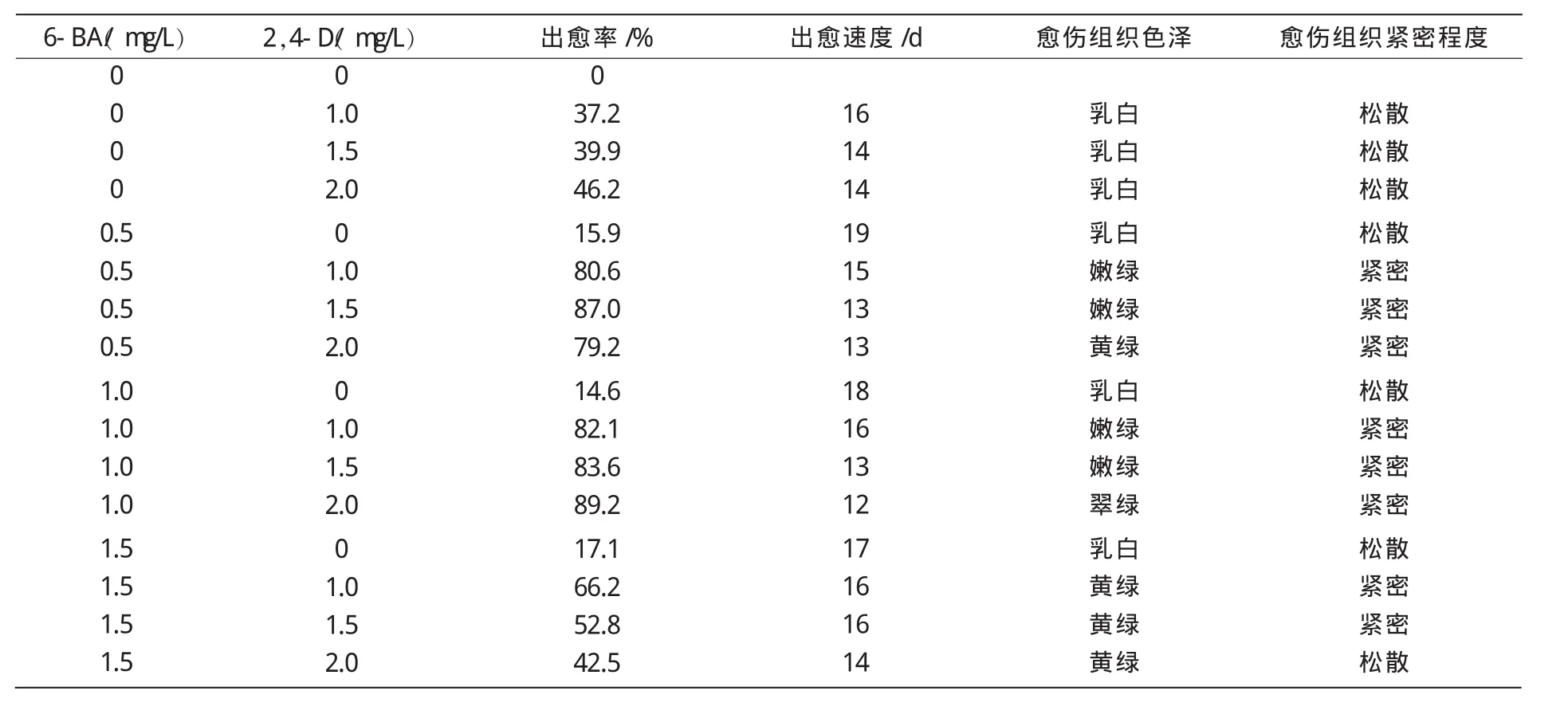
表1 不同质量浓度激素对补血草花梗愈伤组织诱导的影响
在 6-BA为 0.5~1.0 mg/L,2,4-D为 1.0~2.0 mg/L时,各激素配比均适用于愈伤组织的诱导,其中,以 MS+6-BA 1.0 mg/L+2,4-D 2.0 mg/L的愈伤组织诱导率最高,为89.2%,出愈速度最快(12 d),产生的愈伤组织颜色翠绿,质地紧密(图1),其为补血草花梗愈伤组织诱导的最佳培养基。

2.2 激素6-BA与NAA对补血草不定芽的诱导
将诱导产生的愈伤组织,接种在附加不同质量浓度 NAA( 0,0.1,0.5,1.0 mg/L)与 6-BA( 0.5,1.0,2.0,4.0 mg/L)组合的 MS培养基上,进行不定芽的诱导,其结果如表2所示。
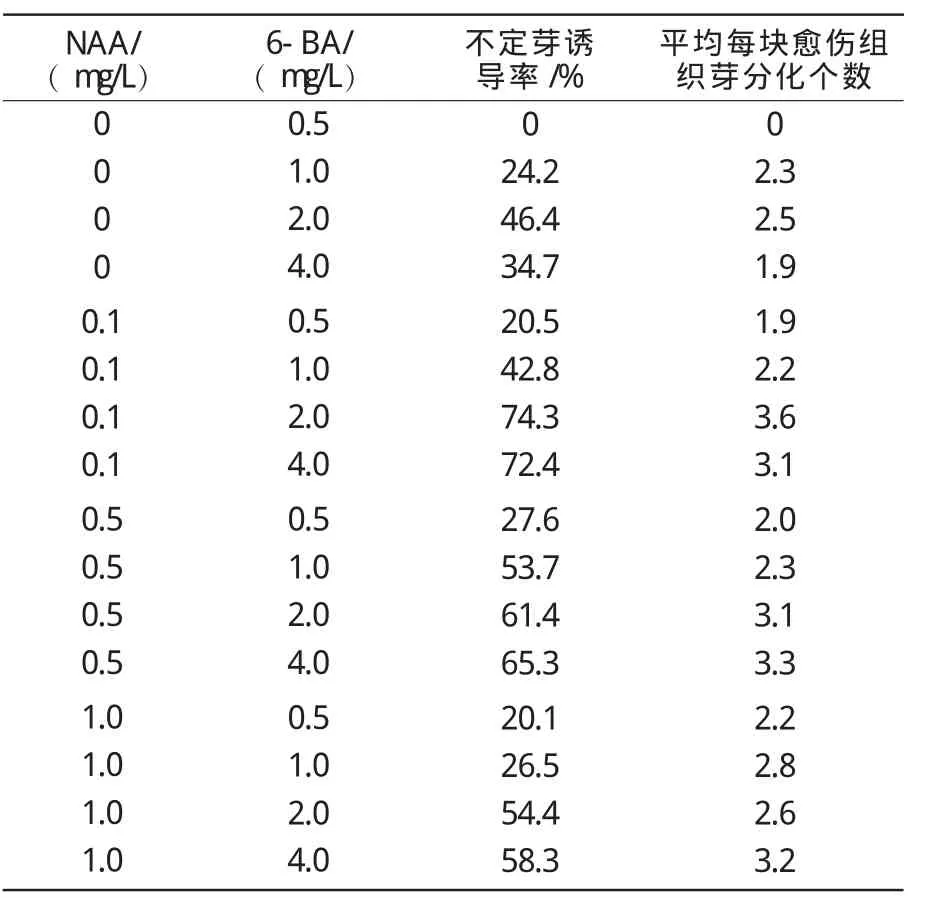
表2 不同质量浓度6-BA与NAA对不定芽诱导影响
由表2可知,MS基本培养基附加一定质量浓度的6-BA和NAA有利于补血草不定芽的发生。由花梗诱导产生的愈伤组织继代培养后3周左右,其表面和周边出现较大颗粒,大多数为绿色和浅绿色,也夹杂少量浅褐色;接种约5周,在绿色或浅绿色颗粒上形成芽点,继而分化出不定芽。当6-BA单独使用时,随着6-BA质量浓度的升高,不定芽的诱导率逐渐增加,6-BA增加至2.0 mg/L时效果最佳,不定芽诱导率达到46.4%,此时平均每块愈伤诱导不定芽数也达到最大,为2.5个;6-BA质量浓度增加到4.0 mg/L时,不定芽诱导率及平均每块愈伤诱导不定芽数又随之下降。NAA加入到含6-BA的培养基中后,可提高不定芽的诱导率,愈伤组织培养在6-BA 2.0,4.0mg/L与NAA 0.1,0.5 mg/L组合的培养基上,不定芽的诱导率在61.4%~74.3%之间,每块愈伤产生的不定芽数均大于3个,其中,以MS+6-BA 2.0mg/L+NAA 0.1 mg/L的效果最佳,诱导率为74.3%,平均每块愈伤诱导的不定芽数为3.6个(图2)。

2.3 激素6-BA和NAA对补血草不定芽继代培养与增殖的影响
将诱导产生的不定芽和腋芽切成等高的小芽,接种在继代增殖培养基上进行分化增殖培养,结果列于表3。
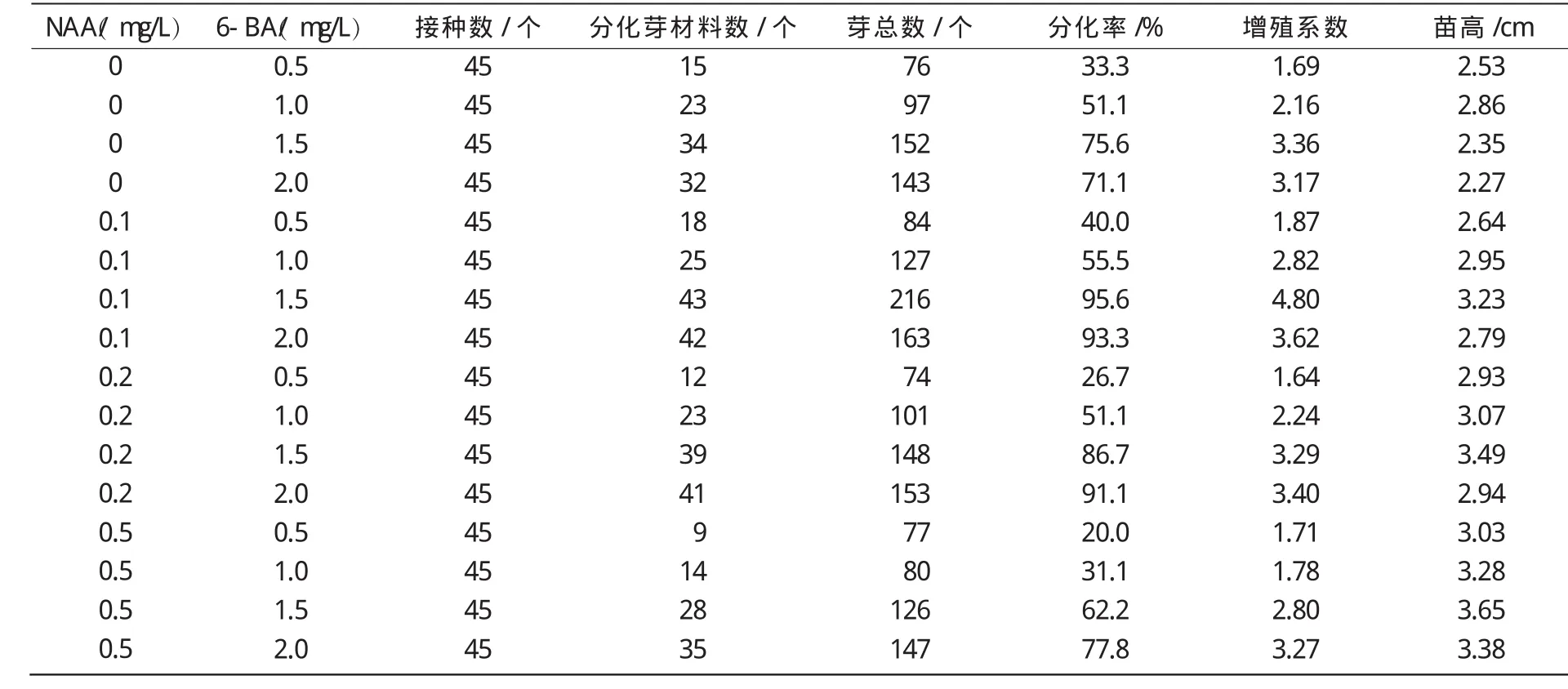
表3 激素6-BA和NAA对补血草不定芽分化增殖的影响
从表3可以看出,在单独使用6-BA时,随着6-BA质量浓度的增加,补血草的分化率、增殖系数都增加,6-BA质量浓度为1.5,2.0 mg/L时,分化率在70%以上,增殖系数大于3.0;高质量浓度的6-BA不利于分化出的幼苗生长,如6-BA为1.0 mg/L时,平均苗高为2.86 cm,而6-BA为1.5,2.0 mg/L时,苗高度则分别降低至2.35,2.27 cm。NAA和6-BA配合使用可以提高补血草的分化率和增殖系数,促进分化幼苗的生长,其中,以NAA 0.1~0.2 mg/L+6-BA 1.5~2.0 mg/L时的效果最好,分化率大于85%,使幼苗数增加3倍以上(最高可达到4.80倍)(图3)。当NAA质量浓度增加到0.5 mg/L时,可以增加试管苗的高度,但分化率和增殖系数均降低,且产生的幼苗瘦弱,在以后的继代培养中分化和增殖能力较差。

2.4 激素IBA对补血草生根的影响
由表4可知,在不同培养基上,补血草的生根率、株平均根数及根长都有所不同,其中,以1/2 MS的生根率最大。IBA以1.0 mg/L的效果最好,在1/2 MS+IBA 1.0 mg/L的培养基上,生根率高达100%;株平均根数为4.3条,最多的有8条;株平均根长为2.6 cm,最长的4.6 cm。当IBA质量浓度为1.5 mg/L时,试管苗基部有愈伤组织产生,抑制根的形成,导致根基部加粗,根系短小。
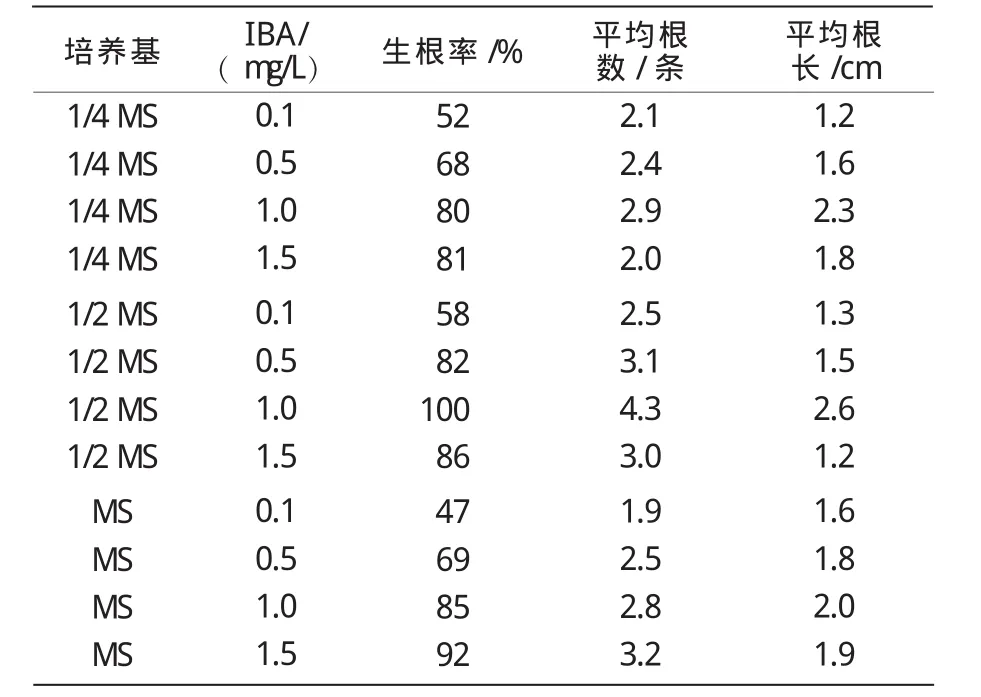
表4 培养基及IBA对补血草试管苗生根的影响
3 结论
本试验结果表明,在MS+6-BA 1.0 mg/L+2,4-D 2.0 mg/L的培养基上,补血草花梗愈伤组织诱导率最高( 89.2%),出愈速度最快(12 d),产生的愈伤组织颜色翠绿,质地紧密,为补血草花梗愈伤组织诱导的最佳培养基。6-BA与NAA配合使用,可提高补血草不定芽的诱导率和增殖系数。不定芽诱导时,以MS+6-BA 2.0 mg/L+NAA 0.1 mg/L的效果最佳,诱导率为74.3%,平均每块愈伤组织诱导的不定芽数为3.6个。以NAA 0.1~0.2 mg/L+6-BA 1.5~2.0 mg/L的继代增殖效果最好,分化率大于85%,使幼苗数增加3倍以上。生根培养时,以1/2 MS+IBA 1.0 mg/L+蔗糖20 g/L的生根率最大,为100%。
[1]黄勇,张秀省,孟宪磊.野生花卉补血草属及其开发利用[J].中国种业,2002( 8):42.
[2]汤新慧,沈敏.补血草属植物化学成分及药理作用研究进展[J].时珍国医国药,2007,18( 8):1874-1876.
[3]李秀花.野生花卉二色补血草引种利用研究 [J].中国园林,2003( 10):78-80.
[4]许毅洪,李福生,赵洪涛.人工栽培二色补血草前景光明[J].植物杂志,2004( 1):12-13.
[5]邓旺华,王雁.补血草属植物在城市绿化中的应用[J].中国城市林业,2006,4( 2) :58-60.
[6]陈佳瀛,杜秀达.补血草的组织培养和快速繁殖[J].植物生理学通讯,2002,38( 6):594.
[7]那淑芝,李云祥,甄占萱,等.二色补血草的组织培养与快速繁殖[J].承德民族师专学报,2003,23( 2):79-80.
[8]陈银凤,陈篙.二色补血草试管苗生根及移栽基质研究[J].亚热带植物科学,2001,30( 3):37-39.
[9]倪跃元,朱锦文,赵晓艺.大花补血草优株无性系的建立[J].植物生理学通讯,1996,32( 3):200.
[ 10] Hsu NaiWen,Liu TsuHwie.Themicropropagation of Limonium wrightii( Hance) O.Kuntze[J].Journal of the Chinese Society for Horticultural Science,2000,46( 3):277-286.
[11] John F Seelye.Shoot regeneration from leaf discs of Limonium perigrinum usingthidiazuron[J].New Zealand Journal of Crop and Horticultural Science,1994,22:23-29.
[ 12] Huang CL.In vitro propagation of Limonium wrightii( Hance)KTZE.(Plumbaginaceae),an ethnomedicinal plant,fromshoottip,leaf-and inflorescence-node explants[J].In vitro Cellular and Development Biology-Plant,2000,36( 3) :220-224.
[13]柴慈江,史燕山,骆建霞,等.二色补血草组织培养快速繁殖技术研究[J].天津农业科学,2010,16( 2):27-28,31.
[14]杨丽莉,张晓,晋凡生,等.激素对萱草组织培养参数的影响[J].山西农业科学,2012,40( 8):815-818.
[15]范小峰,杨颖丽,刘军梅,等.黄花补血草愈伤组织的诱导和植株再生[J].西北植物学报,2007,27( 2):257-261.
