聚合硫酸铁-硫酸铜溶液吸收H2S的研究
2013-09-15沈力,张亮,刘淼
沈 力,张 亮,刘 淼
(吉林大学环境与资源学院,吉林 长春 130012)
硫化氢(H2S)是一种具有臭鸡蛋气味的刺激性气体,广泛存在于各种有毒有害气体之中,如垃圾处理厂废气、含硫天然气和煤气、食品工业和污泥处理厂的废气等[1].我国对环境大气、车间空气及工业废气中硫化氢质量浓度已有严格规定:居民区环境大气中硫化氢的最高质量浓度不得超过0.01mg/m3;车间工作地点空气中最高质量浓度不得超过10mg/m3;城市煤气中不得超过20mg/m3;油品炼厂废气中硫化氢质量浓度要求净化至10~20mg/m3.含硫化氢废气的达标处理对环境和人体健康有着举足轻重的作用[2].目前,国内外处理H2S废气的方法主要分为干法和湿法两类,研究较多的如利用活性炭吸附、杂多酸铁离子吸附和碳酸钠溶液吸附等[3-5].
聚合硫酸铁是一种铁系无机高分子絮凝剂,具有良好的絮凝和吸附作用.在水处理过程中,聚合硫酸铁能很快形成大量的[Fe(OH)2]+,[Fe(OH)]2+和[Fe2(OH)2]4+等多核络离子,极易生成絮凝体,凝聚性能好[6].而且絮凝剂耗量少、沉降速度快、pH适用范围宽、水中残留铁离子少、水解产物脱水性能优良、重金属的去除率高、出水质量优良、处理成本低[7].聚合硫酸铁广泛应用于生活饮用水、工业循环水及化工、石油、矿山、造纸、印染、酿造、钢铁、煤气等行业工业废水的净化处理[8],对不同地区不同种类的水源均能达到理想的效果.
本文着重考察了聚合硫酸铁-硫酸铜溶液对H2S气体的吸收处理,以找到一种既可以吸收高浓度H2S气体又方便易得的吸收剂,以较低的浓度得以吸收较大浓度的H2S气体,这样高浓度H2S的处理流程将得到简化,处理成本也将大幅度下降.
1 实验部分
1.1 仪器和试剂
仪器:QC-1型空气采样器,大型气泡吸收管(长春吉大小天鹅仪器有限公司);721型分光光度计(上海第三分析仪厂);FA1604型电子天平(上海天平仪器厂).
试剂:标准吸收液,将4.3g硫酸镉、0.30g氢氧化钠、10.0g聚乙烯醇磷酸铵定容至1000mL;对氨基二甲基苯胺贮备液,量取浓硫酸25.0mL,边搅拌边倒入15.0mL水中,冷却.称取6.0g对氨基二甲基苯胺盐酸盐,溶解于上述硫酸溶液中,在冰箱中长期保存;混合显色剂,吸取2.5mL贮备液,用体积分数为50%的硫酸溶液稀释至100mL.使用时,按1.00mL对氨基二甲基苯胺使用液和一滴FeCl3溶液的比例相混合.
1.2 吸收液的制备
将10.0g聚合硫酸铁完全溶解于少量水中,再加入24.25g硫酸铜晶体,使之完全溶解,定容至200mL.储存于容量瓶中以备使用,可长期保存.H2O2见光可分解,极不稳定,需现用现加.由于该吸收液的吸收效果非常好,故实验使用时需再稀释50倍.
1.3 标准曲线的制备
利用亚甲基兰分光光度法绘制标准曲线[9].
1.4 实验装置
用FeS与稀硫酸的反应制取H2S气体,可8h持续均匀地产生H2S气体,完全可以满足实验要求,可以通过调节酸的浓度调节产生H2S速度的快慢.实验过程由大气采样器控制流量,实验装置如图1所示.
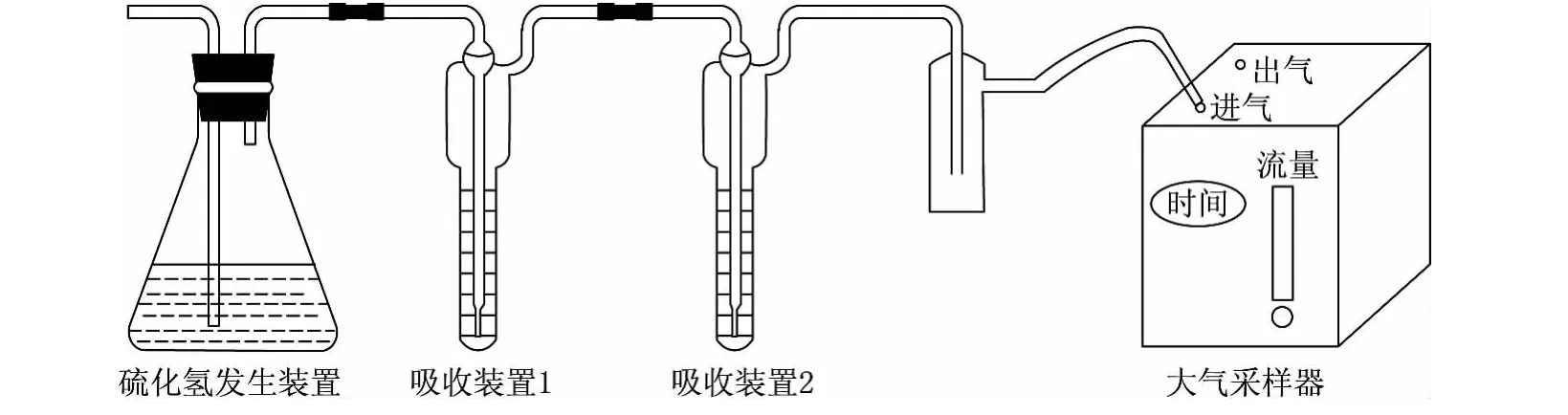
图1 实验装置图
1.5 实验步骤
(1)H2S初始浓度的测定
在H2S气体发生装置中加入250mL水,再用滴管加入5滴浓硫酸(0.25mL),摇匀后,投入大小约1cm3的FeS固体(FeS之前用盐酸清洗,以清除表面氧化膜保证反应的进行),连接尾气吸收装置,打开大气采样器,开始抽气.待30min后H2S气体产生速率基本稳定后再连接吸收装置进行实验.在2个吸收管中分别加入10.0mL的标准吸收液吸收H2S气体,通过大气采样器0.5L/min的流速采样5min,在2个吸收管中各取1mL均匀溶液于20mL比色管中,加入2mL混合显色剂,再将溶液稀释至20mL,摇匀,静置30min,加一滴磷酸氢二铵溶液,摇匀以排除铁离子颜色的干扰[10].将溶液加在1mL比色皿内,以水为参比,在665nm波长下测定吸光度[11],并计算出H2S的初始浓度.由于吸收H2S的量与浓度、流速、吸收时间均有关系,为减少吸收时间,H2S的浓度应略高,实验测得H2S的平均初始质量浓度为68mg/m3,符合实验要求.
(2)聚合硫酸铁-硫酸铜溶液对H2S气体的吸收
在一定的初始浓度和一定的反应时间条件下,在H2S发生装置连接的第1个吸收管中,换成聚合硫酸铁的吸收液,并加入不同比例H2O2作为催化剂.气体先经过聚合硫酸铁吸收液吸收,剩余尾气再由第2个吸收管吸收.通过已知的初始浓度和时间可以计算出产生的H2S总量,再计算出尾气吸收装置吸收的H2S的量即可得到聚合硫酸铁-硫酸铜溶液吸收的H2S量,测定方法同上.
H2S去除率公式:X=[(c0-c)/c0]×100%.
其中:c0代表初始浓度,c代表反应后气体的浓度,X代表去除率.
2 结果与讨论
在未加聚合硫酸铁-硫酸铜的实验装置中,串联2个吸收装置,目的是让吸收管1未完全吸收的H2S气体被吸收管2吸收,2个吸收管的浓度求和既是H2S气体的初始浓度.经实验测得,吸收装置2吸收H2S的浓度远低于装置1吸收的H2S,可粗略认为在吸收装置1中吸收H2S的浓度等同于H2S发生装置生成的H2S的浓度.当吸收装置1加入聚合硫酸铁-硫酸铜吸收液,吸收装置2加入标准吸收液时,通过测标准吸收液吸收的量,从而计算出聚合硫酸铁-硫酸铜吸收液的吸收效率.
2.1 不同比例H2O2作为催化剂的对比实验
实验过程中加入与Cu2+不同物质的量配比的H2O2作为催化剂(如图2所示).当Cu2+与H2O2的物质的量比为1∶4时,其穿透时间较不加H2O2和加入配比为1∶2的时间都要长,当不加H2O2时出口浓度急剧增加,而当Cu2+与H2O2的物质的量比为1∶4时,其穿透曲线上升缓慢,可见H2O2的加入对于聚合硫酸铁-硫酸铜溶液的吸收效果有明显的增强,起到很好的催化效果.
由图2可见,当Cu2+与H2O2物质的量比为1∶4的时吸收效果最好.取H2S出口浓度为进口浓度的10%作为穿透点,则聚合硫酸铁-硫酸铜溶液在100min穿透,吸收效率维持在90%以上.从图2中可以看出,在气体流量、吸附剂用量相同的条件下,不同时间下Cu2+与H2O2物质的量比为1∶4时对H2S的吸收量最大.此溶液相比于其他固体吸附剂如沸石、活性炭等有更大的吸收容量和吸收速率.
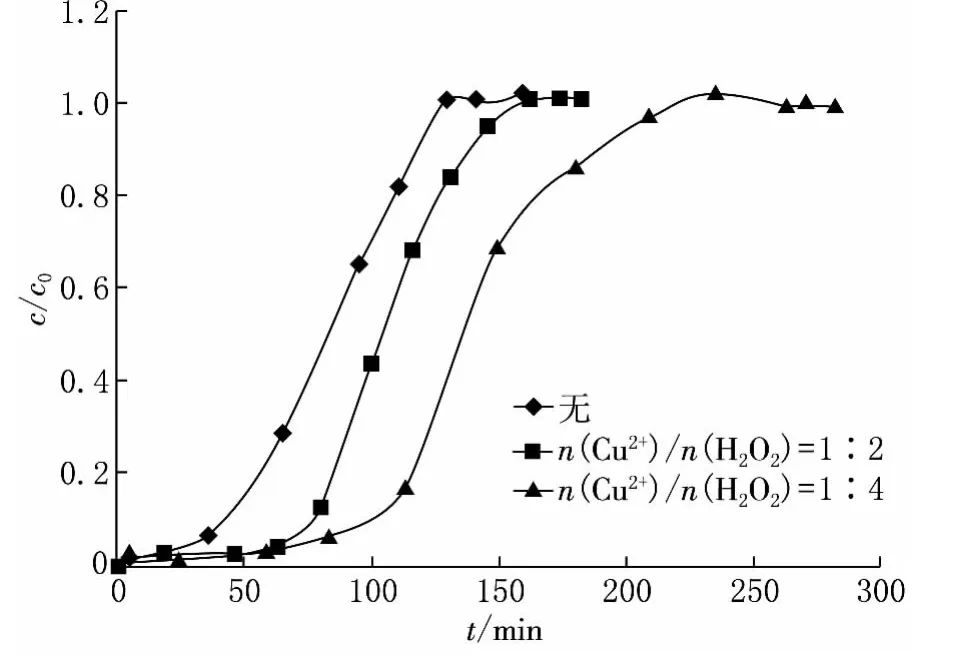
图2 不同比例H2O2作为催化剂聚合硫酸铁-硫酸铜溶液对H2S吸收的穿透曲线
2.2 多种组合吸收液吸收H2S的对比实验
在原始条件均不变的条件下,控制初始质量浓度为68mg/m3,按照聚合硫酸铁-硫酸铜的混合比例,配成聚合硫酸铁-硫酸锌、聚合硫酸铁-氯化铁的吸收液,同样加入n(Cu2+)∶n(H2O2)=1∶4的H2O2作为催化剂,测定其各自的吸收效率(如图3所示).从图3可以看出,聚合硫酸铁中加入硫酸铜的穿透时间最长,其吸收效率最大.
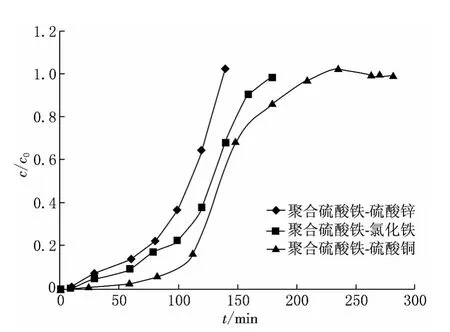
图3 聚合硫酸铁和多种盐类组合对H2S吸收的穿透曲线
2.3 H2S的吸收效率和吸收量
实验中对H2S的吸收效率进行了计算,图4给出了H2S吸收效率随时间变化的关系.从图4中可以看出,聚合硫酸铁-硫酸铜的吸收液在前120min内的吸收效率保持在80%以上,前50min的吸收效率接近100%.
聚合硫酸铁-硫酸铜溶液对H2S的吸收量随时间的变化关系如图5所示.由图5可见,随着时间的增长,聚合硫酸铁-硫酸铜溶液对H2S的吸收量不断增加,但增长幅度逐渐降低,直至大约200min时完全穿透.
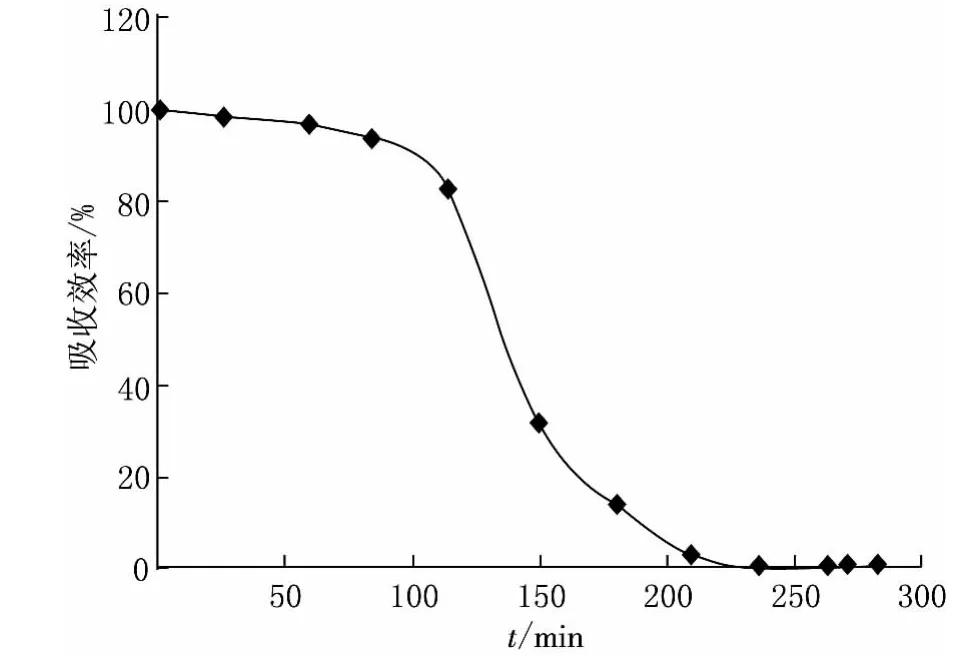
图4 聚合硫酸铁-硫酸铜吸收液吸收H2S的效率与时间关系

图5 聚合硫酸铁-硫酸铜溶液对H2S的吸收量随时间的变化关系
3 结论
实验研究了一种新型聚合硫酸铁-硫酸铜吸收液对H2S的吸收能力、催化剂H2O2的用量和催化效果.通过几组对比实验得出以下结论:
(1)测得H2S气体初始质量浓度为68mg/m3,远高于生活中H2S气体的浓度,而所用稀释50倍后的吸收液在较高H2S气体初始浓度和一定反应时间条件下,该吸收液对H2S就有较好的吸收作用.
(2)H2O2的加入对吸收反应的进行有明显促进作用,随着H2O2量的增加,穿透时间增加,吸收反应更加充分完全,吸收效率有所增加.
(3)实验中应用的几种盐类与聚合硫酸铁组成的混合溶液对H2S气体的吸收均有很好的吸收效果.在维持吸收效率达到90%以上的情况下,聚合硫酸铁与硫酸铜配成的吸收液要比与其他盐类配成的吸收液吸收H2S气体的时间更长,吸收的量更大.
[1]赵由才,鲍晓军,王贤清,等.钼硅酸化学吸收脱除 H2S气体回收硫磺的研究[J].环境科学学报,1996,16(1):82-88.
[2]张家忠,易红宏,宁平,等.硫化氢吸收净化技术研究进展[J].环境污染治理技术与设备,2002,6(3):47-52.
[3]黄妍,张俊丰.活性炭吸附——微波技术再生处理粘胶纤维废气的研究[J].环境污染治理技术与设备,2005,6(9):72-74.
[4]鲍晓军,刘立斌,魏伟胜,等.杂多酸化学吸收从天然气中脱除 H2S回收硫磺的研究[J].过程工程学报,1996,17(2):144-150.
[5]张永,王学谦,宁平,等.碳酸钠溶液吸收处理硫化氢试验研究[J].云南化工,2006,33(2):32-34.
[6]张瑛洁,杨榕,曹天静,等.聚合硫酸铁的制备及改性研究进展[J].工业水理,2011,31(9):11-14.
[7]刘晓林.聚合硫酸铁的特性及应用[J].鹰潭科技,1991(2):17-22.
[8]韩秀山.我国净水剂的专利汇总[J].广东橡胶,2006(5):27-32.
[9]国家环境保护局.空气和废气监测分析方法[S].北京:中国环境科学出版社,1990:124-127.
[10]刘贤淼,江泽华,费本华,等.造纸污泥硫化氢释放量及控制研究[J].环境污染与防治,2009(11):1-4.
[11]刘小凤,王永刚.废水中硫化物测定条件的选择[J].中氮肥,2003(4):62-63.
