骨形态发生蛋白4通过ERK/MAPK信号通路影响人脐静脉内皮细胞的成血管能力
2013-09-15仉红刚卡米拉阿不里米提张秋菊修瑞娟
王 琴,仉红刚,卡米拉·阿不里米提,张秋菊,修瑞娟
(中国医学科学院北京协和医学院微循环研究所,北京100005)
骨形态发生蛋白(bone morphogenetic proteins,BMPs)属于转化生长因子超家族中的一类成员,它们对于细胞的分化、增殖、迁移、存活等生物学过程中具有重要的调控作用[1-2]。最初的研究认为,BMP-2和BMP-4在间质干细胞的分化以及骨及软骨的形成及修复过程中骨的形成和血管的形成具有重要作用[3-4]。然而,也有不少的研究结果显示,BMPs及其受体参与血管发生(vasculogenesis)和血管新生(angiogenesis)。例如,BMP-4表达缺陷的小鼠,其心脏及脉管系统的发育异常[5],敲除了Smad1或Smad5基因的小鼠由于脉管系统发育不完全而死于胚胎期[6]。另外,BMPs影响小鼠胚胎干细胞来源的内皮细胞及人表皮微血管内皮细胞的增殖和迁移[7]。尽管BMPs对于内皮细胞功能的作用越来越受到研究者们的关注,但是,BMPs,特别是BMP-4对于人脐静脉内皮细胞成血管能力的影响及其作用机制的研究仍未见报道。故本研究主要分析了BMP-4对于脐静脉内皮细胞的增殖,迁移,体外成血管能力的影响,并且对于参与其中的分子机制做初步探讨。
1 材料与方法
1.1 试剂
无菌PBS,D'Hanks(中国医学科学院基础医学研究所细胞中心),Hanks,BrdU细胞增殖检测试剂盒(Invitrogen公司),胶原酶Ⅳ,纤维连接蛋白(Sigma公司),内皮细胞用培养基(Sciencell公司),细胞因子BMP-4(R&D Systems公司),包被小鼠抗人CD31单克隆抗体的免疫磁珠(Miltenyi公司);小鼠抗人VE-cadherin单克隆抗体及TRITC标记的山羊抗小鼠荧光二抗(Santa Cruz公司);基质胶(BD Biosciences公司),RIPA裂解液,SDS-PAGE凝胶配制试剂盒(碧云天公司),BCA定量试剂盒(普利莱公司);兔源抗 phospho ERK1/2一抗,兔源抗 total ERK1/2一抗,辣根过氧化物酶标记的抗兔二抗(Cell Signaling公司)。
1.2 HUVEC的分离与培养
原代分离HUVECs,步骤参照文献[8]。采用含10%FBS的内皮细胞专用培养基培养。细胞培养于37℃,5%CO2的孵箱中,取3~6代细胞进行实验。
1.3 HUVECs的纯化与鉴定
使用包被小鼠抗人CD31单克隆抗体的免疫磁珠对原代分离的HUVECs进一步纯化。以小鼠抗人VE-cadherin单克隆抗体及TRITC标记的山羊抗小鼠荧光二抗鉴定纯化后的HUVECs。
1.4 细胞增殖检测
细胞增殖的检测采用BrdU法,利用BrdU试剂盒进行,步骤如下:按照5×103个/孔的接种密度将HUVEC接种至96孔板。血清饥饿8 h。分别以不同浓度的 BMP-4(5、10、20、50 和100 ng/mL)处理细胞24 h,每个浓度5个复孔。在BMP-4作用细胞8 h后,加入BrdU,BMP-4作用24 h后,将细胞固定。加入抗BrdU的一抗,室温,1 h。辣根过氧化物酶标记的二抗,室温,30 min。加入辣根过氧化物酶底物,室温,避光,30 min。酶标仪检测吸光度。
1.5 划痕实验
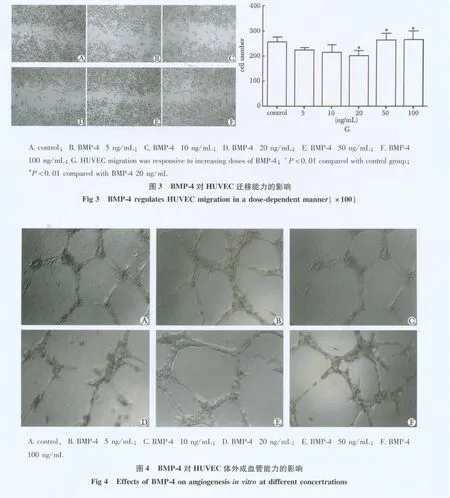
本实验用于观察BMP-4对HUVECs迁移能力的影响。步骤如下:采用包被纤维连接蛋白(10 mg/L)的12孔板培养HUVECs至汇合。使用200 μL黄色枪头垂直于细胞培养面划出相互垂直的两条直线。PBS洗2次,倒置显微镜下以两条划痕的交点为中心,在5×物镜下对连续5个视野进行拍照记录;干预细胞:在干预前8 h以无血清培养基对细胞进行饥饿处理后,进行干预实验。对照组:以无血清培养基培养细胞24 h;BMP-4组:分别以浓度为5、10、20、50 和100 ng/mL的 BMP-4 作用细胞24 h;结晶紫染色HUVECs并在同一位置拍照记录迁移情况;使用Image-Pro Plus 6.0软件测定单个视野十字划痕内的细胞数以衡量HUVECs的迁移能力。实验重复3次。
1.6 HUVEC体外成血管能力检测
本实验考察BMP-4干预下HUVECs形成血管管腔样结构的能力。步骤如下:实验前1 d应把96孔板,200 μL黄色枪头移至4℃遇冷过夜。实验前1 d将基质胶自-20℃移至4℃过夜缓慢融化;在冰上以每孔25 μL基质胶包被96孔板;37℃ 30 min使胶凝固;每孔接种5×103个HUVECs,培养基最终体积为100 μL,24 h后观察各组成管情况,以 HUVECs是否形成血管管腔样结构衡量其成管能力。实验重复3次。
1.7 Western blot
细胞长至汇合后,分别以上述浓度的BMP-4处理细胞10 min,RIPA裂解液提取细胞总蛋白,BCA法测定蛋白质浓度,每孔上样量为30 μg。电泳,恒压65 V,约40 min时样品前沿进入分离胶,切换电压到120 V,直至溴酚蓝跑到距胶底沿1.0 cm时终止电泳。采用湿转法进行转膜,恒流,86 mA,3 h。
1.8 统计学分析
2 结果
2.1 HUVECs的形态学观察
HUVECs呈单层贴壁生长,细胞为扁平短梭状。待细胞汇合后即表现为鹅卵石样(图1A)。免疫荧光染色显示细胞为VE-cadherin阳性,证实细胞确为HUVECs(图1B)。
2.2 BMP-4对HUVEC增殖能力的影响
与对照组相比,只有在BMP-4浓度是20 ng/mL时,对HUVEC的增殖才有显著抑制作用。当BMP-4的浓度为50和100 ng/mL,这种抑制作用减弱,HUVEC的增殖能力又恢复到正常水平(图2)。
2.3 BMP-4对HUVEC迁移的影响
与对照组相比,只在BMP4浓度是20 ng/mL时,对HUVEC的迁移才有显著抑制作用。当BMP-4浓度为50和100 ng/mL,这种抑制作用减弱,HUVEC的迁移能力又恢复到正常水平(图3)。
2.4 BMP-4对HUVEC体外成血管能力的影响

图1 HUVECs的形态学观察Fig 1 Morphology of HUVECs(×400)
与对照组相比,只在 BMP-4浓度是20 ng/mL时,对HUVEC的体外成血管能力才有显著抑制作用。当BMP-4浓度为50和100 ng/mL,这种抑制作用减弱,HUVEC的体外成血管能力又恢复到正常水平(图4)。
2.5 ERK/MAPK信号通路参与BMP-4对HUVEC成血管能力的影响
与对照组相比,BMP-4在低浓度即 5,10,20 ng/mL时抑制HUVEC ERK/MAPK的活性,但是这种抑制作用只在 BMP4浓度是10 ng/mL与20 ng/mL时具有统计学意义。然而,随着BMP-4浓度的继续升高,即BMP-4的浓度为50,100 ng/mL,这种抑制作用减弱,HUVEC ERK/MAPK活性又恢复到正常水平(图5)。
3 讨论
早期的文献表明,BMPs在胚胎早期发育和血管系统的形成过程中具有重要的作用,之后,陆续有研究关注BMPs对于内皮细胞体外成血管能力的影响[9]。然而,针对BMP-4对于脐静脉内皮细胞体外成血管能力的影响的研究至今仍很少见。本研究结果表明,BMP-4的浓度在20 ng/mL时,才对HUVECs的成血管能力有显著抑制作用。然而,当BMP-4的浓度升高至50和100 ng/mL时,这种抑制作用逐渐减弱,并有恢复到正常水平的迹象,这一结果与一些研究结果存在一定的不一致,如BMP-2呈浓度依赖型促进HUVEC的增殖。迁移[10],尽管BMP-2和BMP-4属于BMPs家族中同一亚类,但是这种不一致仍然可能与BMP-2和BMP-4的生物学功能存在一定的差异有关。

图2 BMP-4对HUVEC增殖能力的影响Fig 2 Effects of BMP-4 at different concertrations on HUVEC proliferation
BMPs与受体结合后,Ⅰ型受体被组成型活化的Ⅱ型受体磷酸化,继而启动Smad信号级联通路。Smad1/Smad5/Smad8被活化的Ⅰ型受体磷酸化后,与co-Smad(Smad4)结合后转移至细胞核以调控相关基因的表达。然而本研究结果发现,存在不同于Smad通路以外的其他信号通路参与 BMP-4对HUVEC成血管能力,即ERK/MAPK通路,这一结果与一些研究结果一致,认为 BMPs通过 ERK/MAPK[11-12]通路调节细胞增殖,分化和凋亡。
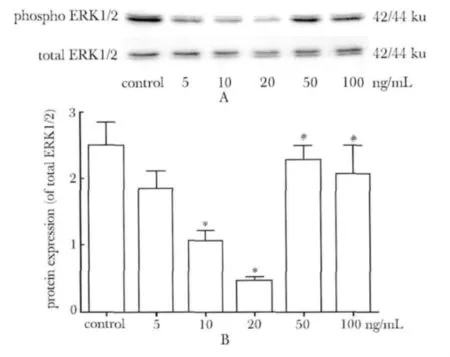
图5 BMP-4对HUVEC ERK1/2的影响Fig 5 Effects of BMP-4 on pERK1/2 expression of HUVECs(±s)
本研究结果显示,BMP-4在低浓度时具有抑制HUVEC的增殖、迁移和成血管,然而随着BMP-4浓度的升高,这种抑制作用逐渐减弱,phospho ERK1/2水平的变化趋势与上述作用一致,故本研究结果提示BMP-4对于HUVEC体外成血管能力的影响可能是通过ERK/MAPK发挥作用的。此外,有研究认为,BMP-4通过 dual-specificity phosphatase(DUSP)的磷酸酶来调节phospho ERK1/2的水平[13]。在本研究中,BMP-4 对于phospho ERK1/2水平的调控是否也是通过DUSP家族成员进行的有待进一步探讨。
综上所述,本研究结果表明,BMP-4在低浓度时具有抑制HUVEC的增殖、迁移和成血管,然而随着BMP-4浓度的升高,这种抑制作用逐渐减弱,并有恢复至正常水平的趋势,BMP-4对于HUVEC体外成血管能力的影响可能是通过ERK/MAPK发挥作用的。
[1]Date T,Doiguchi Y,Nobuta M,et al.Bone morphogenetic protein-2 induces differentiation of multipotent C3H10T1/2 cells into osteoblasts,chondrocytes,and adipocytes in vivo and in vitro[J].J Orthop Sci,2004,9:503 -508.
[2]Xiao YT,Xiang LX,Shao JZ.Bone morphogenetic protein[J].Biochem Biophys Res Commun,2007,362:550 -553.
[3]Wozney JM,Rosen V,Celeste AJ,et al.Novel regulators of bone formation:molecular clones and activities[J].Science,1988,242:1528-1534.
[4]Carano RA,Filvaroff EH.Angiogenesis and bone repair[J].Drug Discov Today,2003,8:980-989.
[5]Winnier G,Blessing M,Labosky PA,et al.Bone morphogenetic protein-4 is required for mesoderm formation and patterning in the mouse[J].Genes Dev,1995,9:2105 -2116.
[6]Lechleider RJ,Ryan JL,Garrett L,et al.Targeted mutagenesis of Smad1 reveals an essential role in chorioallantoic fusion[J].Dev Biol,2001,240:157 -167.
[7]Suzuki Y,Montagne K,Nishihara A,et al.BMPs promote proliferation and migration of endothelial cells via stimulation of VEGF-A/VEGFR2 and angiopoietin-1/Tie2 signalling[J].J Biochem,2008,143:199-206.
[8]Crampton SP,Davis J,Hughes CC.Isolation of human umbilical vein endothelial cells(HUVEC)[J].J Vis Exp,2007:183.
[9]Csiszar A,Labinskyy N,Jo H,et al.Differential proinflammatory and prooxidant effects of bone morphogenetic protein-4 in coronary and pulmonary arterial endothelial cells[J].Am J Physiol Heart Circ Physiol,2008,295:H569-577.
[10]Finkenzeller G,Hager S,Stark GB.Effects of bone morphogenetic protein 2 on human umbilical vein endothelial cells[J].Microvasc Res,2012,84:81 -85.
[11]Li Z,Chen YG.Fine-tune of intrinsic ERK activity by extrinsic BMP signaling in mouse embryonic stem cells[J].Protein Cell,2012,3:401 -404.
[12] Chiu CY,Kuo KK,Kuo TL,et al.The activation of MEK/ERK signaling pathway by bone morphogenetic protein 4 to increase hepatocellular carcinoma cell proliferation and migration [J].Mol Cancer Res,2012,10:415-427.
[13]Li Z,Fei T,Zhang J,et al.BMP4 Signaling Acts via dual-specificity phosphatase 9 to control ERK activity in mouse embryonic stem cells[J].Cell Stem Cell,2012,10:171-182.
