四年生鲜人参遗传毒性及大鼠长期喂养实验
2013-09-14于德伟陈文学
杨 铭 于德伟 林 贺 陈文学 杨 明
1.吉林省中医药科学院,吉林长春 130021;2.长春中医药大学,吉林长春 130117
人参是五加科植物人参(Panax Ginseng C.A.Meyer)的根,其新鲜根称为鲜人参或水参,鲜人参可被加工成为生晒参、红参、糖参、保鲜参、活性参、大力参等[1]。本文根据《新资源食品安全评价规程》、《GB 15193.1-2003 食品安全性毒理学评价程序》的规程要求,对四年生鲜人参进行毒理学安全性初步研究,提供其食用的安全性依据。
1 材料与方法
1.1 供试品
四年生鲜人参(含水量67.19%)产于吉林集安,中国农业科学院左家特产研究所提供,实验前粉碎以蒸馏水配制不同浓度给药。
1.2 动物
Wistar 大鼠,清洁级,体重 130~140 g,雌雄各半;昆明种小鼠,体重18~22 g,雌雄各半或雄性。均购自吉林大学实验动物中心。动物合格证号:SCXK(吉)-2003-0001。动物饲养条件:温度18~22℃,湿度50%~70%。
1.3 菌株
TA97、TA98、TA100、TA102 均购自华西医科大学公共卫生学院检测中心。
1.4 仪器
动物血液分析仪,型号:HEMAVET950,美国产品;OLYMPUS 显微镜,型号CH-20,日本产品;电解质分析仪,型号:E-555,南京产品;单通道血凝仪,型号:BT-M1,德国产品;全自动生化分析仪,型号:ALCYON-300,美国雅培公司产品。
1.5 实验方法[2-4]
1.5.1 急性毒性试验 取Wistar 大鼠40 只,雌雄各半,体重130~140 g,根据体重随机均分两组(对照组及四年生鲜人参组),禁食16 h,于24 h 内灌胃给药四年生鲜人参3次,累计给药量18.6 g/kg 体重,对照组大鼠灌胃等体积蒸馏水。给药后立刻对大鼠的外观体征、行为、活动、精神状态、饮食、体重、粪便、腺体分泌,以及有无其他中毒症状和死亡等情况进行观察,连续观察14 d。
1.5.2 Ames 试验 四年生鲜人参受试品设4000、1000、200、40、8μg/皿,共 5 组;另设溶剂对照组(蒸馏水)、S9 对照组(10%S9 混合液);阳性对照组分别为敌克松(Dexon,50 μg/皿)、丝 裂 霉 素 C(MMC,20 μg/皿 )、叠 氮 钠 (NaN3,20 μg/皿 )、1.8-二羟基蒽醌(50 μg/皿)和 2-氨基芴(2-AF,20 μg/皿)。采用标准平板掺入法试验,37℃培养箱孵育48 h,计算回变菌落数。实验在同条件下3个平行样重复2次。
1.5.3 小鼠骨髓细胞微核试验 取18~20 g 小鼠,雌雄各半。四年生鲜人参受试品设4.0、2.0、1.0 g/kg 体重3个剂量组,溶剂对照为蒸馏水,阳性对照为环磷酰胺 (40 mg/kg 体重),小鼠灌胃给药2次(环磷酰胺组为1次),间隔24 h,末次给药后6 h(环磷酰胺组为24 h)颈椎脱臼处死动物,取股骨骨髓细胞加小牛血清混匀后推片,甲醛固定,吉姆萨染色晾干。观察计数:每只鼠计数1000个骨髓嗜多染红细胞(PCE),观察含微核(MN)的 PCE 数(1个细胞内可出现1个或多个微核,但都按1个细胞计),计算其微核出现率(MNF),以‰表示。并且计数200个细胞中PCE/正染红细胞(NCE)的比值。
1.5.4 小鼠精子畸形试验 雄性小鼠20~22 g,按体重均分5组,每组5 只。分别为四年生鲜人参4.0、2.0、1.0 g/kg 体重剂量组,环磷酰胺组(60 mg/kg 体重),蒸馏水组。每日灌胃给药1次,连续5 d。于首次给药后第35日颈椎脱臼处死动物,取精子,涂片、固定、染色、镜检。
1.5.5 大鼠30 d 喂养试验 取Wistar 大鼠80 只,根据体重随机均分四组,每组动物20 只,雌雄各半。分别为正常对照组,四年生鲜人参8.0、4.0、2.0 g/kg 体重剂量组,大鼠于每日上午8 时和下午4 时各灌胃给药1次,连续给药30 d。停药后,观察2周恢复期。试验期间观察大鼠的外观体征、行为活动,同时称量大鼠体重、摄食量、饮水量,测量体温。分别于给药30 d 和2周恢复期结束后,各组处死10 只动物,雌雄各半。大鼠禁食12 h,经腹主动脉取血,进行血液学[包括红细胞(RBC)、血红蛋白(Hb)、血细胞比容(HCT)、红细胞平均容量(MCV)、红细胞平均血红蛋白量(MCH)、红细胞平均血红蛋白浓度(MCHC)、网织红细胞(RET)、白细胞(WBC)、白细胞分类(G、L、M)、凝血酶原时间(PT)、部分凝血活酶时间 (APTT)]和血液生化学 [谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、尿素(Urea)、总蛋白(TP)、白蛋白(ALB)、谷胺酸(GLU)、总胆红素(TBIL)、胆固醇(CHOL)、三酰甘油(TG)]检测,同时肉眼观察主要脏器的外观形态、表面色泽、轮廓体积、所处位置是否正常,摘取主要脏器(心、肝、脾、肺、肾、肾上腺、胸腺、脑、睾丸、附睾、子宫、卵巢)称量重量计算脏器系数,并同胰腺、骨髓、膀胱、淋巴结、胃、十二指肠、回肠、结肠、前列腺、视神经进行病理组织学检查。
1.6 统计学方法
采用统计软件SPSS 13.0 对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,采用方差分析,LSD-t检验。计数资料以率表示,采用 χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 急性毒性试验
四年生鲜人参供试品以最大给药浓度和给药体积灌胃给予大鼠,观察14 d 内大鼠状态。可见动物行为活动正常,被毛光泽、粪便、饮食、体重增长等指标均正常,未出现其它明显中毒症状和死亡。观察14 d 后处死动物尸解,主要脏器未见外观形态、表面色泽、轮廓体积、所处位置等出现异常。表明四年生鲜人参大鼠的最大耐受剂量大于18.6 g/kg 体重,在此剂量下无急性毒性作用。
2.2 Ames 试验
四年生鲜人参供试品对 TA97、TA98、TA100、TA102 标准菌株,在有无S9 混合液条件下均未引起基因组碱基置换或移码突变,于自发回变组相同(P>0.05),而与阳性对照组比较,差异则均有高度统计学意义(P<0.01)。结果表明四年生鲜人参Ames 试验结果为阴性。见表1。
2.3 小鼠骨髓细胞微核试验
四年生鲜人参4.0、2.0、1.0 g/kg 体重3个剂量组小鼠骨髓细胞微核发生率同阴性对照组相同(P>0.05),而与阳性对照组比较,差异则有高度统计学意义(P<0.01)。结果表明四年生鲜人参对小鼠骨髓嗜多染红细胞无诱发微核作用。见表2。
2.4 小鼠精子畸形试验
四年生鲜人参4.0、2.0、1.0 g/kg 体重3个剂量组出现小鼠精子畸形率和阴性对照组比较,差异均无统计学意义(P>0.05),与阳性对照药比较,差异有高度统计学意义(P<0.01)。表明四年生鲜人参未引起小鼠精子明显畸形。见表3。
2.5 大鼠30 d 喂养试验
2.5.1 对大鼠一般状态的影响 大鼠连续灌胃给予四年生鲜人参30 d 及停药观察2周,给药各组动物的外观体征、行为活动正常,精神状态良好,饮食、粪便正常。与对照组动物比较无异常改变。
表1-1 四年生鲜人参供试品的Ames 试验结果(±s,n=6)

表1-1 四年生鲜人参供试品的Ames 试验结果(±s,n=6)
注:“-”代表无数据
组别 剂量(μg/皿)TA97-S9(cfu) +S9(cfu)TA98-S9(cfu) +S9(cfu)四年生鲜人参四年生鲜人参四年生鲜人参四年生鲜人参四年生鲜人参敌克松2-氨基芴溶剂对照S9 对照自发回变4000 1000 200 40 8 50 20蒸馏水10%S9 混合液-116.7±3.8 115.3±5.4 114.3±11.4 112.3±8.6 116.3±8.2 1360.5±198.2-123.0±9.1-136.5±7.8 131.5±16.2 123.2±11.3 130.3±14.0 124.5±10.4-923.3±49.8 127.0±14.6 130.2±11.3 31.5±1.7 33.2±3.0 28.8±4.7 33.5±4.0 35.5±5.0 241.0±9.4-37.7±2.4-33.8±2.1 37.2±2.1 36.3±3.8 36.0±2.5 37.5±4.5-1479.7±71.8 40.2±1.9 38.8±1.8 121.8±6.5 35.5±1.8
表1-2 四年生鲜人参供试品的Ames 试验结果(±s,n=6)
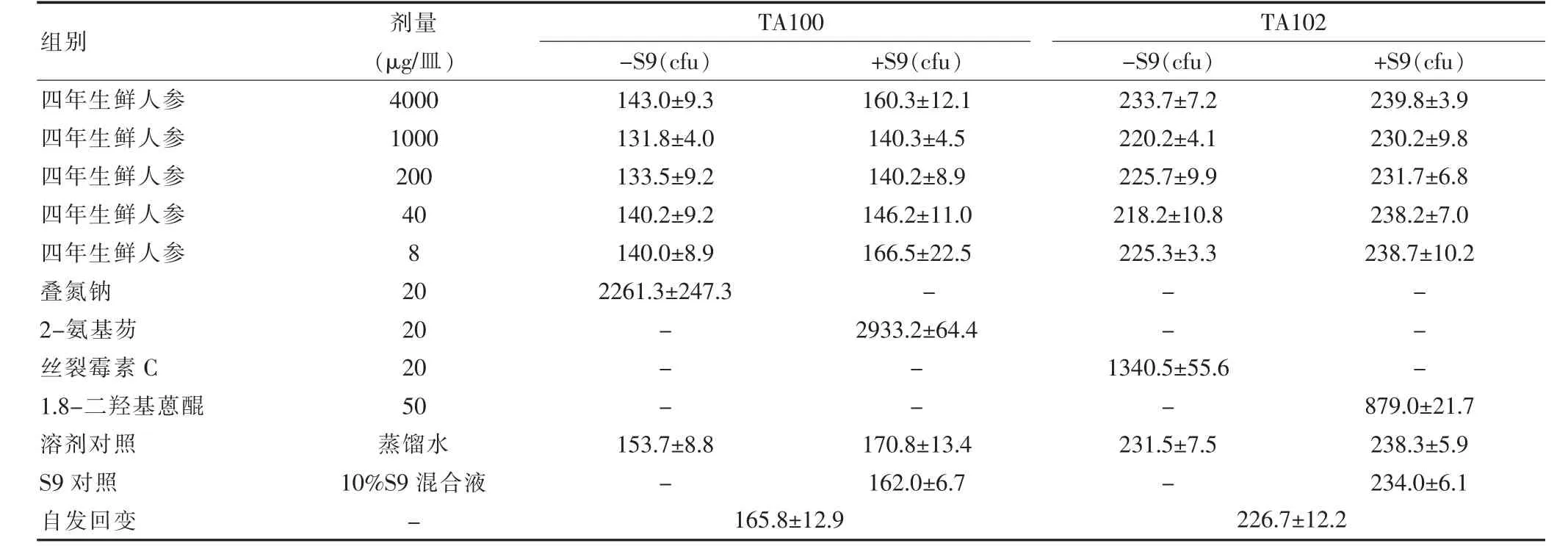
表1-2 四年生鲜人参供试品的Ames 试验结果(±s,n=6)
注:“-”代表无数据
组别 剂量(μg/皿)TA100-S9(cfu) +S9(cfu)TA102-S9(cfu) +S9(cfu)四年生鲜人参四年生鲜人参四年生鲜人参四年生鲜人参四年生鲜人参叠氮钠2-氨基芴丝裂霉素C 1.8-二羟基蒽醌溶剂对照S9 对照自发回变4000 1000 200 40 8 20 20 20 50蒸馏水10%S9 混合液-143.0±9.3 131.8±4.0 133.5±9.2 140.2±9.2 140.0±8.9 2261.3±247.3 233.7±7.2 220.2±4.1 225.7±9.9 218.2±10.8 225.3±3.3 239.8±3.9 230.2±9.8 231.7±6.8 238.2±7.0 238.7±10.2---160.3±12.1 140.3±4.5 140.2±8.9 146.2±11.0 166.5±22.5-2933.2±64.4-------153.7±8.8-170.8±13.4 162.0±6.7 1340.5±55.6-231.5±7.5-879.0±21.7 238.3±5.9 234.0±6.1 165.8±12.9 226.7±12.2
表2 四年生鲜人参对小鼠骨髓细胞微核发生率的影响(±s)

表2 四年生鲜人参对小鼠骨髓细胞微核发生率的影响(±s)
注:与阴性对照组比较,*P<0.01;PCE:多染红细胞;NCE:正染红细胞
表四年生鲜人参对小鼠骨髓细胞微核发生率的影响(组别 剂量(g/kg)小鼠♀/♂PCE♀/♂MN♀/♂MNF(‰)♀/♂PCE/NCE阴性对照组(蒸馏水)四年生鲜人参四年生鲜人参四年生鲜人参环磷酰胺(mg/kg 体重)-4.0 2.0 1.0 40 5/5 5/5 5/5 5/5 5/5 5000/5000 5000/5000 5000/5000 5000/5000 5000/5000 12/13 14/16 12/13 9/14 56/57 2.4±1.1/2.6±1.1 2.8±0.8/3.2±0.8 2.4±0.5/2.6±0.8 1.8±0.8/2.8±1.3 11.2±1.1*/11.4±3.5*1.026±0.137 1.069±0.123 1.022±0.158 0.922±0.062 0.886±0.038
表3 四年生鲜人参对小鼠精子发生率的影响(±s)

表3 四年生鲜人参对小鼠精子发生率的影响(±s)
注:与阴性对照组比较,*P<0.01
组别 剂量(g/kg)雄性小鼠(只)受检精子数(个)精子畸形数(个)精子畸形率(%)阴性对照组(蒸馏水)四年生鲜人参四年生鲜人参四年生鲜人参环磷酰胺(mg/kg 体重)-500018.2±3.11.82 4.0 2.0 1.0 60 5 5555 5000 5000 5000 5000 17.2±3.7 18.2±6.3 14.6±5.6 129.2±13.3*1.72 1.82 1.46 12.92
2.5.2 对大鼠体重、体温、摄食量及饮水量的影响 连续灌胃给予四年生鲜人参30 d 及停药观察2周,给药各组大鼠与正常大鼠比较体温波动正常、摄食量、饮水量和体重变化均未见异常。
2.5.3 大鼠血液学及血液生化学检测结果 连续灌服四年生鲜人参30 d 和2周恢复期观察结束后,四年生鲜人参各剂量组大鼠的血液学及血液生化学指标与对照组比均无明显差异。
2.5.4 主要脏器系数及病理组织学检查结果 大鼠连续灌胃给予四年生鲜人参30 d 和停药观察2周后,分别处死动物进行系统解剖,可见四年生鲜人参各剂量组动物的主要脏器,心、肝、脾、肺、肾、肾上腺、胸腺、脑、睾丸、附睾、子宫、卵巢等外观、形态、位置正常,表面光滑,色泽正常,体积无肿大和缩小。称量主要脏器计算脏器系数,各给药组与对照组比较均无显著性差异。四年生鲜人参高剂量组和对照组病理组织学检查均未出现病理改变。
3 讨论
人参被誉为“百草之王”,是驰名中外的名贵中药材。我国是世界上最早应用人参并有文字记载的国家。东汉时期《神农本草经》将其列为上品,认为人参“味甘微寒,主补五脏、安精神、止惊悸、除邪气、开心益智、久服轻身延年“[5]。现代药理学研究认为人参具有广泛的药理作用,能加强机体适应性,增强机体免疫力,对心血管系统有调节和保护作用,还有纠正脂代谢障碍和调节血糖等作用。目前我国是世界最大的人参生产国,而在人参作为保健滋补食品使用方面我们却落后于韩国及东南亚等地。由于在我国对人参食用安全性存在争议,认为滥用有毒副作用,人参只能用于药品而不能用于食品。因此,不仅限制了人参生产的经济发展,同时也制约了人参保健食品的开发利用。
近年人参安全性研究显示人参粉小鼠最大耐受量(MTD)分别为 15.2(雌)、30.5(雄)g/kg 体重,遗传毒性试验为阴性[6];以4.0、6.0、8.0 g/kg 体重剂量长期喂食大鼠,对大鼠血液学、肝肾功能、电解质、脂代谢,未见明显影响[7-10]。
本文主要针对四年生鲜人参进行毒理安全性研究,其研究结果表明,四年生鲜人参大鼠最大耐受剂量大于18.6 g/kg体重;小鼠骨髓微核试验、小鼠精子畸形试验、Ames 试验结果均为阴性,提示四年生鲜人参无遗传毒性;四年生鲜人参大鼠30 d 喂养试验,大鼠外观体征、行为活动、腺体分泌、呼吸、饮食等一般状态观察结果正常,摄食、饮水、体重增长情况良好,给药30 d 和恢复期结束血液学、血液生化学指标正常,尸解、主要脏器系数及病理学检查未见明显病理改变,表明其无明显毒性作用。上述试验结果为四年生鲜人参的食用安全性提供了毒理学依据。
[1]赵晋红.人参的加工炮制及药理研究进展[J].山西中医,2012,28(3):54-55.
[2]卫生部.食品安全性毒理学评价程序和方法[S].2003.
[3]卫生部.新资源食品安全评价规程[S].2007.
[4]国家新药审评中心.药物遗传毒性研究技术指导原则[S].2007.
[5]王知成.浅谈人参[J].医学信息,2011,24(10):208-209.
[6]孙兰,高峰,吴晓刚,等.人参粉剂安全及遗传毒性研究[J].职业与健康,2011,27(22):2525-2527.
[7]吴晓刚,高峰,张琨,等.吉林人参亚慢性毒性试验中大鼠血液学变化的研究[J].中国预防医学杂志,2012,13(1):36-38.
[8]高峰,张琨,宋昕恬,等.长期喂养大鼠人参粉对其肝肾功能影响研究[J].中国卫生工程学,2011,10(5):364-368.
[9]谷建君.人参长期喂养实验对大鼠血清电解质的影响[J].中国民族民间医药,2011,24(2):47-49.
[10]张琨,高峰,张晶,等.长期喂养大鼠人参粉对其脂代谢影响研究[J].职业与健康,2011,27(18):2094-2095.
