脱氧核苷酸钠抗人肾脏细胞衰老的分子机制
2013-09-13李玉森霍志刚山东大学附属省立医院肾内科山东济南25002
郭 齐 李玉森 陈 强 霍志刚 (山东大学附属省立医院肾内科,山东 济南 25002)
肾脏缺血-再灌注时,肾小管、肾小球等相关脏器细胞均存在缺氧环境,长时间的缺氧,可能诱发肾脏细胞的衰老及凋亡,现有研究证实,衰老、凋亡的重要途径可能与JAK2-STAT的激活有关〔1〕。脏器细胞的凋亡,衰老,导致肾脏功能逐步下降,出现蛋白尿、血尿、BUN、SCr增加,最终发展为肾脏衰竭。流行病学调查〔2〕显示肾衰竭患者患病率逐渐增加,至2012年我国已有近400万肾衰竭患者,因此其已成为人类最主要的公众健康问题之一,肾衰竭患者生活质量低下,长期透析不仅增加社会或个人的医疗负担,另外其心血管并发事件及肾功能持续下降最终使得患者死亡。因此肾功能失代偿期之前的缺血、缺氧所导致的肾脏细胞的衰老、凋亡是肾病治疗中的关键一步。现已证实脱氧核苷酸具有一定的抗衰老、抗凋亡作用〔3〕,可能对肾脏细胞具有一定的保护作用。本研究采用体内、体外实验结合的方式,探究脱氧核苷酸的抗衰老、抗凋亡作用,并试图揭示脱氧核苷酸保护肾脏的可能分子机制。
1 材料与方法
1.1 仪器与试剂 SDS-PAGE、(Therom,美国);光学显微镜及取图系统(奥林巴斯,美国),低温微量离心机(Eppendor公司,德国);酶标仪(岛津,日本);液氮罐及低温冰箱(Thermo公司,美国),小型流式细胞仪10 cm(BD,美国)。IMDM 培养基(青霉素 100 U/ml,链霉素100 μg/ml),标准胎牛血清,胰酶(美国Hyclone公司);二甲基亚矾(DMSO);兔抗人Bax多克隆抗体,鼠抗人Bcl-2单克隆抗体,辣根过氧化酶标记的山羊抗小鼠IG,辣根过氧化酶标记的山羊抗兔IG,细胞凋亡检测试剂盒,免疫组化试剂盒(Sigma);STAT1及 STAT3单克隆抗体,pSTAT1及pSTAT3单克隆抗,叔丁基过氧化氢;TRITC标记二抗;内参山羊抗人β-actin多克隆抗体,辣根过氧化物酶标记二抗(美国Sigma公司)。
1.2 实验方法
1.2.1 体外实验 (1)MTT法〔4〕、JAK2-STAT、bcl-2/bax相关蛋白检测〔5〕:近曲肾小管上皮细胞株(HK-2)用含10% 小牛血清的IMDM培养基,37℃,5%CO2培养,0.25%胰蛋白酶消化传代。细胞生成面积为80% ~90%时,0.25%胰蛋白酶消化,PBS冲洗,调节浓度为2×105/ml,并接种于96孔平底培养板,2×104/孔。分为3组,每组4复孔,即正常对照组,脱氧核苷酸组,模型组。其中脱氧核苷酸组及模型组各孔均加入含有一定浓度CoCl2的细胞培养液,同时脱氧核苷酸组加入20 μg/ml脱氧核苷钠缺氧培育24 h,加入50 μl完全培养液和10 μl浓度为5 mg/ml的MTT溶液共同孵育4 h。吸去上清液,每孔加入150 μl DMSO,室温下,将96孔板置于微振器上振荡 10 min。在酶联检测仪上测波长570 nm光密度(OD)值,并计算缺氧细胞生长细胞抑制率。同时吸去细胞培养液,用4 ml预冷PBS,磷酸酶抑制剂冲洗,弃之再加入1 ml预冷PBS磷酸酶抑制剂,并转移知预冷的1 mlEppendorf管中,并准备电泳成像,主要步骤包括提取核蛋白、应用BCA蛋白浓度测定试剂盒测定蛋白浓度,配制SDS-PAGE凝胶的配制、电泳、转膜、免疫反应、化学发光、显影等。(2)细胞凋亡试验〔6〕:对数生长期细胞接种每孔1×106/ml接种于无菌6孔板中,2 ml/孔,培养24 h,随机分为三组,分别进行相应的干预措施,继续培养48 h、消化,制成细胞悬液,收集于 15 ml离心管,4℃预冷的 PBS冲洗 3次,1 000 r/min离心10 min,弃上清,缓冲液调节浓度为1×106/ml,取100 μl置于5 ml流式管,加入 sulFITC-AnnexinV 和 sulPl双标记,混匀温育15 min,继续加入400 μl×Binding缓冲液,采用BD小型流式细胞仪检测进行定量分析,并采用Multicyder for windows分析软件行双参数分析。
1.2.2 动物实验〔7〕30只雄性SD大鼠,随机分为三组,假手术组,脱氧核苷酸组,模型组,每组各10只。脱氧核苷酸组及模型组大鼠均采用5% 水合氯醛经腹腔注射麻醉大鼠,选取大鼠背部左侧作为手术部位,切开并暴露左肾,钝性分离肾脏包膜,于左肾的上下极各1/3切除,止血,结扎,缝合伤口,给予正常饮水、饮食。术后10 d,采用同样手术方法,结扎肾蒂,摘除右肾,脱氧核苷酸组随后每日静脉推注50 mg脱氧核苷酸钠,模型组推注生理盐水。假手术组除不切除或摘除肾外,处理方式与另外两组相似,术后推注0.9%生理盐水,于第2次手术,30 d后处死动物,处死前1 d,大鼠置于代谢笼中(禁食,不禁水),收集24 h尿液测尿液检查尿蛋白,处死时,取血,检测血尿素氮 (BUN)、肌酐(SCr)。并取左肾组织,置于4%中性福尔马林溶液中固定,并采用石蜡包埋,制作病理切片并进行免疫组化检测。
1.3 统计学处理 采用SPSS17.0医学软件包分析,计量数值均采用±s表示,行方差分析,若方差齐性则采用t检验,若方差不齐性采用秩和检验。
2 结果
2.1 细胞生长抑制率 MTT法检测显示正常对照组无细胞生长抑制发生,模型组抑制率达到40.2% ±11.4%,脱氧核苷酸组为13.46% ±7.7%,三组间显著差异(P<0.05)。见图1。
2.2 脱氧核苷酸对细胞凋亡的影响 图2可见,正常对照组凋亡率仅有(6.56±1.09)%,而模型组凋亡率高达(26.4±2.58)%,脱氧核苷酸干预组凋亡率为(10.8±1.44)%。三组差异显著(P<0.05)。正常对照组Bcl-2蛋白表达的积分光密度值(IOD)为(31.97±4.29),而脱氧核苷酸组(24.66±4.59)与模型组(14.08±2.8)表达均显著下降,模型组下降更明显(P<0.05)。另外Bax蛋白,正常对照组表达(29.68±3.30)则显著低于模型组(109.83±14.3)及脱氧核苷酸组(44.69±6.71),模型组增高更明显(P<0.05)。
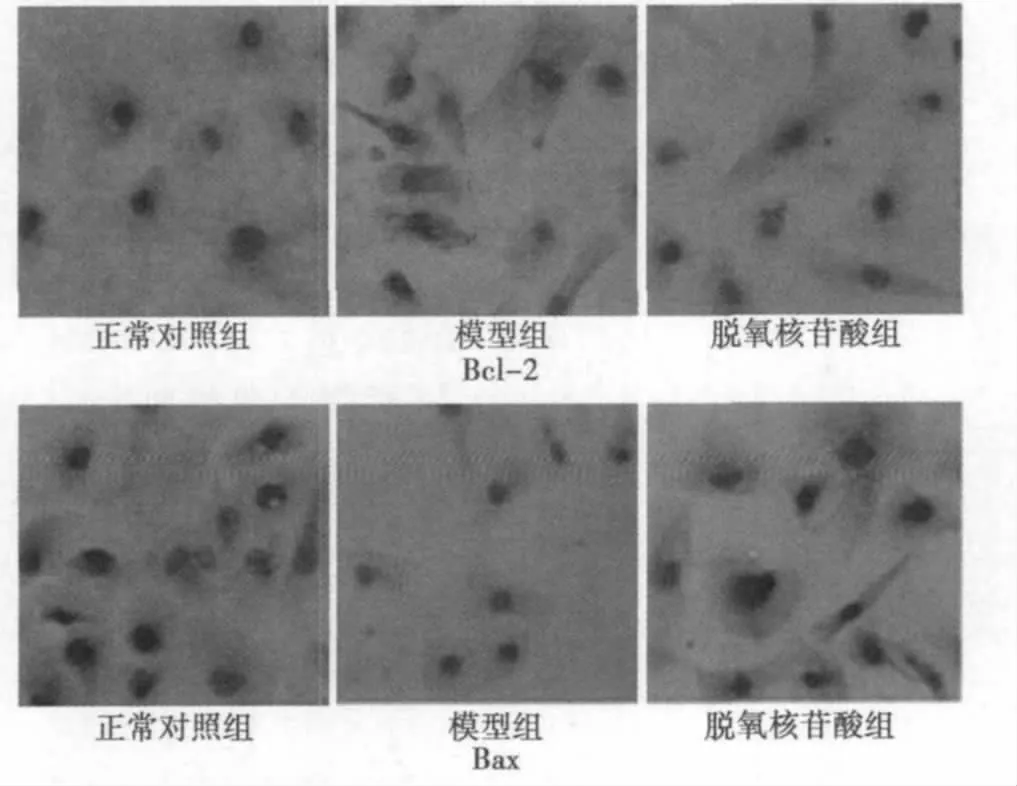
图2 Bcl-2蛋白及Bax蛋白表达情况(×400)
2.3 脱氧核苷酸对JAK2/STAT信号通路的影响 缺氧处理后的 STAT1,P-STAT1,STAT3,P-STAT-3蛋白的表达均较正常对照组有显著地增强,细胞衰老明显增加。脱氧核苷酸组处理后,各蛋白表达均有一定程度降低,见图3。
2.4 组织病理学观察 图4、图5可见,术后取肾纵切面行HE染色,显示模型组纤维组织增生,肾小管萎缩,间质性炎症,上皮细胞呈空泡状,脱氧核苷酸组虽然有部分增生,但较为轻微。正常组则无显著改变。免疫组化检测显示模型组p-STAT1及p-STAT3蛋白表达显著增加,脱氧核苷酸组有一定程度的增加,但是增加并不明显,正常组则表达程度很低。
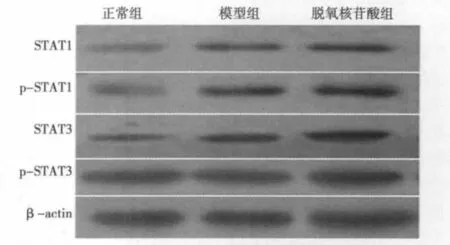
图3 JAK2/STAT信号通路相关蛋白表达情况
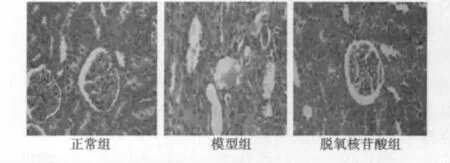
图4 肾脏的HE染色(×400)

图5 肾脏的免疫组化p-STAT1及p-STAT3表达(×400)
2.5 大鼠一般性指标 术后大鼠体重增长较慢,显著低于假手术组,脱氧核苷酸的干预有助于体重的增加。另外肾摘除术后尿蛋白,BUN,SCr水平均显著增加,脱氧核苷酸的干预有利于降低尿蛋白,BUN,SCr水平,保护肾功能,见表2。
表2 三组大鼠一般性指标比较(±s)

表2 三组大鼠一般性指标比较(±s)
组别 体重(g)尿蛋白(mg/24 h)BUN(mmol/L)SCr(μmol/L)446.6±14.2 6.2±2.4 6.51±0.7 37.35±6.38模型组 317.4±12.8 116.5±22.4 16.5±1.6 193.33±18.05脱氧核苷酸组假手术组366.5±23.8 42.5±21.4 12.6±1.4 121.74±10.3
3 讨论
JAK2-STAT是凋亡、衰老的重要信号通路。研究显示STAT的激活,可以激发下游途径如casepase-3蛋白的活化,bcl-2/bax蛋白表达,促进细胞发生凋亡〔8〕。另外JAK2-STAT亦是细胞衰老的重要途径,有研究显示人肾小球系膜细胞衰老过程中STAT1,STAT3均过度磷酸化〔9〕,尤其是Ang-Ⅱ的生成,可以进一步导致JAK2-STAT信号通路的活化,促进细胞的衰老,而采用Ang-Ⅱ受体抑制剂,则可以阻止STAT1,STAT3的磷酸化,细胞的衰老得到一定的控制〔10〕。脱氧核苷酸是细胞增殖和传代所需要的遗传底物,可以通过促进细胞生长,增殖从而促进损伤脏器的修复,可能有助于减少细胞的凋亡〔11〕。另外脱氧核苷酸具有稳定细胞膜的功能,通过促进细胞膜中蛋白质的合成,维持细胞的正常形态,减缓衰老所造成的细胞萎缩〔12〕。因此我们猜想脱氧核苷酸对缺血、缺氧的肾脏细胞可能有较好的保护作用。但是其抗衰老、抗凋亡的机制,我们尚不明确。本研究提示脱氧核苷酸减少了肾小管上皮细胞凋亡,促进肾小管上皮细胞的生长,采用Western印迹技术检测相关蛋白显示脱氧核苷酸促进Bcl-2蛋白的合成、抑制Bax蛋白的表达,同时阻止STAT1,STAT3磷酸化活化。因此我们基本可以判断脱氧核苷酸阻止了JAk2-STAT信号通路的表达。另外整体动物实验再次验证了我们的想法,给药9 w后5/6肾切除大鼠体重有显著改善,尿蛋白,BUN,Cr水平较模型组更低。HE染色也显示,脱氧核苷酸具有一定的细胞修复作用,可以减少大鼠肾脏的纤维化病变,空泡性病变,减少炎症。因此脱氧核苷酸对肾衰大鼠具有肾功能的保护作用。进一步采用免疫组化检测显示脱氧核苷酸减少了P-STAT1,P-STAT3表达。因此本研究为脱氧核苷酸治疗肾炎、肾功能衰竭提供了理论和实验依据。但是肾功能损伤的机制极其复杂,涉及的因素可能包括炎症、氧化应激、ECM过度沉积等,机制尚未完全阐明〔13〕,本研究,缺乏脱氧核苷酸对氧化应激、炎症因子表达的实验研究,尚不能确定其是否能清除肾衰大鼠体内的氧自由基及炎症性物质,因此在临床上脱氧核苷酸的效果尚不能估测,有待于更进一步研究。
1 Hassoun HT,Lie ML,Grigoryev DN,et al.Kidney ischemia-reperfusion injury induces caspase-dependent pulmonary apoptosis〔J〕.Am J Physiol Renal Physiol,2009;97(1):125-37.
2 黄燕萍,王伟铭,裴道灵.上海城市社区成年人群慢性肾脏病流行病学研究〔J〕.中华肾脏病杂志,2009;12(4):33-6.
3 Rakyan VK,Down TA,Maslau S.Human aging-associated DNA hypermethylation occurs preferentially at bivalent chromatin domains〔J〕.Genome Res,2010;20(4):434-9.
4 Sylvester PW.Optimization of the tetrazolium dye(MTT)colorimetric assay for cellular growth and Viability〔J〕.Methods Mol Biol,2011;716(1):157-68.
5 Meier C,Hoeller S,Bourgau C.Recurrent numerical aberrations of JAK2 and deregulation of the JAK2-STAT cascade in lymphomas〔J〕.Mol Pathol,2009;22(3):476-87.
6 Diaz T,Navarro A,Ferrer G,et al.Lestaurtinib inhibition of the JAK/STAT signaling pathway in Hodgkin lymphoma inhibits proliferation and induces apoptosis〔J〕.PLoS One,2011;6(4):e18856.
7 Bowmer CJ,Collis MG,Yates MS.Effect of the adenosine antagonist 8-phenyltheophylline on glycerol-induced acute renal failure in the rat〔J〕.Br J Pharmacol,1986;8(1):205-12.
8 Wen SH,Li Y,Li C,et al.Ischemic postconditioning during reperfusion attenuates intestinal injury and mucosal cell apoptosis by inhibiting JAK/STAT signaling activation〔J〕.Shock,2012;38(4):411-9.
9 Neuwirt H,Eder IE,Puhr M,et al.SOCS-3 is downregulated in progressive CKD patients and regulates proliferation in human renal proximal tubulecells in a STAT1/3 independent manner〔J〕.Lab Invest,2013;93(1):123-34.
10 Kirabo A,Oh SP,Kasahara H,et al.Vascular smooth muscle Jak2 deletion prevents angiotensinⅡ-mediated neointima formation following injury in mice〔J〕.J Mol Cell Cardiol,2011;50(6):1026-34.
11 Kneuertz PJ,Maithel SK,Staley CA,et al.Chemotherapy-associated liver injury:impact on surgical management of colorectal cancer liver metastases〔J〕.Ann Surg Oncol,2011;18(1):181-90.
12 何 威,周佩军,沈周俊.新型的免疫佐剂:CpG寡聚脱氧核苷酸〔J〕.中国临床医学,2008;5(13):42-6.
13 Tögel F,Hu Z,Weiss K,et al.Administered mesenchymal stem cells protect against ischemic acute renal failure through differentiation-independent mechanisms〔J〕.Am J Physiol Renal Physiol,2005;289(1):31-42.
