白藜芦醇对大鼠缺血心肌的保护及对凋亡的抑制作用
2013-09-13何东伟刘新伟重庆医科大学附属第一医院麻醉科重庆400016
何东伟 刘新伟 庞 勇 刘 柳 (重庆医科大学附属第一医院麻醉科,重庆 400016)
缺血再灌注损伤研究中,预处理和后处理均和减轻心肌细胞凋亡有关,即与细胞内的Fas凋亡通路、线粒体凋亡通路等有关,但其确切的分子机制尚不清楚。白藜芦醇是一种抗自由基、抗氧化剂,能预防、治疗动脉粥样硬化等心血管疾病,有助于血液流通,还能增进血管内皮细胞的功能。在心肌缺血再灌注损伤过程中,心肌损伤的发生是多因素多途径的,阻断心肌损伤级联反应中的关键环节和抑制参与多信号途径的介质是防治心肌损伤和细胞凋亡的最有效方法。磷脂酰肌醇-3-激酶-丝氨酸/苏氨酸激酶(PI3K-Akt)信号通路是细胞内重要的信号转导通路,在对抗心肌缺血再灌注损伤、抑制细胞凋亡中发挥重要作用〔1〕。本研究观察白藜芦醇预处理对大鼠急性心肌缺血再灌注损伤的保护作用及对心肌细胞凋亡的影响与PI3KAkt信号通路的关系,探讨白藜芦醇保护缺血心肌的作用机制。
1 材料与方法
1.1 实验动物 健康成年雄性SD大鼠50只,体重220~250 g,由重庆医科大学实验动物中心提供。
1.2 主要药品、试剂、及仪器 白藜芦醇购自四川维克奇生物科技有限公司,渥曼青霉素、一氧化氮(NO)、一氧化氮合酶(NOS)检测试剂盒、原位细胞凋亡检测试剂盒、免疫组化及Wester抗体购自北京中杉金桥生物技术有限公司。动物人工呼吸机DH-40,浙江大学实验仪器厂产品,八导生理记录仪(日本:RM6000),日本光电公司产品。
1.3 研究方法
1.3.1 分组 将50只SD雄性大鼠,随机分为假手术组(SH组)、缺血再灌注组(I/R组)、白藜芦醇预处理组(Res组)、白藜芦醇预处理+渥曼青霉素组(Res+Wom组)、缺血再灌注+渥曼青霉素组(I/R+Wom组)五组,每组10只。
1.3.2 模型制备 SD健康大鼠术前禁食6 h,在1.55 mol/L乌拉坦5 mg/kg静脉麻醉,仰卧位固定大鼠,标准Ⅱ导联心电图监测,连接气管插管待开胸后连接人工呼吸机(潮气量20 ml/kg,频率50次/min)。在胸骨左缘0.5 cm处纵行切开第3~5肋,剪开心包,暴露心脏,结扎冠状动脉左前降支,同时将一根直径2 mm塑料管置于结扎线和冠状动脉之间,拉近结扎线使塑料管压迫引起冠脉闭塞,造成急性心肌缺血模型,观察心电图,以出现QRS波群高大增宽为结扎成功的标志。缺血45 min后,取出塑料管即再灌注,以QRS波群振幅逐渐回落为再灌注成功标志,进行再灌注120 min,假手术组的动物手术全过程与其他组相同,但只穿线不结扎冠脉〔2〕。
1.3.3 给药方法 (1)SH组:冠状动脉左前降支只穿线,不结扎,穿线时及第46分钟取下穿线时由舌静脉注入生理盐水1 ml;(2)I/R组:结扎左冠状动脉前降支45 min,造成急性心肌缺血模型,再灌注120 min,结扎时及再灌注前1 min由舌静脉注入生理盐水1 ml,余同SH组;(3)Res组:结扎左冠状动脉前降支45 min,造成急性心肌缺血模型,再灌注120 min,结扎时及再灌注前1 min由舌静脉注入白藜芦醇20 mg/kg,余同SH组;(4)Wom+Res组:结扎左冠状动脉前降支45 min,造成急性心肌缺血模型,再灌注120 min,结扎时及再灌注前1 min由舌静脉注入白藜芦醇20 mg/kg及渥曼青霉素,余同SH组;(5)Wom+I/R组:结扎左冠状动脉前降支45 min,造成急性心肌缺血模型,再灌注120 min,结扎时及再灌注前1 min由舌静脉注入1 ml生理盐水及渥曼青霉素,余同SH组。
1.3.4 指标测定 (1)血流动力学监测:大鼠乌拉坦麻醉后,仰卧位固定,肝素化后(500 IU/kg)导管行右股动脉插管检测血压,经右侧颈总动脉插管至左心室,连接至八道生理记录仪,检测血流动力学各项指标,并重点记录左心室收缩压(LVSP)、左室舒张末期压(LVEDP)、左心室变化速率最大值(±dp/dtmax)在缺血前、缺血30、再灌注60、90、120 min几个时间点的变化情况,并同步监测肢体Ⅱ导联心电图。(2)心肌组织NOS、NO含量的测定:NOS测定采用催化L-Arg比色法;NO采用硝酸酶还原法测定。(3)心肌凋亡细胞原位检测:再灌注结束,迅速剪下心脏,置于冰的PBS液中洗净残血,分离左心室前壁,于4%的多聚甲醛固定12 h,石蜡包埋。应用TUNEL凋亡测试试剂盒严格按照试剂盒说明书操作。光镜下正常心肌细胞核呈蓝色,凋亡细胞核为深浅不一的棕褐色,每张切片于缺血部位随机选取8个高倍视野(400倍),分别计数凋亡心肌细胞数和心肌细胞总数并进行汇总,以凋亡心肌细胞数占心肌细胞总数的百分比作为凋亡指数(AI)。(4)心肌组织Bcl-2、Bax蛋白表达的免疫组化测定:每一标本取2个不同部位的切片各2张,采用链酶亲和素-生物素-酶复合物(SABC)免疫组化检测Bcl-2、Bax蛋白的表达。以细胞质着棕黄色为阳性,用计算机图像处理系统,每次随机选10个视野,测定细胞阳性染色的OD值与阳性细胞百分比,计算蛋白阳性表达指数(PEI),并计算Bax和Bcl-2的比值。(5)Western印迹测定Akt及p-Akt的蛋白表达:左心室心肌的缺血区,置于液氮中冻存后转至-70℃存放。称取冻存心肌样品0.1 mg,冰浴,加入500 μl组织裂解液,冰浴匀浆,4℃,12 000 r/min 离心 10 min,收集上清50 μl应用 BCA 蛋白定量试剂盒进行蛋白定量。余下上清加入4倍上样缓冲液,封闭后100℃水浴10 min,-70℃保存。以每个样品的总蛋白为20 μg上样,进行SDS-PAGE凝胶电泳(浓缩胶为5%,分离胶为12%,120 V/140 V),BioBad干转仪(≤90 mA)转膜至PVDF,2%脱脂奶粉封1h,一抗体封闭4℃过夜。PBST(PBS+Tween-20,1/1 000,v/v)洗膜15 min ×3 次;二抗(1∶4 000)37℃孵育1 h(羊抗兔),PBST漂洗后用增强化学发光法检测蛋白表达,凝胶成像系统成像,应用 UVP凝胶图像处理系统 Labwork4.6软件分析目的条带的灰度值。
1.4 统计学方法 采 用SPSS13.0统计软件进行分析,计量资料以±s表示,血流动力学采用重复测定的方差分析,其余指标采用单因素方差分析,两两比较采用SNK-q检验。
2 结果
2.1 白藜芦醇对LVSP、LVEDP、±dp/dtmax的影响 见表1。
2.2 各组心肌组织中的NOS、NO的含量 见表2。
表1 白藜芦醇对LVSP、LVEDP、±dp/dtmax水平的影响(±s ,n=10)

表1 白藜芦醇对LVSP、LVEDP、±dp/dtmax水平的影响(±s ,n=10)
与I/R组比较:1)P<0.05;与SH组比较:2)P<0.05;与Res组比较:3)P<0.05
SH组 I/R组 Res组 Res+Wom组 I/R+Wom组LVSP(mmHg)缺血前 114.44±7.65 113.55±7.05 114.17±6.82 113.97±6.59 112.98±6.65缺血30 min 113.27±7.43 100.71±7.192) 109.42±6.301)2) 101.05±5.782)3) 100.27±5.962)3)再灌注60 min 112.38±7.17 95.19±7.052) 104.75±6.751)2) 96.19±5.572)3) 94.16±5.152)3)再灌注90 min 111.75±7.01 91.34±6.972) 103.16±7.501)2) 92.65±5.672)3) 90.40±4.852)3)再灌注120 min 111.09±7.06 88.0±77.202) 101.53±8.191)2) 89.65±6.122)3) 86.99±4.732)3)LVEDP(mmHg)缺血前 4.44±1.58 4.52±1.36 4.09±1.80 4.15±1.13 4.42±1.35缺血30 min 4.81±1.60 9.47±1.382) 6.90±1.401)2) 8.71±1.292)3) 9.49±1.332)3)再灌注60 min 5.31±1.65 11.78±0.892) 7.96±1.771)2) 10.74±1.232)3) 12.17±1.422)3)再灌注90 min 5.60±1.59 12.72±0.922) 8.52±1.751)2) 11.66±1.262)3) 13.36±1.372)3)再灌注120 min 5.78±1.52 13.58±1.052) 9.05±1.671)2) 12.59±1.402)3) 14.51±1.042)3)dp/dtmax缺血前 4 192.46±303.35 4 165.52±256.17 4 104.45±270.47 4 208.00±217.06 4 081.65±276.152)3)缺血30 min 4 100.17±291.20 3 177.21±229.672) 3 665.85±266.251)2) 3 360.87±179.522)3) 3 084.91±274.312)3)再灌注60 min 4 049.17±293.54 2 887.65±266.352) 3 480.03±237.521)2) 3 074.13±141.452)3) 2 780.06±248.132)3)再灌注90 min 4 009.75±290.49 2 777.35±250.992) 3 422.85±231.991)2) 2 943.99±170.052)3) 2 681.93±259.872)3)再灌注120 m 3 960.75±280.06 2 672.18±247.502) 3 359.552±29.631)2) 2 842.00±143.622)3) 2 590.28±251.392)3)-dp/dtmax缺血前 -3 903.32±354.66 -3 843.79±292.58 -3 914.31±439.72 -3 933.29±362.35 -3 870.78±297.86缺血30 min -3 845.65±354.98 -3 061.15±279.702) -3 465.93±415.841)2)-3 098.50±242.432)3)-2 974.69±271.172)3)再灌注60 min -379 814±361.16 -2 925.75±289.912) -3 407.55±413.361)2)-2 974.37±247.842)3)-2 806.97±273.602)3)再灌注90 min -3 759.19±362.87 -2 847.64±302.352) -3 351.32±401.581)2)-2 902.35±240.762)3)-2 711.62±280.692)3)再灌注120 min -3 720.35±372.68 -2 775.87±300.852) -3 293.13±388.141)2)-2 831.53±248.162)3)-2 617.03±289.252)3)
表2 各组心肌组织中NOS、NO含量(±s ,n=10)

表2 各组心肌组织中NOS、NO含量(±s ,n=10)
与I/R组比较:1)P<0.05;与Res组比较:2)P<0.05
组别 NO(μmol/L) NOS(U/ml)SH组36.60±3.42 21.18±2.75 I/R组 18.38±3.90 11.35±2.00 Res组 51.49±5.321) 30.95±3.031)Res+Wom组 20.52±4.102) 12.64±2.452)I/R+Wom组 15.29±2.892) 10.32±1.982)
2.3 各组大鼠心肌细胞AI比较 TUNEL法染色阳性的心肌细胞具有形态变圆或不规则、与周围组织脱离、核固缩、染色质浓聚等典型的凋亡细胞的形态特征,主要位于心肌梗死区与非梗死区交界处,而在心肌梗死区和非梗死区内仅见极少数散在凋亡细胞。与I/R组〔(17.25±2.51)%〕相比,Res组AI显著降低〔(10.03±2.25)%,P<0.05〕;Wom+I/R组与 Res组相比,AI显著升高〔(17.70±2.32)%,P <0.05〕,Wom+I/R 组与I/R组相比 AI无显著差别(P>0.05)。Res+Wom组 AI(16.17±2.86)%较I/R组及Res组明显增高(P<0.05)。
2.4 各组心肌组织中Bcl-2、Bax蛋白表达 Bcl-2和Bax蛋白表达的部位与凋亡细胞十分相似。与I/R组相比,Res组Bcl-2蛋白表达显著升高(P<0.05),Bax/Bcl-2低于 I/R组(P<0.05),加入PI3K-Akt信号通路的特异性阻断剂渥曼青霉素后,与Res组相比,Bcl-2蛋白表达显著降低(P<0.05),Bax/Bcl-2高于Res组。Res+Wom组与I/R组及Wom组相比,Bcl-2蛋白的表达无显著差异(P>0.05),Bax/Bcl-2无显著差异(P>0.05)。见表3。
表3 各组心肌组织中Bcl-2、Bax蛋白表达(±s ,n=10)

表3 各组心肌组织中Bcl-2、Bax蛋白表达(±s ,n=10)
与I/R组比较:1)P<0.05;与SH组比较:2)P<0.05;与Res组比较:3)P<0.05
组别 Bcl-2 PEI(%)Bax PEI(%)Bax/Bcl-2 SH组14.1±1.8 15.4±3.1 1.5±0.5 I/R组 6.4±1.32) 14.7±2.52) 2.2±0.72)Res组 19.6±2.01)2) 13.5±2.71)2) 0.6±0.11)2)Res+Wom组 6.2±0.92)3) 13.6±2.6 2.1±0.52)3)I/R+Wom组 13.9±1.82)3) 15.2±2.82)3) 1.5±0.42)3)
2.5 各组总Akt及磷酸化Akt的表达量 各组总Akt差异无统计学意义(P>0.05);与I/R组比较,Res组P-Akt蛋白表达明显增加(P<0.05);与 Res组比较,Res+Wom组和I/R+Wom组P-Akt蛋白表达水平降低(P<0.05)。见表4,图1。
表4 各组大鼠T-Akt及p-Akt蛋白的相对表达量比较(±s ,n=10)
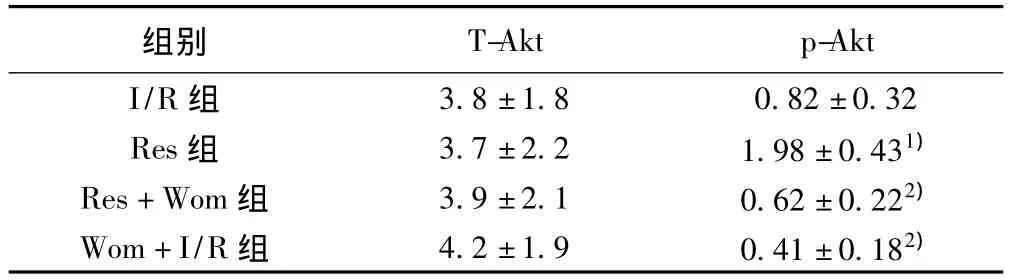
表4 各组大鼠T-Akt及p-Akt蛋白的相对表达量比较(±s ,n=10)
与I/R组比较:1)P<0.05;与Res组比较:2)P<0.05
组别T-Akt p-Akt I/R组3.8±1.8 0.82±0.32 Res组 3.7±2.2 1.98±0.431)Res+Wom组 3.9±2.1 0.62±0.222)Wom+I/R组 4.2±1.9 0.41±0.182)

图1 各组大鼠总AKT及P-AKT的表达
3 讨论
本实验表明:LVSP、+dp/dtmax是与心肌收缩强度相关的指标。+dp/dtmax是对心肌变力性干预十分敏感的指标,在一定程度上受心率及前后负荷的影响并与其呈正相关。-dp/dtmax是心室收缩后左室内压快速下降期的最大下降速率,反映左室的舒张功能,是心肌缺血早期心室舒张功能改变的敏感指标。若动脉压不变或降低,-dp/dtmax降低则表示左室舒张功能异常。当左室舒张功能不全或回心血量增加,使LVEDP增高。心肌缺血期及再灌注期,上述各项心功能指标均表现出异常:左心室峰压(LVSP)、左室等容期压力最大变化速率(±dp/dtmax)呈现进行性下降,左室舒张末压(LVEDP)不断升高,给予白藜芦醇后虽然不能使各项心功能指标恢复正常,但可以降低缺血后LVSP、±dp/dtmax的降低幅度;同时可以对抗LVEDP的升高,但是应用PI3K-Akt信号通路的特异性阻断剂后,白藜芦醇改善心功能的效果明显降低(P<0.05)。
研究发现,细胞凋亡是心肌缺血时心肌损伤的主要形式,心肌细胞的凋亡程度决定了心肌梗死面积的大小〔3〕。急性心肌梗死再灌注治疗,在梗死灶周围可见凋亡细胞的存在,因此抑制细胞凋亡,改善心肌细胞的功能状态对于防治心肌缺血再灌注损伤,促进细胞存活有重要意义。白藜芦醇预处理后,心肌组织中的NOS活性和NO含量上升,心肌细胞凋亡的数量显著下降。NO的信号内转导途径可以与细胞凋亡的信号传递通路相互联系,抑制 caspase-3裂解为 Bcl-2,从而减少细胞凋亡〔4〕。Bcl-2家族是主要的凋亡调控蛋白,包括 Bcl-2、Bax、Bcl-XL等,Bcl-2蛋白具有促进细胞生存,抑制细胞凋亡的作用,而Bax蛋白促进细胞凋亡,其中Bax与Bcl-2的表达比例是决定细胞是否凋亡的关键。心肌缺血再灌注损伤发生后,心肌细胞Bcl-2蛋白表达下降。本实验提示白藜芦醇减少心肌细胞凋亡的机制可能是通过上调Bcl-2蛋白的表达,下调Bax/Bcl-2的比值来实现的。NO还可以通过影响缺血再灌注过程中的炎症反应过程,减少心肌细胞坏死和凋亡〔5〕。
研究证实,部分心肌保护的作用机制最终依赖于Akt的活化〔6〕。PI3K-Akt保护心脏的机制中涉及多种细胞内信号转到介质和效应蛋白。活化的Akt能作用于它下游的多个靶点,如NOS〔7〕、B 细胞淋巴瘤/白血病 2(Bc1-2)家族〔8〕、糖原合成酶激酶 3β(GSK-3β)、天冬氨酸蛋白酶-9(caspase-9)、70 kd 核糖体蛋白S6激酶(p70S6K)等,并可能最终通过减少线粒体通透性转换孔(mPTP)〔9〕的开放,来改善线粒体能量的生成,保持线粒体外膜的稳定性,减少促凋亡因子的活化等,发挥保护心肌功能,抗凋亡的作用。再灌注时mPTP的开放是心肌损伤从可逆变为不可逆的标志,其开放的范围决定再灌注损伤的程度。故延迟或阻断心肌危险区mPTP的开放,可减轻心肌再灌注损伤。mPTP被认为是缺血∕再灌注损伤中细胞死亡的关键事件〔10〕。mPTP是PI3K-Akt信号通路上的重要靶点,PI3K-Akt信号通路是参与细胞增殖调控的重要通路,是许多生命活动中的关键信号分子,PI3K-Akt介导的信号通路调节细胞的分裂、分化、凋亡等活动。
由此提示,白藜芦醇对缺血再灌注心肌具有保护作用,能够显著抑制再灌注引起的细胞凋亡,而这种保护作用能被渥曼青霉素所阻断,这种抑制可能与激活PI3K-Akt信号通路有关,而激活后的Akt具体是如何发挥保护效应,还需进一步研究。
1 Matsui T,Rosenzweig A.Convergent signal transduction pathways controlling cardiomyocyte survival and function:the role of PI3K-Akt〔J〕.J Mol Cell Cardiol,2005;38(1):63-71.
2 廖奕华,邓云梅,邓静修,等.黄芪注射液对家兔急性心肌缺血再灌注损伤的保护作用〔J〕.辽宁中医学院学报,2002;32(3):55-7.
3 Maroko PR,Kjekshus JK,Sobel BE,et al.Factors influencing infarct size following experimental coronary artery occlusions〔J〕.Circulation,1971;43(1):67-82.
4 马世玉,吴基良,向继洲,等.倒卵叶五加总皂甙对大鼠心肌缺血再灌注损伤后Bcl-2、Bax蛋白表达的影响〔J〕.华中科技大学学报,2003;32(2):145-56.
5 张 峰,罗晓星,张 涛,等.缺氧复氧诱导的心肌细胞凋亡及一氧化氮对此过程的作用〔N〕.中国药理学通报,2002;18(3):288-90.
6 Tong H,Chen W,Steenbergen C,et al.Ischemic preconditioning activates phosphatidylionsitol-3-kinase upstream of protein kinase C〔J〕.Circ Res,2000;87(4):309-15.
7 Raphael J,Abedat S,Rivo J,et al.Volatil anesthetic preconditioning attenuates myocardial apoptosis in rabbits after regional ischemia and reperfusion via Akt signaling and modulation of Bcl-2 family proteins〔J〕.J Pharmacol Exp Ther,2006;318(1):186-94.
8 Hausenloy DJ,Yellon DM,Mani-Babu S,et al.Preconditioning protects by inhibiting the mitochondrial permeability transition〔J〕.Am J Physiol Heart Circ Physiol,2004;287(2):H841-9.
9 Lim SY,Davidson SM,Hausenloy DJ,et al.Preconditioning and postconditioning:the essential role of the mitochondrial permeability transition pore〔J〕.Cardiovasc Res,2007;75(3):530-5.
10 Haider UG,Roos TU,Kontaridis MI,et al.Resveratrol inhibits angiotensinⅡ and EGF-mediated Akt activation-role of Gab1 and Shp2〔J〕.Mol Pharmacol,2005;68(1):41-8.
