医疗器械的售后监督
2013-09-12欧阳黎明赖玲波冷德嵘李宁陆飞
欧阳黎明 赖玲波 冷德嵘 李宁 陆飞
1 湖南食品药品职业学院 ( 长沙 410014)
2 南京微创医学科技有限公司 ( 南京 210061)
3 南京市食品药品监督管理局 ( 南京 210007)
售后监督活动指采用积极的、系统的、科学有效的方法对上市产品进行数据和(或)其它信息的收集,数据分析和诠释[1]。售后监督活动,这个概念已经作为制造商质量体系的一部分,以满足企业内部的需要和(或)满足第三方审核的需要[2]。随着国际标准ISO13485与欧盟医疗器械指令2007/47/2007的实施,上述标准与法规对医疗器械生产企业是否建立切实有效的售后监督体系提出了更高的要求。
1.相关法规、标准对售后监督的要求
1.1 ISO13485标准(医疗器械质量管理体系)
ISO13485标准的8.2条款中要求,组织应为反馈系统建立一个形成文件的程序(见7.2.3C),以提供质量问题的早期报警,且能输入纠正和预防措施过程(见8.5.2和8.5.3)。如果国家或地区法规要求组织从生产后阶段获取经验,则对这一经验的评审应构成反馈系统的一部分(见8.5.1)。这就要求作为提供质量问题早期预警要求的一部分,组织一般实施警戒或售后监视系统。
1.2 ISO14971标准(医疗器械风险管理体系)
ISO14971标准中明确要求:制造商应建立、文件化并保持用于收集和评审生产和生产后阶段得到的医疗器械(或相似医疗器械)信息的体系。该体系应包括医疗器械产品售后的所有单个风险降低到合理可接受程度后,必须建立全部风险等级。风险包括两部分组成:(1)伤害发生的概率,即伤害可能发生的频率;(2)伤害的后果,即伤害的严重性。利益相关方能够承受风险的程度,受到以上两个因素以及他们对风险的认识的影响。由于利益相关方涉及多个方面——医师、医疗保健组织、政府机构、行业组织、患者和公众,因此,这种全部风险等级必须反映单个风险的累积效应。
2.应用现状
所有的监管制度认识到,不良事件报告本身不能捕获所有的风险与使用的医疗设备。以预期会产生假阳性和假阴性的诊断装置、长期植入器械以及家用医疗器械为例,仅使用源于不良事件报告的信息对产品性能进行评估是非常困难甚至是不可能的。出于这个原因,对处于售后阶段的数据收集产生了各种不同的数据采集方案[3]。
在澳大利亚医疗器械指南-售后监督(指南文件编号:11)中,售后监督活动主要由12种方式组成[4],详见表1。
售后监督活动包括主动售后监督和被动售后监督两种。主动售后监督活动主要包括售后临床跟踪、文献评估等,被动售后监督活动主要包括客户抱怨、事故报告、警戒系统等。售后监督活动所搜集到的数据和信息,要反馈到风险管理活动中去,对进一步的风险控制提供充分的依据。以一家生产隐形眼镜的企业为例:隐形眼镜的生产商收到了一定数量关于镜片破损的抱怨。这类抱怨数量的显著增加,可能与产品的运输和储存有关。通过调查,是由于从供应商处采购来的中盒走了生产商图纸的下偏差导致了对镜片的额外压力,从而产生了镜片损坏的数量增加。结果是:将该信息反馈给设计控制,该生产商调整了他的图纸,从而降低了镜片的破损率,增加了使用者的满意度,并降低了成本。由此可见,售后监督活动的信息反馈可以有效地促进风险控制。
发达国家都对医疗器械的售后监督活动有明确的要求,如欧盟在医疗器械指令2007/47/EEC中引入了“售后监督活动包括售后临床跟踪”的概念,并在2010年5月强制执行。美国FDA(美国食品药物管理局)在21CFR822(上市后监督)中专门描述了售后监督活动。国内目前还没有专门的关于售后监督的法规,但YY/T 0316-2008(医疗器械风险管理对医疗器械的应用)的颁布,对生产后信息的收集提出了一定的要求。发达国家的行动表明了售后监督活动不仅仅是医疗器械生产商自我控制的要求,更是主管当局监管的强制要求,由于我国还没有专门的售后监督法规,国内企业更多的是采用被动售后监督活动来进行一定的数据收集,真正满足要求的售后监督活动并不多,很多企业的售后监督活动结果仅仅是客户抱怨的数据分析。这些原因除了很多企业的风险管理意识不足以外,医疗器械的多样性和复杂性也决定了售后监督数据收集的艰难度。经过多年的实践,我国医疗器械企业在售后监督活动的执行虽然有了一定的经验,也存在不少的问题,尤其还存在一些认识上的误区。要将售后监督活动有效地贯彻执行,确保医疗器械产品的安全性和有效性,就需要充分理解相关标准和法规的内涵,强化企业主动意识,加强企业、政府部门、使用者和消费者的互动交流。
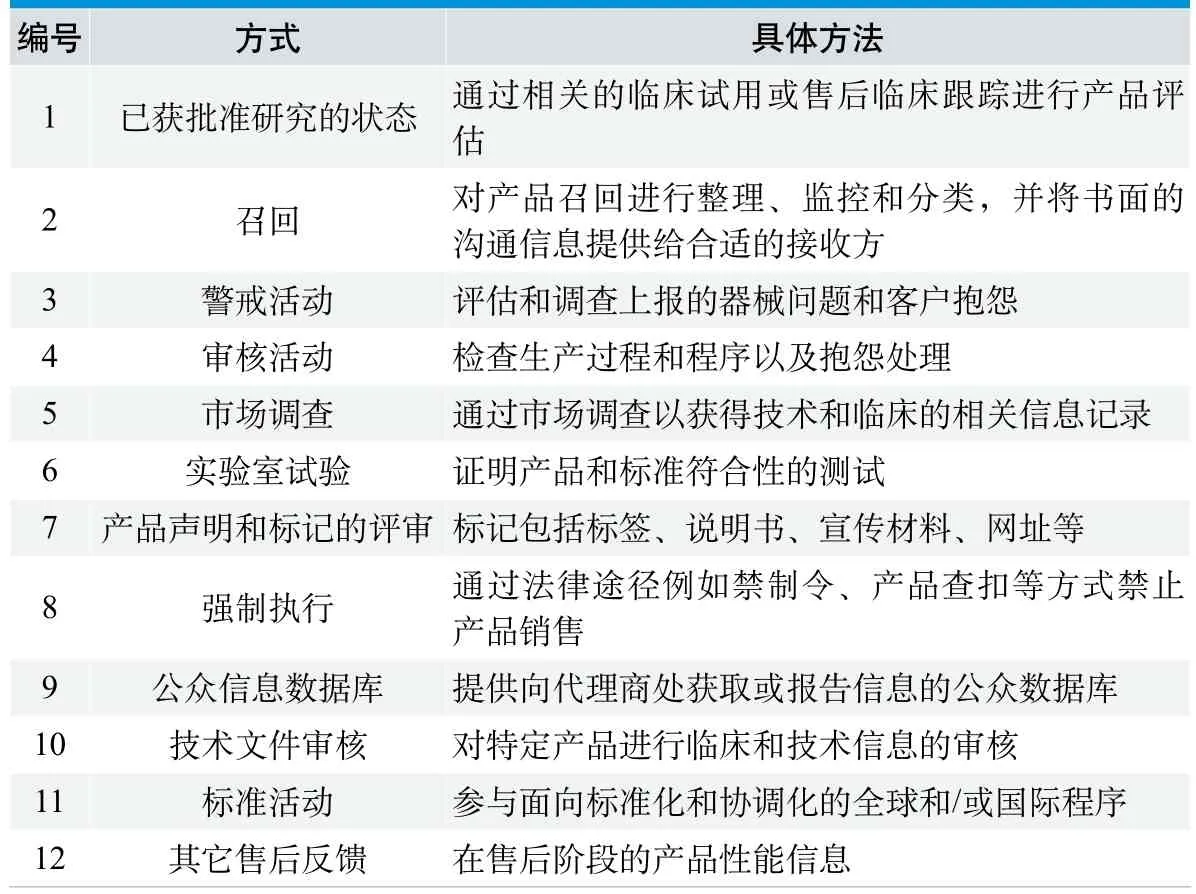
表1. 澳大利亚医疗器械售后监督主要活动方式
3.主要内容
3.1 售后监督活动执行的范围
满足(a)器械故障可能产生严重的不良健康后果;(b)器械预期植入人体1年或1年以上;或(c)器械预期使用于用户装置之外,用于支持或维持生命中任意一条的产品必须要进行售后监督活动。
3.2 售后监督计划的内容要求
A.售后监督计划的目的;
B.研究的对象,例如患者、器械、动物;
C.用于回答监督问题的变量和终点,例如临床参数或结果;
D.将要使用的监督的方法和方法论;
E.观察的样本量;
F.调查者合同,如需要;
G.数据来源,例如医院记录等;
H.数据收集计划和表格;
I.知情同意书,如需要;
J.评审机构委员会信息,如需要;
K.患者跟踪计划,如需要;
L.监督执行和进展的监控程序;
M.监督持续时间的评估;
N.计划的所有数据的分析和统计计算;
O.报告的内容和时间。
3.3 售后监督信息的来源
A.专业使用者群体;
B.客户调查;
C.客户抱怨;
D.服务信息;
E.文献回顾;
F.非客户抱怨的客户反馈;
G.产品追踪和注册信息;
H.在培训过程中,使用者的反应等。
4.实施重点
因为标准或法规是工业化国家多年有效经验的总结,也是审核或监管的依据,所以在实施售后监督活动时首先需要考虑的是遵循法规和标准的要求。
结合NB-MED/2.12/Rec1、21CFR822和ISO 14971 的应用,我们可以找到医疗器械售后监督活动的实施重点,了解了这些重点,我们可以更好地理解标准、贯彻标准。概括而言,重点在于:“全员参与、概念明确及全面数据/信息收集和分析”。
4.1 全员参与
正如医疗器械企业在实施质量管理体系时所倡导的“全员参与”,售后监督活动的执行必须要通过“全员参与”方可有效履行。
一个有效的售后监督小组,一般由8个功能小组组成,包括市场调研、文献检索、竞争产品分析、质量、临床研究、产品标记、生产/过程控制和客户服务,框架图如图1。
医疗器械产品生产企业在产品生产出来后需要投入更大力量进行售后监督活动,考虑的问题应更为全面,如考虑实际的生产过程控制、环境控制、客户反馈、最新的法律法规要求等,并将收集到的售后数据和信息反馈至风险管理活动中,进行进一步的风险控制,这就要求所有的职能部门都参与到售后监督活动中,体现“全员参与”的概念。售后监督活动是对前期风险管理活动的所有输出的一个充分验证过程。
“全员参与”,首先要求管理层要有医疗器械的风险管理意识,方可有效地推动售后监督活动的进行。医疗器械是关系人员健康、生命安全的产品,小到一块纱布、一支体温计,甚至一份产品说明书,都有可能带来损害,不可轻视[5]。
在管理层重视的前提下,“全员参与”就会体现在各个部门的职责分配和相互沟通上。在实践中,很多部门虽然在进行了数据和信息的收集,但是没有采用有效的数据信息分析,并将分析结果反馈至风险管理活动中。对所有职能部门人员进行售后监督活动和风险管理活动培训,树立全体员工售后监督和风险管理意识,并明确这两者之间的输入输出关系,是医疗器械产品售后监督活动的基础。
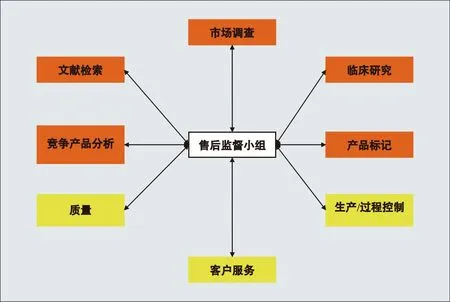
图1. 售后监督小组组成示意图
4.2 概念明确
医疗器械产品生产企业需要先确定自己的产品是否适用于售后监督活动的范围。售后监督活动的目的是最大化上市后监测计划所产生的有用数据收集的可能性。这些数据可以揭示不可预见的不良事件,预期的不良事件发生的实际概率,或者是可能保护公众健康的其他信息。
4.3 全面数据/信息收集和分析
售后监督活动的目的在于对前期的风险管理活动输出进行识别、重新评估和控制。所以对售后监督活动所搜集到的信息和数据的分析是否准确和全面尤为重要。
数据/信息收集包括发现的生产问题,产品质量改进,风险分析结果的确认,长期性能/可靠性和/或慢性并发症方面的知识,产品性能变化趋势的知识,不同使用人群对性能的要求,说明书的反馈,用户所需培训的反馈,使用其他器械的反馈,客户满意度的反馈,警戒报告的识别,错误使用方法知识,持续市场可行性的反馈。但并非所有的信息都需要收集,需要企业根据自身产品特点和企业特点进行评估,从而决定各类数据/信息收集的先后顺序。
对搜集到的数据,目前主要的分析方法是 p-chart,FMECA,Attribute Data Analysis,Process Capability Study和正态测试等方法。
以上的三个实施重点就是医疗器械产品生产器械进行售后监督活动的主要组成部分。医疗器械产品生产企业需要遵循法规和标准的要求,有重点地开展售后监督活动,以保证上市后医疗器械产品的安全性和有效性。
5.发展趋势
随着售后监督活动的不断深入,产生了多种的分析方法和工具。从常规的Excel工具的使用,还有辅助售后监督活动的各种应用软件。选择多样化的方法,结合或选用适合的工具,可以起到事半功倍的效果。
6.结论
医疗器械的售后监督活动是一个系统性活动,只有建立售后监督意识,并将售后监督活动反馈至风险管理过程中,才能真正起到作用。
[1]Title 21 CFR 822, 售后监督(Postmarket Surveillance)
[2]NB-MED/2.12/Rec1 售后监督 售后/生产(Post-Marketing Surveillance (PMS) Post Market/Production)
[3]GHTF, SG2/N47R4:2005,售后监督当前要求的评审(Review of Current Requirements on Post-market Surveillance)
[4]澳大利亚医疗器械指南-售后监督(Australian Medical Device Guidelines Postmarket Activities - Guidance Document Number 11)
[5]谢英杰,徐星岗,“医疗器械的风险管理”,中国医疗器械杂志:2007年31卷第4期
