猪支气管败血波氏杆菌的鉴定和生物学特性
2013-09-12马有智徐海圣李双茂
马有智,徐海圣,李双茂
(1.浙江大学动物科学学院,浙江杭州 310058;2.浙江省农业科学院畜牧兽医研究所,浙江杭州 310021)
猪支气管败血波氏菌 (Bordetella bronchiseptica,Bb)能感染多种哺乳动物引起呼吸道隐性感染及急慢性炎症[1]。Bb可以单独或和其他病原菌协同致病,单独感染猪可导致支气管败血波氏杆菌病,主要侵害仔猪[2]。Bb和产毒性多杀性巴氏杆菌混合感染则能导致严重的进行性萎缩性鼻炎,病猪发育迟缓,对饲料利用率降低,仔猪感染甚至出现死亡,给养猪业带来严重的经济损失。Bb易与支原体、副猪嗜血杆菌、猪流感病毒、猪繁殖与呼吸综合征病毒等感染,引起猪呼吸道综合征,增加猪群病死率[3]。在所有分离的致病菌中,分离率排在猪链球菌、副猪嗜血杆菌、大肠埃希菌之后列第四[4],是高热综合征细菌性病原的四大病原之一[5]。我们对从发病猪中分离到的细菌进行病原学研究,以期为预防和控制该病的流行提供依据。
1 材料与方法
1.1 细菌分离培养
取发病猪的肺、肝、脾、心血等组织,划线接种于5%绵羊鲜血平板,37℃培养24 h,挑取单个菌落作纯培养。用鲜血液平板、BHI培养基的18 h细菌培养物,分别作革兰氏染色,观察其形态和在固体及液体培养基中的培养特性。用微量生化发酵管 (购自杭州天和微生物公司)进行糖发酵及其他生化试验,细菌为18 h培养物。
1.2 PCR鉴定
根据文献[6]中的编码Bb的flagellin的基因序列设计引物,PCR扩增后的DNA片段为237 bp。Pl:5’-CCCCGCACATTTCCGAACTTC-3’P2:5’-GGCTCCCAAGAGAGAAAGGCTT-3’,引物由上海生工合成,用ddH2O稀释为10 μmol·L-1,-20℃保存备用。细菌DNA提取:用brain heart infusion(BHI)broth 2 mL接种细菌在37℃下培养20 h,取培养液1 mL 14 000 r·min-1离心30 s,弃上清液。沉淀物中加入灭菌蒸馏水,混匀100℃下煮沸5 min后迅速加入冰块中,放置5 min,14 000 r·min-1离心2 min,取上清液作为模板DNA使用。PCR反应程序为94℃ 10 min,94℃ 1 min,55℃1 min,72℃ 1 min,35个循环,72℃ 10 min。1%琼脂糖电泳检测。
1.3 药物敏感性试验
操作方法及结果判定参照文献[7]进行。药敏纸片购自杭州天和微生物试剂有限公司。
1.4 小白鼠致病性试验
分离株培养18 h后,倾注法平板计数,调整菌数约为1亿mL-1,分别腹腔注射6只NIH小鼠(小鼠体重15~20 g·只-1,购自浙江大学实验动物中心)。小鼠注射剂量为0.2 mL·只-1,观察发病和致死情况,连续观察6 d,剖检死亡小鼠,无菌取其心血分离细菌并鉴定。
1.5 生物被膜 (Biofilm,BF)检测
体外BF形成于测定方法参照文献[8]的微孔板法进行适当改进,具体步骤如下:将细菌过夜培养液与新鲜BHI培养液按1∶3体积混匀后,取200 μL加入到96孔酶标板小孔中,37℃湿盒静置培养24 h,弃去培养液,用0.85%的无菌生理盐水250 μL洗涤2次以去除游离细菌,干燥后往各孔加入200 μL 0.1%结晶紫染色液,染色30 min后弃去染色液,0.85%的无菌生理盐水250 μL洗涤3次,加入33%的乙酸溶液200 μL,待完全溶解后用酶标仪测定测其D570值。各试验孔均设8个平行孔,以不含菌液的培养液为空白对照。
2 结果与分析
2.1 细菌的分离培养
从发病猪的肺脏实质器官中共分离到4株细菌,分别命名为Bb5、Bb18、Bb49和Bb51。
2.2 分离菌株的形态培养特征和理化特性
分离菌株镜下细菌分散排列,个别菌体呈两极着色,均为革兰氏阴性小杆菌。在绵羊血平板培养基上分离菌株形成表面光滑,湿润,边缘整齐的圆形菌落。4株菌中,Bb5在血平板上呈β溶血,其余3株菌均呈α溶血。在BHI培养基中呈均匀浑浊生长,Bb5菌株在培养液表面能形成明显的生物被膜 (图1)。4株细菌都不分解碳水化合物,触酶和氧化酶都是阳性。
图1 分离菌株在BHI培养基中形成的生物被膜
2.3 分离菌株的PCR检测
结果 (图2)显示,4株分离菌均能扩增出预期大小的237 bp的DNA片段。PCR产物经克隆测序分别与波氏杆菌fla基因 (No.AF232939)序列100%同源性 (序列略)。

图2 分离菌株的flagellin基因PCR产物
2.4 分离菌株的药物药敏性
分离菌对阿米卡星、卡那霉素、妥布霉素、先锋必、氧呱嗪青霉素、环丙沙星、氟派酸、菌必治、氯霉素、庆大霉素等敏感,对新霉素、红霉素、壮观霉素、复方新诺明、四环素等不敏感;Bb51对林可霉素、复达欣和氨苄青霉素中度敏感,其他3株菌不敏感 (表1)。
2.5 分离菌株的动物致病性
分别接种Bb5、Bb18、Bb49和Bb51细菌,6只小白鼠中死亡数分别为5,0,6和1只,对照组无异常,显示4株菌对小白鼠毒力有差异。取死亡鼠心血接种血平板,结果分离出纯的经鉴定与接种菌一致的细菌,证明为猪支气管败血波氏杆菌并对小鼠有一定致病性。
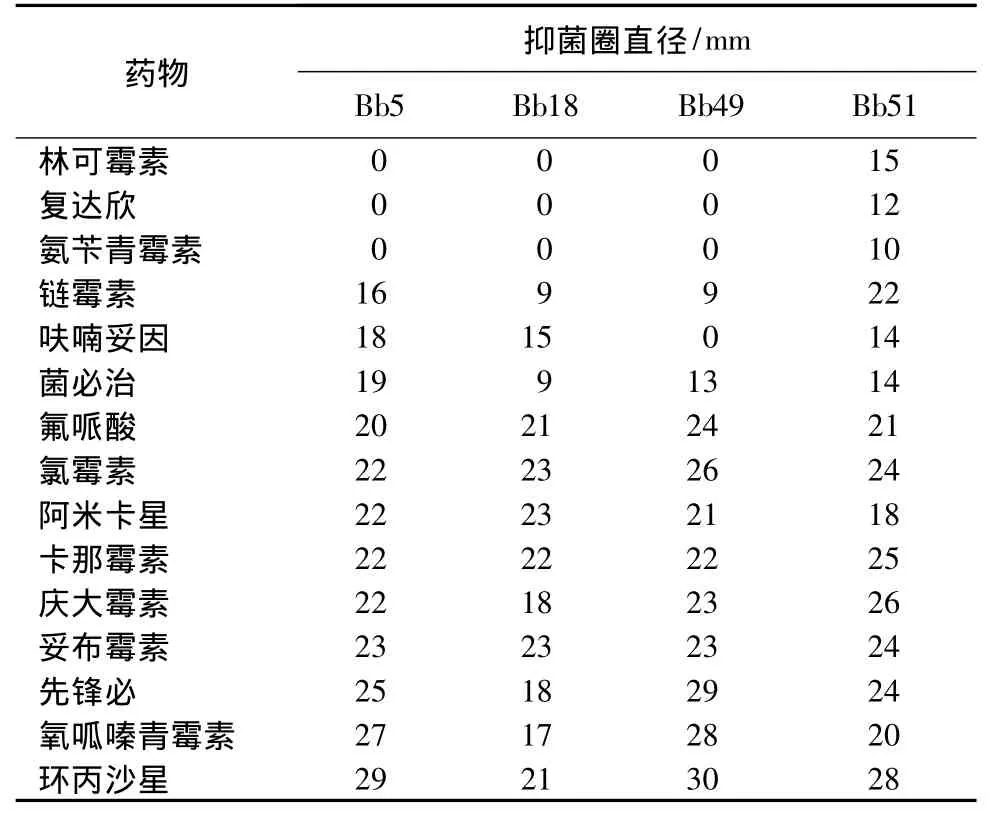
表1 分离菌株对药物的敏感性
2.6 分离菌株的生物被膜
4株菌形成生物被膜能力不同,差异分析结果(图3)显示,Bb5,Bb18,Bb49与Bb51之间有极显著差异。

图3 分离菌株的生物被膜形成
根据《伯杰细菌鉴定手册》,对4株分离细菌从形态、培养特性、生理生化特征和PCR鉴定等,确定4株分离菌均为支气管败血波氏杆菌。在对该菌培养特性进行鉴定过程中,发现该菌具有较强的变异性,即易于由强毒力的Ⅰ相菌变异为弱毒力的Ⅱ、Ⅲ相菌,表现为初代分离物在血平板上培养可产生绿色色素,在普通琼脂平板及普通肉汤中生长不产生色素,此特征为强毒力的I相菌的表现。药
3 小结和讨论
敏试验结果显示,4株菌对大多数抗生素的敏感性基本相同,只有Bb51对林可霉素、复达欣和氨苄青霉素中度敏感,而其他3株菌均不敏感。4株菌在液体培养时,只有Bb5能形成明显的BF,其他3株菌BF不明显。BF定量测定显示,4株菌中,Bb5和Bb18生物被膜形成量最多,而Bb51形成量最少;而动物试验显示 Bb5和 Bb49毒力较强,Bb18和Bb51基本无毒力,说明毒力与BF的形成量没有明显的相关性,这与文献报道有一定不同[9]。然而,我们发现从发病棘胸蛙分离的嗜水气单胞菌,其BF与毒力之间具有正相关性,这可能与细菌的种类不同有关。总之,细菌毒力、BF形成能力与药物敏感性三方面之间的关系还需要进一步的研究。需要注意的是,体外药敏试验没有考虑BF的因素,在动物体内细菌以BF的形式黏附于呼吸道黏膜引起耐药。因此,我们在临床对支气管败血波氏杆菌引起的感染治疗时,药敏试验结果只能作为参考依据。
[1]陆承平.兽医微生物学[M].3版.北京:中国农业出版社,2002:276-277.
[2]斯特劳.猪病学[M].8版.北京:中国农业大学出版社,2000:369-396.
[3]袁翠霞,罗阿东,徐景峨,等.猪萎缩性鼻炎支气管败血波氏杆菌PCR检测方法的建立[J].中国预防兽医学报,2007(11):896-899.
[4]Zhao Z Q,Wang C,Xue Y,et al.The occurrence of Bordetella bronchiseptica in pigs with clinical respiratory disease[J].The Veterinary Journal,2011,188:337 -340.
[5]徐引弟,王治方,蔡旭旺,等.河南省规模化猪场高热综合征细菌性病原的分离鉴定[J].河南农业科学,2010(1):116-118.
[6]Hozbor D,Fouque F,Guiso N.Detection of Bordetella bronchiseptica by the polymerase chain reaction[J].Res in Microbiol,1999,150(5):333 -341.
[7]Davies D.Understanding biofilm resistance to antibacterial agents[J].Nat Rev Drug Discov,2003(2):114-122.
[8]Stepanovic S, Vukovic D, Dakic I, et al. Modified microtiter-plate test for quantification of staphylococcal biofilm formation [J].J Microbiol Meth,2000,40:175-179.
[9]Fux C A,Costerton J W,Stewart P S,et al.Survival strategies of infectious biofilms[J].Trends Microbiol,2005,13:34-40.
