瓜类细菌性果斑病菌对硫酸铜的敏感性检测与分析
2013-09-11赵文龙杨玉文王铁霖刘慧芹赵廷昌
赵文龙, 杨玉文, 王铁霖, 蒋 洁, 刘慧芹, 赵廷昌
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
瓜 类 细 菌 性 果 斑 病 (bacterial fruit blotch,BFB)是西瓜和甜瓜上最重要的毁灭性种传细菌性检疫病害,病原菌为西瓜嗜酸菌(Acidovorax citrulli,Ac)。菌株间存在比较丰富的遗传多样性,主要分为两个亚群,亚群Ⅰ主要分离自甜瓜、南瓜等,亚群Ⅱ主要分离自西瓜[1-4]。目前,该病害在美国、澳大利亚、韩国、日本、土耳其及泰国等国家均有发生。我国的西瓜、甜瓜种植面积和产量都位居世界前列,而且我国是西瓜、甜瓜的重要制种基地,该病害自1998年在我国首次报道以来[5],已经在我国大面积发生,给西甜瓜种植业造成了巨大的损失[6],成为目前我国西甜瓜种植业生产上亟待解决的问题。
田间防治果斑病的药剂主要是含铜杀菌剂[7-8],随着铜化合物药剂的使用,菌株对铜的敏感度越来越低,为果斑病的药剂防治带来困难。Walcott等[4]对35株果斑病菌铜敏感度进行了初步检测,发现83%的亚群Ⅰ菌株对硫酸铜不敏感,菌株间对铜敏感性存在差异。目前,国内尚没有关于果斑病菌株对硫酸铜敏感度的检测报道,因此作者对实验室保存的143株菌株的硫酸铜敏感性进行了检测,以确定菌株的硫酸铜敏感浓度,以及不同菌株之间的敏感度差异,为合理使用含铜杀菌剂田间防治该病提供帮助。
1 材料与方法
1.1 材料
本实验室保存的143株果斑病菌菌株。其中寄主为甜瓜的菌株71株,寄主为西瓜的菌株71株(含寄主为打瓜的菌株5株),寄主为南瓜的菌株1株;亚群Ⅰ菌株91株,亚群Ⅱ菌株52株(表1)[9]。King’s B(KB)培养基[10],CuSO4·5H2O购自天津大学科威公司。
1.2 方法
1.2.1 不同浓度硫酸铜KB培养基配制
称取0.3125g CuSO4·5H2O,溶于100mL的蒸馏水,配制0.2%的母液,4℃冰箱保存。分别取母液25.64、52.63、81.08、111.11、142.86、176.47、212.12、250、290.32、333.33、379.31、428.58、481.48、538.46、600mL加入KB培养基成分中,定容至1000mL,配制含有50、100、150、200、250、300、350、400、450、500、550、600、650、700、750μg/mL 硫酸铜平板的KB培养基。融化培养基,制成含有不同浓度硫酸铜的KB平板。
1.2.2 硫酸铜敏感性测定
将143株果斑病菌株(表1)分批次在KB培养基上于28℃下培养48h后待用。挑取单菌落在含有不同浓度硫酸铜的KB平板上画线,28℃培养。每个浓度设3个重复,以不加硫酸铜的KB平板作为对照,2d后开始观察菌落生成情况,直至10d,观察期间若有单菌落生成则判定为不敏感,若无单菌落生成则定为敏感。挑取首次活化的菌株单菌落于KB平板上进行继代培养,培养10代后,用同样方法再次对菌株的硫酸铜敏感性进行测定。

表1 143株瓜类细菌性果斑病菌Table1 143strains of Acidovorax citrulli

续表1 Table 1(Continued)
2 结果与分析
2.1 果斑病菌对硫酸铜的敏感性
果斑病菌对不同浓度硫酸铜敏感性的检测结果见表2。供试所有菌株在对照和低浓度硫酸铜培养基中均能正常生长,表现为不敏感,因此低于300μg/mL(1.88mmol/L)处理结果没有在表中显示。浓度为300μg/mL时,菌株生成单菌落的时间开始延缓,随着硫酸铜浓度的增加,部分菌株表现出对硫酸铜敏感(表2)。浓度为300μg/mL (1.88mmol/L)、350μg/mL(2.19mmol/L)时除pslbtw43菌株外所有菌株表现为不敏感,在浓度达到700μg/mL(4.38mmol/L)时,分离自我国的所有菌株均不能生长,而来自国外亚群Ⅰ的8株菌株在此浓度下仍然能够生长,表现出良好的抗性,浓度达到750μg/mL(4.69mmol/L)后所有菌株在培养10d内均不能生长。将菌株继代培养10代后,再一次检测所有菌株的敏感性,试验结果与第一代没有差异。

表2 果斑病菌对不同浓度硫酸铜敏感性检测结果1)Table 2 Sensitivity of 143strains of A.citrulli to copper sulfate

续表2 Table 2(Continued)

续表2 Table 2(Continued)
2.2 不同寄主菌株硫酸铜敏感性差异
对不同寄主菌株的硫酸铜敏感性进行了统计分析(图1)。在硫酸铜浓度低于400μg/mL(2.5mmol/L)时,2种寄主上的敏感菌株数量无显著差异。浓度为450μg/mL(2.81mmol/L)时,西瓜和甜瓜上的敏感菌株数量开始增加。500μg/mL(2.13mmol/L)时32%分离自西瓜的菌株不敏感,其中分离自打瓜的菌株全部不能生长,92%分离自甜瓜的菌株不敏感。浓度为500~650μg/mL(2.13~4.06mmol/L)时分离自西瓜和甜瓜的敏感菌株比率无显著变化。浓度为700μg/mL(4.38mmol/L)时,3%分离自甜瓜的菌株不敏感,但此时仍有7%分离自西瓜的菌株能够生长,该浓度下不敏感的菌株全部来自于美国(Walcott赠送)。综合分析表明寄主为甜瓜的菌株比其他寄主的菌株对硫酸铜具有更低的敏感性,即有更高的抗铜性。

图1 不同硫酸铜浓度下不同寄主菌株的生长比率Fig.1 The growth rate of strains from different hosts under different copper sulfate concentrations
2.3 亚群Ⅰ和亚群Ⅱ菌株硫酸铜敏感性差异
通过对亚群Ⅰ和亚群Ⅱ菌株硫酸铜敏感性的统计分析,结果表明:硫酸铜浓度低于450μg/mL(2.81mmol/L)时亚群Ⅰ和亚群Ⅱ菌株敏感性没有差异;在浓度为450μg/mL(2.81mmol/L)时,亚群Ⅱ菌株中对硫酸铜不敏感的菌株所占比例开始显著降低,在500μg/mL(2.13mmol/L)时所有亚群Ⅱ菌株均不能生长。在浓度为650μg/mL(4.06mmol/L)时,亚群Ⅰ不敏感菌株数量开始出现较明显的下降,但仍有82%的菌株不敏感;浓度为700μg/mL(4.38mmol/L)时,有9%亚群Ⅰ菌株不敏感;在750μg/mL(4.69mmol/L)浓度时所有亚群Ⅰ菌株均不能生长。分析结果表明亚群Ⅰ菌株硫酸铜敏感性显著低于亚群Ⅱ菌株(图2)。
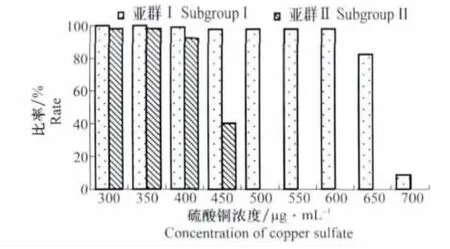
图2 不同硫酸铜浓度下两组菌株的生长比率Fig.2 The growth rate of strains from different groups under different copper sulfate concentrations
3 讨论
通过检测,确定了143株果斑病菌株的硫酸铜敏感浓度。供试143株果斑病菌菌株包含来自我国西瓜、甜瓜主产区的10个省市,地理来源丰富、具有代表性,因此试验结果可以体现我国果斑病菌菌株的硫酸铜敏感性。试验采用与Walcott R R相同的检测方法,且试验所用部分国外供试菌株也相同。Walcott R R对200μg/mL(1.25mmol/L)硫酸铜浓度下不敏感的菌株并没有继续检测其硫酸铜敏感浓度;其试验结果表明在硫酸铜浓度为100μg/mL(0.63mmol/L)时即有菌株表现为敏感,而本试验在相同浓度和相同观察时间下相同供试菌株均表现为不敏感[4]。来自美国的部分菌株在浓度达到700μg/mL(4.38mmol/L)时仍能够生长,而来自于我国的菌株在该浓度下均不能生长,该结果表明美国的菌株对铜有更高的抗性。试验试图分析菌株硫酸铜敏感度与时间、地理来源的关系,但由于相同地点不同时间段菌株的来源与数量有限,无法得出伴随铜制剂农药的使用等因素使果斑病菌株的铜敏感度逐年增加的结论,需要进一步进行对该病害的监测和病原菌的分离检测。
综合分析表明寄主为甜瓜的菌株比寄主为西瓜的菌株对硫酸铜具有更低的敏感性,但不是所有寄主为甜瓜的菌株抗铜性都高于其他寄主的菌株。通过对不同亚群菌株硫酸铜的敏感性分析表明,亚群Ⅰ菌株硫酸铜敏感性显著低于亚群Ⅱ菌株;硫酸铜浓度为500μg/mL(3.13mmol/L)时,亚群Ⅰ菌株只有2%敏感,而亚群Ⅱ菌株100%敏感,且根据试验中的观察,在不同浓度硫酸铜平板上,亚群Ⅰ菌株形成单菌落的速率也高于亚群Ⅱ菌株,表明亚群Ⅱ菌株抗铜性均较弱,因此使用铜制剂防治该亚群果斑病可以获得更好的效果。造成寄主为甜瓜的菌株比寄主为西瓜的菌株对硫酸铜具有更低的敏感性的原因可能是:通常情况下,甜瓜叶片显症明显,瓜农在发现叶片病斑后,为了防止病害进一步暴发,造成较大的经济损失,通常选择第一时间喷洒农药;而西瓜叶片症状不明显,瓜农往往不施药;因此甜瓜较西瓜用药更加频繁,使得分离自甜瓜的菌株对铜有更高的抗性。但该原因无法解释寄主为甜瓜的亚群Ⅱ菌株抗铜性较差,寄主为西瓜的亚群Ⅰ菌株抗铜性较高。显然以亚群判断菌株的抗铜性更加科学与准确。因此要想真正阐明果斑病菌株间抗铜性差异的原理,需要进一步从生理与分子机理上开展研究。本研究仅有一株来自于美国寄主为南瓜的菌株,该菌株对硫酸铜的敏感度为700μg/mL(4.38mmol/L),由于数量有限无法对南瓜上的菌株硫酸铜敏感性作出判断,需要进一步获得更多菌株。
田间防治果斑病的主要含铜杀菌剂53.8%氢氧化铜干悬浮剂800倍液,铜浓度约为6.86mmoL/L;47%春·王铜可湿性粉剂800倍液,铜浓度约为5.23mmoL/L。两种农药的铜含量均高于4.69mmoL/L(750μg/mL),存在滥用现象。在大田发生病害后,并没有根据菌株的不同而设定使用不同浓度的农药。因此本试验菌株硫酸铜敏感浓度以及不同亚群和寄主菌株间硫酸铜敏感性差异的确定为科学合理地选择果斑病防治方法及使用铜制剂农药浓度提供了理论依据。合理的使用、选择农药不仅可以降低成本、减少农药残留、减少污染、有效地控制病害,更可以减缓菌株对农药抗性提升的速度,提升果斑病的防治效率。供试菌株继代培养后的检测结果没有差异,表明菌株具有稳定的铜抗性。果斑病菌是否存在抗铜性基因目前还不清楚,抗铜机理也尚未研究,在今后的试验中可以在分子水平对其进行研究分析。
[1] Somodi G C,Jones J B,Hopkins D L,et al.Occurrence of a bacterial watermelon fruit blotch in Florida[J].Plant Disease,1991,75(10):1053-1056.
[2] O’Brien R G,Martin H L.Bacterial blotch of melons caused by strains of Acidovorax avenae subsp.citrulli[J].Australian Journal of Experimental Agriculture,1999,39:479-485.
[3] Walcott R R,Langston D B,Sanders F H,et al.Investigating intraspecific variation of Acidovorax avenae subsp.citrulli using DNA fingerprinting and whole cell fatty acid analysis[J].Phytopathology,2000,90:191-196.
[4] Walcott R R,Fessehaie A,Castro A C.Differences in pathogenicity between two genetically distinct groups of Acidovorax avenae subsp.citrulli on cucurbit hosts[J].Phytopathology,2004,152:277-285.
[5] 张荣意,谭志琼,文衍堂,等.西瓜细菌性果斑病症状描述和病原菌鉴定[J].热带作物学报,1998,19(1):70-75.
[6] 阎莎莎,王铁霖,赵廷昌.瓜类细菌性果斑病研究进展[J].植物检疫,2011,25(3):71-75.
[7] Hopkins D L.Control of bacterial fruit blotch of watermelon with cupric hydroxide[J].Phytopathology,1991,81:1228.
[8] Hopkins D L.Copper-containing fungicides reduce the spread of bacterial fruit blotch of watermelon in the greenhouse[J].Phytopathology,1995,85:510.
[9] Yan Shasha,Yang Yuwen,Wang Tielin,et al.Genetic diversity analysis of Acidovorax citrulli in China[J].European Journal of Plant Pathology,2013,136(1):171-181.
[10]King E O,Ward M K,Raney D E.Two simple media for the demonstration of pyocyanin and fluorescin[J].The Journal of Laboratory and Clinical Medicine,1954,44(2):301-307.
