水分胁迫对大岩桐生理生化指标的影响
2013-09-11王存纲
王存纲,郭 丽
(1.鹤壁职业技术学院,河南 鹤壁 458030;2.河南农业职业学院,河南 郑州 475470)
大岩桐原产南美洲巴西的热带雨林,属于温室盆栽球根花卉。将试验获得的大岩桐组培苗利用聚乙二醇 (PEG-6000,以下简称 PEG)人工模拟干旱条件,从生理的角度对其抗旱性进行研究,测定叶绿素、膜透性等生理生化指标的变化。
1 材料与方法
1.1 供试材料
重瓣大岩桐品种由西南大学园艺园林学院花卉实验室保存。
1.2 供试材料的培养与处理
将生长均匀的大岩桐不定芽接种于1/2MS固体培养基上,在24~26℃,光照16 h·d-1,光强1 500~2 000 lx条件下培养。
当生长均匀的组培苗长出大量根系时,将其上部的培养基洗净放入干净的培养瓶中,分别加入20 mL浓度分别为5%,15%,25%,35%的PEG进行根际水分胁迫处理24 h,以去离子水为对照,重复3次。
均匀剪取组培苗叶片,用去离子水冲洗干净,再用干净吸水纸吸干,混匀称重,进行叶绿素含量(参考高俊凤[1]方法)、丙二醛 (MDA)含量 (硫代巴比妥酸显色法[2])、电导率 (电导仪法[3],用相对电导率表示)和过氧化物酶 (POD)活性(愈创木酚比色法[1-3])测定。
2 结果与分析
2.1 不同PEG浓度处理对抗旱性的影响
24~26℃组培室培养的大岩桐在40%PEG处理24 h,叶片完全干枯。因此试验设 PEG 5%,15%,25%,35%不同处理浓度。35%处理使受试植株几乎全部失水死亡,在5%时部分植株叶片就发生萎蔫,甚至死亡。这表明大岩桐植株对干旱非常敏感。
2.2 不同PEG浓度处理对叶绿素的影响
叶片叶绿素含量与光合作用密切相关。叶绿素含量的测定无论是在生理、品种选育及抗性研究等方面都很有必要,其含量多少直接影响叶片的光合能力。
从图1可知,不同PEG浓度处理下,叶绿素含量随着PEG浓度的增大而降低,5%PEG处理与对照差异不显著,比对照含量减少了0.86%;25.0%PEG处理比对照含量少了19.6%,35.0%PEG浓度处理比对照含量减少了近1/2。这可能是由于在各种逆境胁迫下,植物光合作用呈现出下降的趋势,同化产物供应减少,如干旱、寒冷、高温等均可使叶绿素含量下降,光合作用酶活性下降,钝化或气孔关闭,造成CO2供应不足而使光合速率下降,同化物形成减少,叶绿素含量下降。
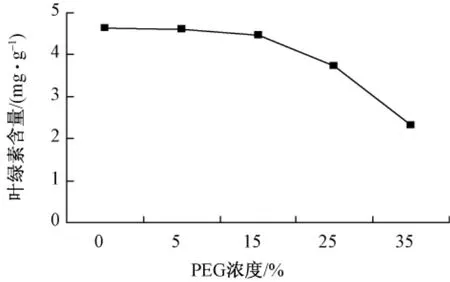
图1 不同浓度PEG对幼苗叶绿素含量的影响
2.3 不同PEG浓度处理对MDA的影响
MDA是植物脂质过氧化的产物,是检测植物膜伤害的一个重要的指标,其含量可以表示脂膜过氧化的程度。
从图2看出,随PEG浓度的增大,大岩桐叶片细胞内MDA含量的变化幅度有较大差异。在5%,15%,25%浓度处理后,MDA比对照分别增加48.6%,108.0%和201.5%,而35%浓度处理后,MDA比对照增加325.5%。MDA含量的变化在一定程度上反映了大岩桐对水分胁迫敏感程度的差异。

图2 不同浓度PEG对幼苗MDA含量的影响
2.4 不同PEG浓度处理对相对电导率的影响
植物细胞膜对维持细胞的微环境和正常的代谢起着重要的作用。正常情况下,细胞膜具有选择透性。当植物受到逆境胁迫影响时,如干旱和盐胁迫下,细胞膜遭到破坏,膜透性增大,从而使细胞内的电解质外渗,使植物细胞浸提液的电导率增大。因此,质膜透性的变化是植物细胞结构和功能完整性的可靠指标[4]。
在PEG渗透胁迫下,大岩桐幼苗膜透性随着PEG浓度的增加而呈上升趋势 (图 3)。5%,15%,25%,35%PEG浓度处理后,相对电导率比对照分别增加 6.3%,12.5%,146.9%和259.4%。
在5%,15%PEG浓度处理下,与对照相比差异不是太大,但25%,35%PEG浓度处理下,相对电导率与对照相比发生极显著变化,出现了急剧升高,说明在PEG渗透胁迫下,大岩桐幼苗细胞受到了一定的伤害,而且渗透胁迫强度越大,受到的伤害越严重。
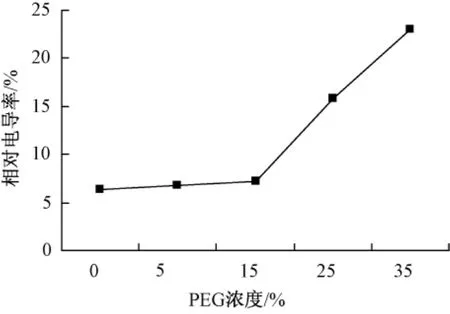
图3 不同浓度PEG对幼苗相对电导率的影响
2.5 不同PEG浓度处理对POD的影响
正常情况下,由于植物体内存在着活性氧,清除系统细胞内活性氧含量处于动态平衡的状态,因此不会引起对植物的伤害。植物细胞中活性氧的清除主要是通过有关酶和一些抗氧化物质。细胞的保护酶主要有超氧化物歧化酶 (SOD)、POD、过氧化氢酶 (CAT)等,非酶类的活性氧清除剂包括类胡萝卜素、Vc、Ve 等[5]。
从图4可知,不同PEG浓度处理后,POD活性呈先升后降趋势。5%浓度处理后,POD活性呈上升趋势,明显高于对照;15%,25%,35%处理后,POD活性均呈下降趋势。15%处理虽POD活性高于对照,但却低于5%处理,35%时POD活性甚至低于对照。所以轻度胁迫能促进POD活性增高,但随着胁迫强度的增大,酶活性变化呈下降趋势,可能使其酶系受到破坏。王启明等[6]研究表明,随着干旱胁迫天数的增加,大豆酶活性变化趋势均呈先升后降,达到峰值后迅速下降,说明抗旱机制也仅维持到此而已。

图4 不同浓度PEG对幼苗POD活性的影响
3 小结和讨论
植物遭受逆境胁迫或在衰老的进程中都伴随细胞膜系统的逐步破坏。Fridovih提出生物自由基伤害是细胞系统破坏的主要原因,认为植物体内大量自由基产生的毒害引发膜脂过氧化作用,从而造成细胞膜系统的破坏[7];细胞内同时存在清除超氧自由基的保护系统,如CAT,POD和SOD等。水分胁迫造成的膜系统伤害就是由细胞内活性(O-2)的产生与清除的不平衡引起的。植物处于正常水分状态时,机体原有的各种氧代谢生理过程处于平衡状态,所产生的氧自由基能够得到及时的清除;在水分严重亏缺的条件下,植物机体各种代谢过程发生紊乱,从各代谢途径产生的氧自由基增加,机体由于代谢受阻不能及时清除而发生积累。大量积累的氧自由基以强烈的氧化作用诱发细胞膜中的不饱和脂肪酸,其产物是具有强氧化性的脂质过氧化物的各种小分子的降解物,尤其以MDA含量增高最为显著。因此,植物的抗旱性与活性氧清除酶类的活性密切相关。
关于植物抗旱机理,自由基引起的伤害学说[8-9]已受到人们的广泛重视,植物机体在正常生理代谢过程中,通过多种途径产生活性氧(ROS)[10]。ROS是成对电子,其化学性质极其活泼,几乎可与植物体内全部生物大分子进行反应,破坏这些大分子的活性构象,影响细胞正常代谢[11]。正常情况下,植物体依赖体内 ROS清除系统包括SOD、POD、CAT、甘露醇、甘氨酸、抗坏血酸、类胡萝卜素等维持自由基生成与清除的动态平衡,但在植物的衰老劣变过程中,特别是当植物处于干旱、盐害和环境污染等逆境下,体内ROS生成大于清除,ROS的大量积累与膜脂反应造成膜伤害[12-15]。很多试验证实,轻度水分胁迫后,SOD、POD、CAT 活性有增加趋势[16-17]。张振镒等[18]发现,干旱胁迫可提高抗旱玉米叶片细胞保护酶SOD、POD的活性,但随着干旱胁迫时间延长,玉米叶片细胞保护酶活性不同程度地下降。
本试验结果表明,干旱胁迫明显地影响大岩桐组培苗叶片活性氧的产生与活性氧清除系统 (即细胞保护系统)之间的动态平衡。随着干旱胁迫强度增加,POD活性增大,这是大岩桐组培苗适应干旱的一种应激保护反应。而当水分胁迫强度继续增大,其活性下降,这是因为在高度的水分亏缺环境下,植物严重脱水,POD受到破坏而导致活性降低,有机体内活性氧的产生与清除平衡系统遭到破坏。如在35%PEG浓度处理下,POD活性低于对照。
膜脂过氧化是一个复杂的过程,而MDA含量的高低表示了膜脂过氧化作用的程度[19-20]。本试验结果表明,在水分胁迫下,O-2和H2O2含量越高,膜脂过氧化的终产物MDA也越高,说明水分胁迫下活性氧的产生和积累是引起MDA含量增加的主要因素。蒋明义等[21]的研究表明,抗旱性强的品种具有较强抗氧化能力,膜脂过氧化程度低;抗旱性弱的品种抗氧化能力较弱,膜脂过氧化程度较高。MDA含量随水分胁迫浓度增加上升,造成膜伤害,增大细胞膜的透性,引起细胞内物质外渗。细胞液外渗液增加,即表现为电导率增大。干旱对细胞膜的伤害随着胁迫程度的提高而加大,且胁迫程度越高,电导率就越大[22]。
光合作用是植物代谢的基础,而叶绿素是光能吸收和转换的原初物质,因此,影响叶绿素代谢的逆境因素都将直接影响植物的生长发育。植物在遭受水分胁迫时抗旱性强的品种叶绿素含量比抗旱性弱的品种叶绿素含量高,又进一步证明了抗旱性强的品种受伤害程度越小。而在持续水分胁迫下,由于活性氧的产生和清除平衡被打破,尽管植物体内SOD、POD活性上升到较高水平,但 O-2和H2O2仍较快积累,MDA含量持续升高,膜脂过氧化加剧,进而影响光合、呼吸等生理过程,最终影响产量和品质。
大岩桐的抗旱性是个复杂性状,其适应干旱环境的机理尚不十分清楚,不同生育阶段对水分胁迫的响应,活性氧积累诱发植物伤害的最低浓度以及活性氧诱导保护系统的机理等还有待深入研究。
[1]高俊凤.植物生理学实验技术 [M].杨凌:西北农业大学,2000.
[2]候福林.植物生理学实验教程 [M].北京:北京科学出版社,2004.
[3]李合生.植物生理生化实验原理与技术 [M].北京:高等教育出版社,2000.
[4]王荣华,石雷,汤庚国,等.渗透胁迫对蒙古冰草幼苗保护酶系统的影响 [J].植物学通报,2003,20(3):330-335.
[5]姚允聪,曲泽洲,李树仁.不同浇水处理过程中柿幼树SOD、CAT和脂质过氧化作用的变化 [J].北京农学院学报,1994,9(1):23-27.
[6]王启明,郑爱珍,吴诗光.干旱胁迫对花荚期大豆叶片保护酶活性和膜脂过氧化作用的影响 [J].安徽农业科学,2006,34(8):1528-1530.
[7]陈洪.木麻黄抗旱生理生化部分特性的研究 [J].福建农业大学学报,2000,15(1):48-54.
[8]Bewkey J D.Physiological aspects of desiccation tolerance[J].Ann Rev Plant Physio,1979,30:195-238.
[9]Dhinsa R S,Wandckayim.Drought tolerance in two mosses:correlated with enzymatic defence against lipid peroxidation[J].J Exp Bota,1981,32(126):79 -91.
[10]Elster E F,Harald S.Biological socources of free radical[J].Free Radical in the Enviro,1994,7:13-15.
[11]王建华,刘鸿先.SOD在植物逆境及衰老中的作用 [J].植物生理学通讯,1980(1):1-7.
[12]王俊刚,陈国仓,张承烈.水分胁迫对2种生态型芦苇(phragmites communis)的可溶性蛋白含量 SOD、POD、CAT活性的影响 [J].西北植物学报,2002,22(3):561-565.
[13]Smirnoff N.The role of active oxygen in the response of plants to water deficit and desiccation [J].New Phytol,1993,125:27-58.
[14]Sigha S,Choudhuri M A.Effect of salinity(NaCl)stress on H2O2metabolism in vigna and oryza seedlings[J].Biochem Physiol Pflanzen,1990,186:69-74.
[15]Tanaka K, Sugahara K. Role of superoxide dismutase indefence againstSO2toxicity and increase in superoxide dismutase activity with SO2fumigation[J]. PlantCell Physiok,1980,21:601-611.
[16]陈由强.水分胁迫对芒果幼叶细胞活性氧伤害影响 [J].生命科学研究,2000,4(1):60-64.
[17]林永英.水分胁迫对青冈叶片活性氧的伤害 [J].福建林业大学学报,2002,22(1):1-3.
[18]张振镒,郭蔼光,罗淑萍.水分胁迫对玉米SOD和POD活力及同工酶的影响 [J].西南农业大学学报,1989,17(1):45-49.
[19]唐连顺,李广敏.干旱对玉米杂交种及其亲本自交系幼苗膜脂过氧化及其保护酶活性的影响 [J].作物学报,1995,21(4):409-512.
[20]蒋明义,郭绍川.渗透胁迫下稻苗中铁催化的膜脂过氧化作用 [J].植物生理学报,1996,22(1):6-12.
[21]蒋明义,杨文英,徐江,等.渗透胁迫诱导水稻幼苗的氧化伤害 [J].作物学报,1994,20(4):733-738.
[22]李培英.优良草坪草研究 [M].北京:北京农业出版社,2001.
