EGF通过STAT5调控肺腺癌A549细胞中COX-2的机制
2013-09-10曹守强赵桂彬董庆韩敬泉辛衍忠闫宇博李吉尧崔键
曹守强 赵桂彬 董庆 韩敬泉 辛衍忠 闫宇博 李吉尧 崔键
肺癌是导致人类死亡的第一高发癌症。肺腺癌是非小细胞肺癌(non-small cell lung cancer, NSCLC)的一种,虽然可以通过手术切除和放化疗进行治疗,但患者预后通常较差。近几年随着小分子靶向药物治疗的兴起,使部分肺腺癌患者的生存期明显延长,生活质量得到改善。然而临床研究[1]表明,表皮生长因子受体(epidermal growth factor receptor, EGFR)突变阳性的肺腺癌患者对EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)的有效率可达70%-80%,而野生型的患者有效率仅约10%-20%,治疗存在局限性。即便EGFR-TKI初始治疗有效的患者,随着治疗时间的延长,最终几乎都会出现获得性耐药,而且,严重的皮肤副反应等并发症常使很多患者被迫停药。以上种种问题限制了EGFR-TKI的推广使用,在不久的将来,EGFR-TKI必将被副作用小、适用人群广的靶向药物所取代。
STAT5是STAT家族中的成员,受细胞因子或生长因子激活后发生磷酸化改变,由细胞浆穿梭入细胞核,参与转录调控,并在细胞的生长及分化过程中起到关键作用。在人体内很多组织存在STAT5的表达,而且血液、乳腺、头颈部及前列腺肿瘤等存在STAT5的激活,其参与了肿瘤细胞的增殖、分化及凋亡等生物学行为。COX-2是COX家族中的一员,COX-2在多种实体瘤如肺癌、乳腺癌、前列腺癌、膀胱癌中均存在较高表达,并参与了肿瘤细胞的调亡、肿瘤侵袭、血管发生及肿瘤转移等过程。越来越多的研究表明COX-2在肺癌发生过程中起关键作用,COX-2的过度表达可以抑制细胞调亡,刺激血管生成,促进肿瘤细胞的浸润与转移,导致肺癌疾病进展[2],并可作为判断肺癌预后的指标[3]。而COX-2抑制剂无论与其它药物联合治疗或单独使用,均因其对肺癌血管生成的抑制而具有治疗作用[2]。因此,COX-2成为肺癌未来诊断与治疗研究的新热点。但在肺腺癌中COX-2是否受到细胞因子的刺激后表达发生改变,以及STAT5是否参与了COX-2表达的调控等机制至今仍不明确。带着这些疑问,我们对肺腺癌A549细胞中STAT5对COX2的调控机制进行了研究。
1 材料与方法
1.1 材料 人肺癌细胞株A549购自中国科学院典型培养物保藏委员会细胞库。STAT5和p-STAT5a/b兔抗人抗体购自美国Santa Cruz公司,FITC标记的羊抗兔二抗购自美国Sigma公司。STAT5短片断干扰RNA(small interfer RNA, siRNA)(ON-TARGETplus SMARTpool siRNA),ON-TARGETplus Non-targeting siRNA(阴性对照)及DharmaFECT siRNA转染试剂均购自美国Dharmacon公司。STAT5显性负突变体(AdCMV5 Stat5a△740)及野生型STAT5(AdWTSTAT5)质粒由名古屋市立大学医学科学院Hiroko Yamashita教授惠赠。ProteoJETTM细胞浆和细胞核蛋白提取试剂盒购自加拿大Fermentas公司。蛋白提取试剂盒购自美国Milipore公司。Bradford蛋白定量试剂盒购自美国Pierce公司。含有STAT5结合位点的生物素标记双链探针(5'-biotin-AGATTTCTAGGAATTCGCAG-3')购自美国Affymetrix公司。DuoSet IC(Intracellular)Active Transcription Factor Assays(用于检测转录因子结合实验)购自英国R&D公司。辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗兔抗体购自美国Chemicon公司。Trizol试剂购自Invitrogen公司。RT-PCR试剂盒购自大连TaKaRa公司。PCR所用引物均由大连TaKaRa公司提供。
1.2 方法
1.2.1 细胞培养 人肺癌细胞株A549用含有10%胎牛血清、100 μg/mL青霉素、100 μg/mL链霉素的RPMI-1640完全培养基(美国Gibco公司)在37oC、5%CO2、相对湿度为90%的培养箱中培养。随后将细胞接种于12孔板中进行EGF(Invitrogen公司,100 ng/mL)激活实验及转染研究。
1.2.2 免疫荧光法检测STAT5核穿梭现象 A549细胞爬片24 h,待细胞伸展并牢固贴附玻片后用磷酸缓冲盐溶液(phosphate buffer saline, PBS)洗涤细胞,更换为含0.1%血清的培养基饥饿培养过夜。次日更换为含100 ng/mL EGF和10%胎牛血清的完全培养基,1 h后,用PBS冲洗,4%多聚甲醛固定10 min,0.25% Triton X-100透化处理细胞,5%胎牛血清封闭1 h,用兔抗人STAT5或p-STAT5a/b一抗(1:100稀释)4oC孵育过夜。PBS洗涤后,用FITC标记的羊抗兔二抗(1:200稀释)孵育2 h。Hoechst33258细胞核染色后,在荧光显微镜下观察并拍照。
1.2.3 STAT5 siRNA的转染及分组研究 待A549细胞铺满板底约80%-90%时,根据商品说明书使用DharmaFECT siRNA转染试剂对细胞进行STAT5 siRNA转染(50 nM)。ON-TARGETplus Non-targeting siRNA作为阴性对照进行转染,转染72 h后Western blot法验证沉默效率。并根据研究需要分为6组:未转染组;转染阴性对照siRNA组;EGF刺激组;转染阴性对照siRNA加EGF刺激组;转染STAT5 siRNA加EGF刺激组;转染STAT5 siRNA组。
1.2.4 STAT5显性负突变体(dominant negative mutant,DN)及野生型STAT5的转染及分组研究 腺病毒介导的Stat5a△740 Stat5a能够阻断STAT5的信号通路的激活[4]。待A549细胞铺满板底约70%-80%时,准备转染质粒。取2支EP管,于一管中加入10 μg质粒和500 μL无血清、无抗生素的RPMI-1640培养基,另一管加入20 μg Lipofectamine 2000和500 μL无血清、无抗生素的RPMI-1640培养基。两管混合后,室温放置30 min,再加1 mL RPMI-1640培养基,混匀。吸出孔板中旧培养基,用无血清、无抗生素的RPMI-1640培养基洗涤一遍,然后加入已混匀的上述两种混合液。2 h后,倒掉混合液,更换为含10%血清的RPMI-1640培养基,转染72 h后Western blot法验证转染效率。并根据研究需要分为5组:未转染组;转染野生型STAT5组;EGF刺激组;转染STAT5显性负突变体加EGF刺激组;转染STAT5 siRNA加EGF刺激组。
1.2.5 转录因子结合实验 将干预后细胞分为如下5组:未转染组;转染野生型STAT5组;EGF刺激组;转染STAT5显性负突变体加EGF刺激组;转染STAT5 siRNA加EGF刺激组。根据试剂盒说明书提取各组细胞核蛋白。使用Bradford蛋白定量试剂盒进行蛋白质浓度测定。根据文献[5]指导进行操作。一抗为兔抗人p-STAT5(100 μL/1:100),二抗为HRP标记的羊抗兔抗体(100 μL/1:200)。
1.2.6 Western blot实验 细胞经上述处理后,根据试剂盒说明书分别提取细胞核蛋白,细胞浆蛋白和总蛋白,首先进行蛋白定量,从每组中取50 μg蛋白提取物进行SDS聚丙烯酰胺凝胶电泳,转膜,以5%脱脂奶粉PBS/0.1%Tween20封闭30 min,加入1:1,000倍稀释的一抗(STAT5或p-STAT5),以β-actin或Histone H1为内参,4oC孵育过夜。PBS/0.1% Tween20洗膜后加入二抗室温孵育2 h。PBS/0.1% Tween20洗膜后ECL发光,用Chemi-genius凝胶成像系统分析目的蛋白的表达量。
1.2.7 半定量RT-PCR检测 细胞经过上述处理后,收集细胞,用Trizol试剂一步法提取细胞总RNA。取总RNA 500 ng进行cDNA第一链合成,根据RT-PCR试剂盒说明书合成模板。引物序列如下:COX-2(forward:5'-TTCAAATGAGATTGTGGGAAAATTGCT-3'; reverse:5'-AGATCATCTCTGCCTGAGTATCTT-3'),β-actin(forward: 5'-AAATCGTGCGTGACATTAA-3'; reverse: 5'-CTCGTCATACTCCTGCヰG-3')。PCR体系在94oC下变性2 min,循环条件为94oC、30 s,55oC、30 s,72oC、30 s,共25个循环,最后延伸10 min。取产物5 μL通过电泳利用琼脂糖凝胶进行分离,并在紫外线灯下照相。最后通过凝胶灰度分析仪进行统计分析。
1.3 统计分析 利用SPSS 13.0软件进行统计学处理,统计学数据用Mean±SD表示,多组间均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 EGF对肺腺癌A549细胞中STAT5活化的影响 为明确在体外A549细胞中是否存在STAT5的激活,以及EGF是否可以促进STAT5的活化,我们用EGF对细胞刺激后进行了免疫荧光染色。在荧光显微镜下,我们发现在部分未经处理的A549细胞中活化的STAT5(p-STAT5)主要位于细胞浆,且处于极低的激活水平,而在部分细胞则无p-STAT5的表达。EGF刺激A549细胞后STAT5部分活化穿梭入细胞核,而且呈高水平激活(图1)。在未经处理的A549细胞中STAT5位于细胞浆内,呈高水平表达。EGF刺激A549细胞后细胞浆内STAT5的表达无明显改变(图2)。经Western blot分析,结果显示,在未经处理的A549细胞核中无p-STAT5的表达,而经EGF激活后,细胞核中的p-STAT5呈高表达(图3A)。在EGF刺激A549细胞前后,细胞浆内的STAT5均呈高表达,且无明显差异(图3B)。
2.2 STAT5 siRNA对A549细胞中STAT5蛋白表达的影响及对COX-2 mRNA表达的影响 Western blot检测结果表明,与未转染及转染阴性对照siRNA的细胞相比,转染STAT5 siRNA细胞中STAT5蛋白表达水平明显降低(P<0.05),提示STAT5 siRNA能明显阻断STAT5的表达,而EGF刺激后对STAT5的表达无明显影响(图4A)。另一方面,与未转染及转染阴性对照siRNA的细胞相比,转染STAT5 siRNA细胞中COX-2 mRNA的表达明显降低(P<0.05)。EGF虽然可以使COX-2 mRNA表达明显升高,但在转染STAT5 siRNA细胞中,此作用被明显削减(P<0.05,图4B)。
2.3 野生型STAT5及STAT5显性负突变体对A549细胞中STAT5、p-STAT5蛋白及COX-2 mRNA表达的影响 Western blot检测结果表明,与未处理组的细胞相比,转染野生型STAT5细胞中STAT5蛋白表达水平明显升高(P<0.05),而对p-STAT5蛋白表达无明显影响。转染STAT5显性负突变体细胞对STAT5表达无明显影响,但Western blot可见突变体条带,而且,转染STAT5显性负突变体后,EGF对STAT5的活化作用也被明显削弱(P<0.05,图5A,图5B),提示STAT5显性负突变体有阻断STAT5激活的作用。另一方面,与未转染的细胞相比,转染野生型STAT5细胞中COX-2 mRNA的表达明显升高(P<0.05),提示非磷酸化的STAT5在A549细胞中有调节COX-2表达的作用。转染STAT5显性负突变体细胞中,EGF上调COX-2 mRNA的作用被明显削弱(P<0.05,图5C),提示p-STAT5在A549细胞中同样具有调节COX-2表达的功能。

图 1 A549细胞和EGF刺激A549细胞后p-STAT5的免疫荧光染色分析。A:p-STAT5在A549细胞中的表达;B:A549细胞的核染色;C:A与B的重叠图像;D:EGF刺激后p-STAT5在A549细胞中的表达;E:A549细胞的核染色;F:D与E的重叠图像。Fig 1 Immunofluorescence of p-STAT5 in resting and EGF-stimulated human lung adenocarcinoma A549 cells. Upper panels, no EGF stimulation;lower panels, EGF stimulation. (A) and (D), p-STAT5 staining; (B) and (E), Hoechst33258 staining of nuclei; (C) and (F), merged images.

图 2 A549细胞和EGF刺激A549细胞后STAT5的免疫荧光染色分析。A:STAT5在A549细胞中的表达;B:A549细胞的核染色;C:A与B的重叠图像;D:EGF刺激后STAT5在A549细胞中的表达;E:A549细胞的核染色;F:D与E的重叠图像。Fig 2 Immunofluorescence of STAT5 in resting and EGF-stimulated human lung adenocarcinoma A549 cells. Upper panels, no EGF stimulation;lower panels, EGF stimulation. (A) and (D), STAT5 staining; (B) and (E), Hoechst33258 staining of nuclei; (C) and (F), merged images.
2.4 A549细胞中STAT5表达的变化和STAT5活化对 DNA结合活性的影响 转录因子结合实验结果显示,与未处理组的细胞相比,EGF刺激后的细胞的STAT5 DNA结合活性明显升高(P<0.05)。转染野生型STAT5的细胞未发现STAT5 DNA结合活性发生改变。而转染STAT5显性负突变体和STAT5 siRNA的细胞中,EGF对STAT5 DNA结合活性的刺激作用被抑制(图6)。提示STAT5显性负突变体和STAT5 siRNA有抑制STAT5 DNA结合活性的作用,从而影响STAT5的转录活性。
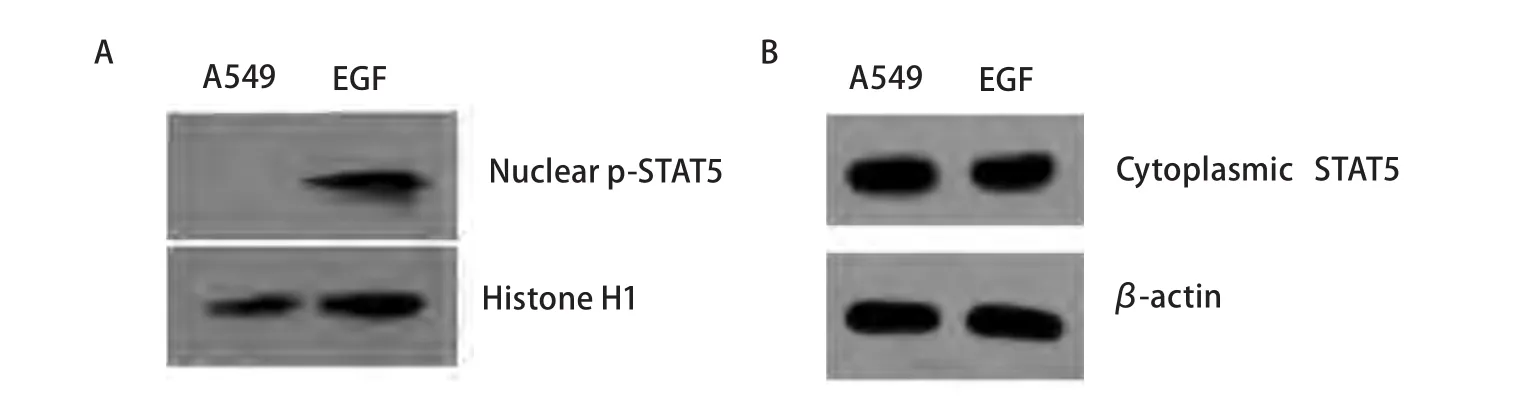
图 3 EGF刺激对A549细胞核p-STAT5(A)和细胞浆STAT5(B)表达影响的免疫印迹分析Fig 3 P-STAT5 (A) and STAT5(B) expression induced by EGF in human lung adenocarcinoma A549 cells. Western blot analysis of nucleus extracts from EGF-stimulated and resting A549 human lung adenocarcinoma cells showing upregulation of nucleus p-STAT5 (A) and no significant of cytoplasmic STAT5 (B).
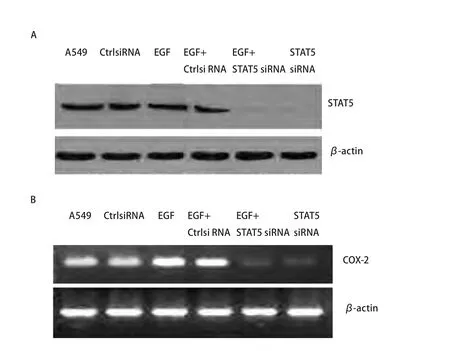
图 4 A549细胞转染STAT5 siRNA后以及受到EGF刺激后对STAT5表达影响的免疫印迹分析(A)和COX-2 mRNA表达影响的电泳分析(B)。A549:未转染组;CtrlsiRNA:转染阴性对照siRNA组;EGF:EGF刺激组;EGF+CtrlsiRNA:转染阴性对照siRNA加EGF刺激组;EGF+siRNA:转染STAT5 siRNA加EGF刺激组;STAT5 siRNA:转染STAT5 siRNA组。Fig 4 Western blot analysis of STAT5 expression (A) and electrophoresis analysis of COX-2 expression (B) in A549 cells transfected with STAT5 siRNA together with or without EGF stimulation. A549: untransfected; CtrlsiRNA: transfected with control siRNA; EGF: stimulation with EGF;EGF+CtrlsiRNA: transfected with control siRNA and stimulation with EGF; EGF+STAT5 siRNA : transfected with STAT5 siRNA and stimulation with EGF; STAT5 siRNA: transfected with STAT5siRNA.
3 讨论
自1992年Fu发现了信号转导和转录激活因子以来,国内外医学工作者对STAT家族进行了大量研究,证实STAT家族成员参与了多种细胞因子、生长因子的信号转导,并调节人体免疫反应、炎症反应和细胞的生长、分化等。研究显示,在许多恶性肿瘤中,包括白血病[6]、乳腺癌[7]、前列腺癌[8]、头颈癌[9]及NSCLC[10]中均存在STAT的异常激活。STAT激活后发生磷酸化,形成二聚体并穿梭入细胞核,入核后的STAT与同源的DNA结合区域相结合诱导转录激活[11]。在NSCLC中已被证实存在STAT酪氨酸磷酸化现象[12]。
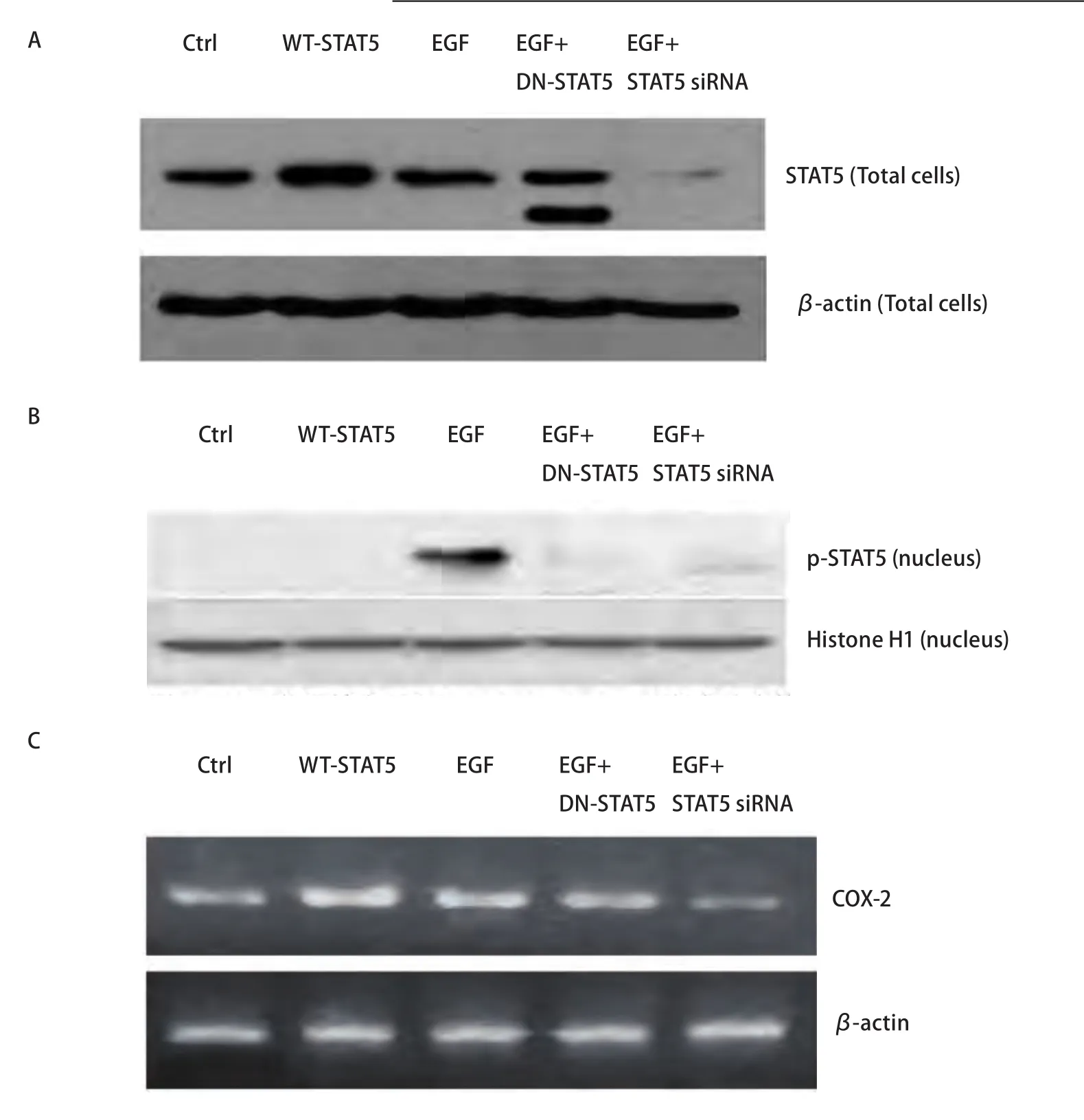
图 5 A549细胞转染野生型STAT5,STAT5显性负突变体和STAT5 siRNA后以及受到EGF刺激后对STAT5(A)、p-STAT5(B)表达影响的免疫印迹分析和COX-2 mRNA表达影响的电泳分析(C)。Ctrl:未转染组;WT-STAT5:转染野生型STAT5组;EGF:EGF刺激组;EGF+DN-STAT5:转染STAT5显性负突变体加EGF刺激组;EGF+STAT5 siRNA:转染STAT5 siRNA组加EGF刺激组。Fig 5 Western blot analysis of STAT5 (A), p-STAT5 (B) and electrophoresis analysis of COX-2 (C) expression in A549 cells transfected with WT-STAT5,DN-STAT5 and STAT5 siRNA together with or without EGF stimulation. Ctrl, transfected with control adenovirus; WT-STAT5, transfected with wildtype STAT5; EGF, stimulation with EGF; EGF+DN-STAT5, transfected with dominant negative STAT5 and stimulation with EGF; EGF+STAT5 siRNA,transfected with STAT5 siRNA and stimulation with EGF.
在STAT家族的7个成员中,目前研究最为深入和广泛的是STAT3和STAT5。STAT5分为STAT5a和STAT5b两种亚型,STAT5位于细胞浆内,受细胞因子或生长因子刺激,在酪氨酸激酶,特别是JAK激酶的作用下,其羧基末端结构域的酪氨酸残基发生磷酸化,从而使STAT5发生活化[13]。磷酸化的STAT5形成同源或异源的二聚体,穿梭入细胞核内,识别并结合到靶基因特异启动子的反应元件中[14]。
RNA干扰(RNA interference, RNAi)技术是用来研究基因功能的最常用工具,属于转录后基因沉默(posttranscriptonal gene silencing, PTGS)。而显性负突变体是通过显性负性作用而产生负性调节效应,在蛋白水平起竞争性抑制作用,对目的基因表达无影响,能够和正常受体竞争结合配体,但是显性负突变体无信号传导功能,因此对该受体功能起到抑制作用,并对该受体的表达未造成影响,而siRNA则会导致该受体表达水平下降。因此,siRNA和显性负突变体是在不同水平起作用的。STAT5是通过磷酸化及去磷酸化来实现其作用的,磷酸化后生成的蛋白量很少,若仅用siRNA来抑制目的基因表达并不能完全阐释STAT5的功能。而用显性负突变体则可以代替功能蛋白来研究其缺失后状态,并对研究人类癌细胞的基因功能非常有用。STAT5显性负突变体的特点是使激活域的C末端的部分或完全失活。Stat5a△740是表达负显性STAT5的质粒,保留了二聚体形成及DNA结合区域中保守的酪氨酸残基,可对STAT5a和STAT5b介导的转录产生干扰[15]。我们通过对A549细胞进行STAT5显性负突变体转染,使细胞过表达显性负STAT5,从而减弱DNA结合活性,抑制EGF介导的DNA结合活性的增加,以此研究STA5活化后对COX-2的调节作用。通过对细胞进行野生型STAT5的转染可以使STAT5的表达升高,借助此方法,我们可以更深一步地为非磷酸化STAT5对COX-2的调控作用进行阐释。
本研究中,通过对A549细胞进行EGF的刺激,STAT5 siRNA、野生型STAT5及STAT5显性负突变体的转染,从多层次多角度探讨了STAT5对COX-2的调控作用,从而得出如下结论:EGF的刺激可诱导A549细胞中STAT5的活化,使COX-2 mRNA的表达明显升高,但STAT5的表达未增加;STAT5 siRNA可抑制STAT5蛋白及COX-2 mRNA的表达,并可削减EGF对STAT5的激活效应;野生型STAT5可使STAT5蛋白和COX-2 mRNA的表达升高,但不能使STAT5发生活化;STAT5显性负突变体可削减EGF对STAT5的活化作用和EGF上调COX-2 mRNA的作用。这些结果提示,在肺腺癌A549细胞中,STAT5的激活参与了COX-2的调控,而且是COX-2上调表达的必须条件。另一方面,非磷酸化的STAT5的表达也是COX-2表达的必要条件,其可能通过不依赖于磷酸化和转录激活途径来实现其调控作用。COX-2表达很可能受非磷酸化STAT5及磷酸化STAT5双途径的调控。据文献[16]报道,STAT5可被EGFR家族激酶激活,这也与我们得出的STAT5可以通过EGFR信号通路发生活化这一结论相符。

图 6 A549细胞转染野生型STAT5,STAT5显性负突变体和STAT5 siRNA后以及受到EGF刺激后对STAT5 DNA结合力表达影响的分析。与其它组相比,*P<0.05,n=3。Fig 6 STAT5 DNA binding assay in A549 cells nuclei transfected with WT-STAT5, DN-STAT5 and STAT5 siRNA with or without EGF stimulation.Data are means± SEM. *P<0.05 when compared with the other four groups. n=3.
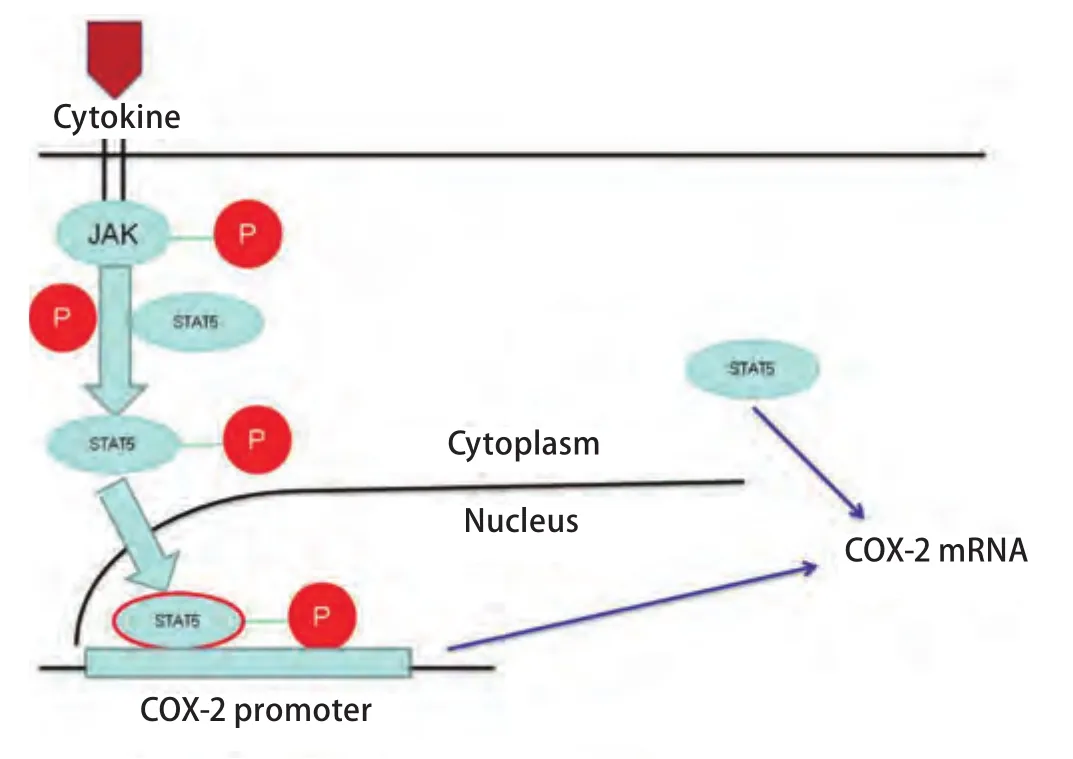
图 7 STAT5对COX-2可能存在的两种调控机制。STAT5通过磷酸化及非磷酸化双途径来实现对COX-2的调控。Fig 7 Schematic depiction of two different potential mechanisms of regulation. STAT5 regulates COX-2 by pathways dependent of phosphorylation and unphosphorylation.
综上所述,通过我们研究,有如下新发现:①在体外A549细胞中STAT5无激活;②EGF能够诱导STAT5的激活,促使磷酸化的STAT5穿梭入核;③STAT5的激活是EGF诱导COX-2上调表达的必要条件;④非磷酸化状态的STAT5可能通过非转录激活的途径参与了COX-2表达的调控。更令我们感兴趣的是在研究中发现非磷酸化STAT5也可能参与了COX-2表达的调控,还有一个尚未明确的信号通路需要我们继续去探求。我们可以利用STAT5通过磷酸化及非磷酸化双途径来实现对COX-2的调控(图7)这一特点,探求一条以STAT5为靶点治疗肺腺癌的新途径,为更多肺腺癌患者的治疗寻求到新出路。
