镁、锰、活性炭和石灰及其交互作用对小麦镉吸收的影响
2013-09-07周相玉冯文强秦鱼生廖鸣兰刘禹池王昌全涂仕华
周相玉,冯文强,秦鱼生,喻 华,廖鸣兰,刘禹池,王昌全,涂仕华,*
(1.四川省农业科学院土壤肥料研究所,成都 610066;2.四川农业大学资源环境学院,成都 611130)
重金属是一类不能降解且具有潜在危害的重要污染物,能在生物体内富集,并转化为毒性更强的金属有机化合物。重金属在植物体内积累到一定程度时,就会影响植物对营养元素的吸收、蒸腾作用、光合作用、呼吸作用等正常生理活动,改变植物细胞的超微结构,对植物造成伤害甚至导致死亡[1]。镉不仅危及植物的生长发育,而且通过粮、油、水果、蔬菜等农产品进入食物链危害人类健康。镉进入人体后,会在体内积蓄。当累积达到致病剂量后,便会引起人体器官/组织的致畸,致癌,突变等[2]。
植物对重金属的吸收和累积受诸多因素的影响,如土壤质地、水分、有机质、pH值、共存元素[3-6]等。在镉污染土壤上,肥际土壤理化性状的变化会影响镉的形态变化和作物对镉的吸收。例如,施用铁、镁、锰肥能明显降低旱作土壤中镉的活性和小麦对镉的吸收[7];施用石灰能显著降低土壤有效镉浓度,但石灰过量则会使小麦显著减产[8-9]。这些研究主要探讨了不同物质单因素处理对小麦吸收镉的影响,对复合因子的研究较少。因此,本试验旨在探讨镁、锰、活性炭和石灰不同用量和交互作用,以及镁、锰肥的两种施用方式(土壤施用和叶面喷施)对小麦吸收镉的影响,从而为镉污染土壤上使用镁,锰,活性炭和石灰等物质抑制作物吸收镉的合理施用提供技术支撑。
1 材料与方法
1.1 供试材料
试验盆栽用土壤采自绵竹市富新镇镉污染水稻土0—20cm耕层。样品风干后,除去沙砾及植物残体,用木槌捣碎后供小麦盆栽使用,部分土样经磨碎过筛后用于基本理化性质以及全镉和有效镉含量测定。土壤pH用 pH计(pHS-4C+)测定(土水比1∶2.5),全氮用开氏法,有机质用重铬酸钾外加热法,碱解氮用碱解扩散法,有效钾用NH4OAc浸提火焰光度法,有效磷用Olsen-NaHCO3浸提-钼蓝比色法,CEC用醋酸铵法,全镉采用HNO3-HF-HC1O4消煮,火焰原子吸收光谱法(石墨炉novAA400-德国耶拿)测定,有效镉采用 Tessier(1979)五步连续提取法第一步:即1mol/L 1MgCl2(pH=7)溶液浸提[10],石墨炉原子吸收光谱法测定。供试土壤 pH6.8,有机质 4.26%,碱解氮 156.9mg/kg,有效磷 18.3 mg/kg,有效钾 75.3 mg/kg,阳离子交换量(CEC)14.9cmol/kg,全镉0.489 mg/kg,有效镉0.125mg/kg。供试作物为川麦42,由四川省农业科学院作物研究所提供。
1.2 试验设计
盆栽试验设计共22个处理,每个处理重复3次。添加的物料包括硫酸镁,硫酸锰,活性炭(粉状),熟石灰(Ca(OH)2),试验设一个无肥对照(CK0)处理和只添加氮、磷、钾肥料的对照处理(CK)。除CK0处理外,其余处理每千克风干土壤分别添加0.20g N、0.15g P2O5和0.15g K2O。氮肥为尿素,磷肥为磷酸二氢钙,钾肥为硝酸钾,活性炭为重庆钟山活性炭制造有限公司生产的环保专用炭(经Na2S溶液浸渍处理,对重金属有更强吸附能力),添加的其它试剂均为分析纯。各元素用量参考一般大田试验中施用量,据其养分用量计算出对应的肥料用量。为了比较Mg和Mn对小麦吸收Cd的影响机理是发生在土壤还是植株体内,除土施硫酸镁和硫酸锰处理外,另外设置叶面喷施硫酸镁和硫酸锰处理(分别在小麦苗期、拔节孕穗期各喷1次)。试验各处理的添加物和肥料用量见表1。
称取7kg风干土于干净塑料盆中,按照表1称取每个处理所需肥料与称好土壤混合均匀。按100%田间持水量加水入陶瓷盆中,然后将塑料盆中混匀的土壤倒入陶瓷盆中,利用毛细作用湿润上层土体,15d后施肥。将称好的氮、磷、钾肥料均匀洒施在离土表5cm深处,放置2d后播种。小麦种子经表面消毒后,用去离子水冲洗5次,恒温箱25℃培养12 h,将吐出芽嘴的健康种子播入土中,每盆10颗,三叶期定苗至7株,生长期间定量浇水。
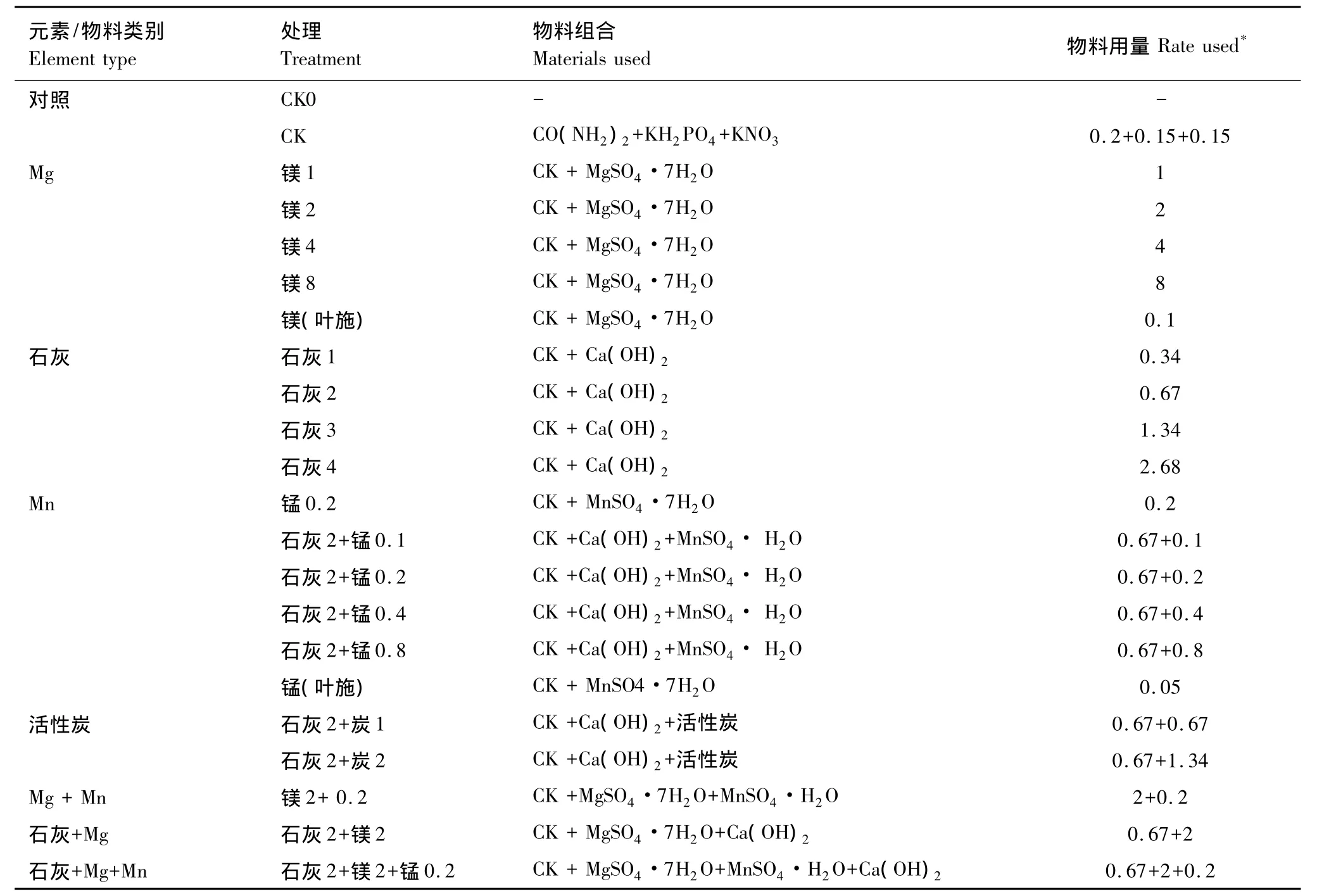
表1 镁、锰、活性炭和石灰对小麦生长和吸收镉影响的试验设计Table1 Experiment design for effect of magnesium,manganese,activated carbon and lime on wheat grow and cadmium uptake
1.3 测定项目与方法
小麦成熟后收获地上部分,干燥后测定小麦基本生物性状。将秸秆样品和籽粒样品置于烘箱65℃烘干至恒重,磨碎后过40目尼龙筛,然后用HNO3-HClO4消解法进行分析测定,试验中采用消煮空白和标准样品进行质量控制和回收率校正,火焰原子吸收光谱法测定小麦秸秆和籽粒Cd含量。小麦植株Cd吸收量(μg/盆)=植株生物量(g/pot)×植株Cd浓度(mg/kg)。试验数据采用DPS软件进行方差分析。
2 结果与分析
2.1 镁,锰,活性炭和石灰对小麦产量及构成因素的影响
镁、锰、活性炭和石灰对小麦产量及构成因素的影响见表2。与无肥处理(CK0)相比所有施肥处理均显著提高小了麦籽粒产量、秸秆产量及产量构成因素数值。在施肥处理中,以镁2,石灰2+锰0.8,石灰2+镁2+锰0.2三个处理的小麦有效穗数最高,但与CK差异不显著;镁4、镁8、锰(叶施)、镁2+锰0.2、石灰2+炭1、石灰3和石灰4都显著降低了小麦的有效穗。在NPK处理的基础上添加其他物料显著降低了小麦穗粒数和千粒重,其中以石灰2+炭2处理的有效穗数最低;使千粒重降低幅度最大的为石灰2+炭2处理,其降幅达到显著水平。小麦籽粒产量以石灰2+镁2+锰0.2处理为最高,为24.22g/盆,但与CK处理的差异不显著;镁2+锰0.2、石灰2+炭1、石灰2+炭2、石灰2、石灰3和石灰4的小麦籽粒产量均显著低于CK处理;其余处理与CK差异不显著。小麦秸秆产量以CK为最高,其中以镁2+锰0.2处理降低幅度最大,为8.68g/盆,达到了显著水平。

表2 镁、锰、活性炭和石灰对小麦生长的影响Table2 Effect of magnesium,manganese,activated carbon and lime on wheat growth
2.2 镁、锰、活性炭和石灰对小麦吸收镉的影响
2.2.1 不同用量的石灰对小麦吸收镉的影响
从表3看出,施用氮磷钾肥较无肥处理明显促进了小麦对Cd的吸收,但降低了Cd从秸秆向籽粒的转移。施用石灰能显著降低小麦籽粒和秸秆中Cd浓度和吸收量,对Cd浓度降低的效果随石灰用量增加而增加,最高量的石灰处理籽粒Cd浓度为0.071mg/kg,比CK降低了43%;最高石灰用量处理的秸秆Cd浓度为1.74μg/盆,较CK下降了75%。就Cd吸收量而言,不同用量石灰处理间的差异不显著;当石灰用量≥0.66g/kg时,即石灰2及其以后的高用量处理,籽粒吸收的Cd无明显变化。秸秆中的Cd吸收量随石灰用量增加而显著降低。从Cd在小麦体内的分配比例来看,表观上显示出高量石灰促进了Cd从秸秆向籽粒的转移,但实际上却是因为籽粒Cd含量保持相对稳定而秸秆Cd含量显著降低之故。石灰对小麦吸收Cd的抑制作用大致可归咎于两个方面的原因,一是石灰施入土壤后能升高土壤pH,增加土壤表面的可变电荷量和对Cd2+的吸附能力;二是促进Cd2+水解为吸附作用更强的Cd(OH)+,使得土壤中的交换性Cd浓度降低[11]。
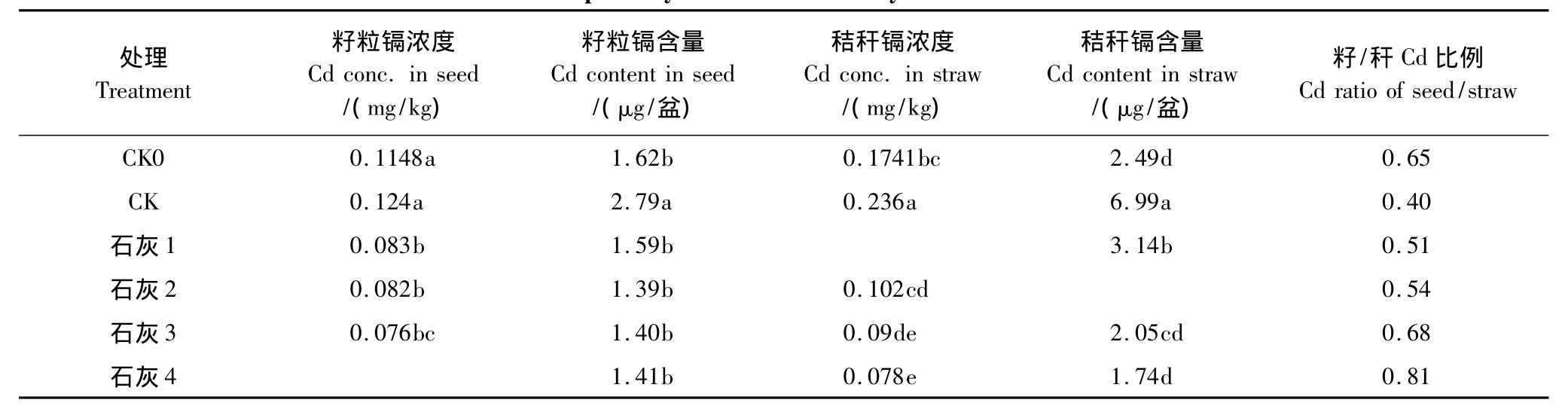
表3 不同石灰用量对小麦镉吸收的影响Table3 Cd uptake by wheat as affected by different rates of lime
2.2.2 不同用量的硫酸镁对小麦吸收镉的影响
不同用量的硫酸镁对小麦籽粒和秸秆的Cd浓度影响差异显著(表4)。所有的硫酸镁处理都比CK显著降低了小麦籽粒的Cd浓度和吸收量。当硫酸镁用量从1mmol/kg增至8mmol/kg时,小麦籽粒Cd浓度下降了34%—60%,Cd吸收量的变化趋势也基本一致。叶面喷施0.1% 硫酸镁后,小麦籽粒中的Cd浓度与镁1处理相当。不同硫酸锰用量和施用方式处理的小麦秸秆Cd浓度与吸收量都高于籽粒,其变化趋势也与上述的籽粒Cd一致。从籽/杆Cd比例来看,镁2和镁(叶施)处理高于CK,最高量硫酸镁处理籽杆Cd比例最小。当硫酸镁与石灰配合施用时,小麦籽粒Cd浓度与单施硫酸镁相比没有变化,但籽粒Cd含量、秸秆Cd浓度和含量都比单施硫酸镁显著降低,表现出一定的正交互作用。
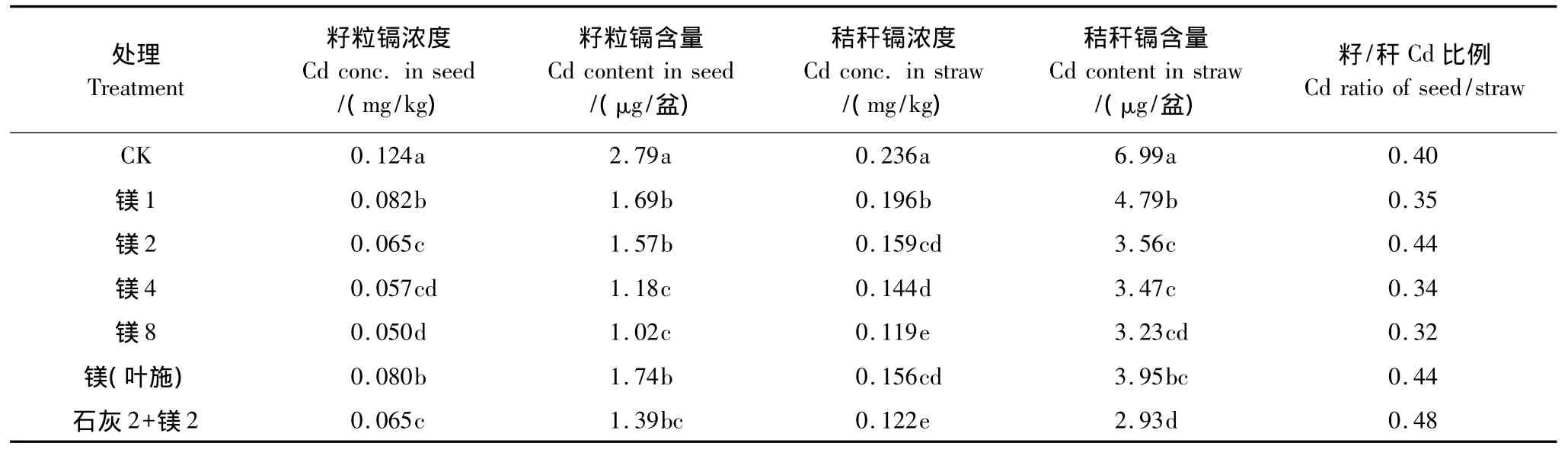
表4 不同硫酸镁用量(1,2,4,8 mmol/kg)对小麦吸收镉的影响Table4 Cd uptake by wheat as affected by different rates(1,2,4,8 mmol/kg)of manganese
总体来看,所有硫酸镁处理小麦籽粒和秸秆中的镉的浓度和吸收量都低于CK,Cd在小麦体内的分配为秸秆>籽粒,说明镁抑制了小麦对Cd的吸收,并减少了镉从秸秆向籽粒的转移,这与蓝兰[7]等人的研究结果一致。在其它作物上,一些研究小组Kashem和 Kawai[12]报道了施用Mg肥能解除日本芸苔属菠菜Cd的毒害,增加菠菜产量。Hermans等人[13]发现了Mg解除Cd对植物毒害的几个基因,指出Mg对Cd的解毒作用部分归咎于Mg能维持植物体内的Fe浓度,提高植物抗氧化能力,从而解除毒害和/或保护光合作用器官。此外,在动物上,Mg也发挥了卓越的解除Cd毒害的作用[14-16]。
2.2.3 不同用量的硫酸锰与石灰配合施用对小麦吸收镉的影响
在石灰的基础上施用硫酸锰或在硫酸锰的基础上施用石灰都进一步降低了秸秆籽粒中的Cd浓度与含量(石灰2+锰0.8处理除外)(表5)。在石灰的基础上施用硫酸锰对小麦籽粒Cd的降低幅度为4%—23%,并随硫酸锰用量的增加而降低;在硫酸锰的基础上添加石灰,比单施硫酸锰降低了19%的籽粒Cd浓度和18%的吸收量。小麦叶面喷施硫酸锰对籽粒Cd浓度降低的效果与石灰2+锰0.4处理相当,表明叶面喷施锰比土施锰更能有效降低小麦籽粒的Cd浓度和吸收量。当硫酸镁与硫酸锰配合施用或当硫酸镁、硫酸锰与石灰一起施用时,对籽粒Cd浓度和吸收量的降低达到最低值。硫酸镁+硫酸锰比单施其中任何一种物质都能进一步降低小麦籽粒的Cd浓度,并且能够明显的降低籽杆Cd的比例,表现出正交互作用。石灰、硫酸镁和硫酸锰三种物质同时施用时,小麦籽粒Cd浓度和吸收量显著或明显低于单施任何一种物质,说明了这些物质配合施用对降低小麦吸收Cd具有显著正交互作用。
不同处理对秸秆中Cd浓度和含量的影响与籽粒的情况有所不同。就不同硫酸锰用量而言,两个低量硫酸锰处理(石灰2+锰0.1和石灰2+锰0.2)比单独使用硫酸锰降低了小麦秸秆中的Cd浓度和吸收量,比单施石灰增加了秸秆中的Cd浓度和吸收量。在石灰2+锰0.2处理基础上继续增加硫酸锰用量,秸秆中的Cd浓度与吸收量却显著增加。叶面喷施硫酸锰对秸秆的Cd浓度和吸收量的影响与单独土施硫酸锰相当。镁与锰,石灰、镁与锰的配合施用对小麦秸秆中的Cd浓度和吸收量的影响与籽粒的情况相反。镁与锰配合施用比单独施用硫酸锰或石灰增加了秸秆中的Cd浓度和吸收量;石灰2+镁2+锰0.2处理比镁2+锰0.2、石灰2+锰0.2或石灰2+镁2处理进一步增加了秸秆中的Cd浓度和吸收量。这些结果显示,几种物质的配合施用有利于显著降低小麦籽粒中的Cd浓度与吸收量,但显著增加秸秆中的Cd,阻止了Cd从秸秆向籽粒的转移,产生最低的籽/秆Cd比例,以石灰2+镁2+锰0.2处理籽/秆Cd比例为最小(0.24),其次为石灰+锰0.4处理(0.27)。
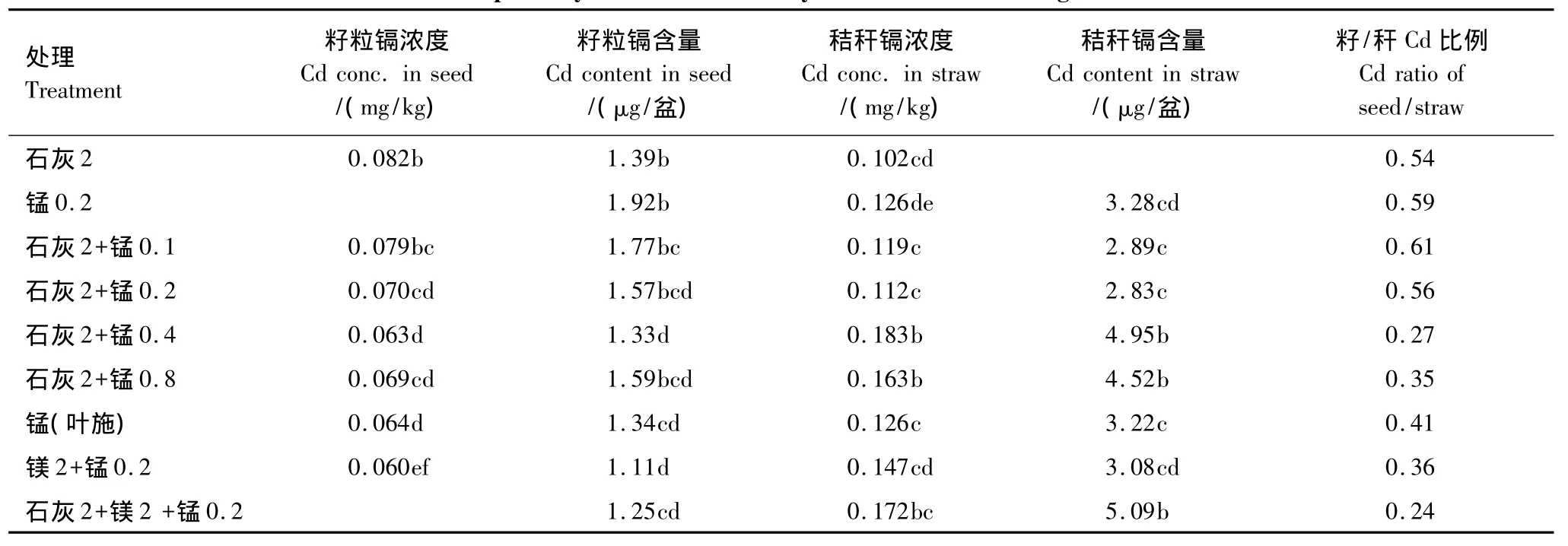
表5 不同用量的硫酸锰与石灰配合施用对小麦吸收镉的影响Table5 Cd uptake by wheat as affected by different rates of manganese and lime
硫酸锰对小麦吸收Cd的抑制作用,可能归因于Mn2+施入土壤后,在好气条件下被氧化成氧化锰(MnO2),在氧化锰的形成过程中土壤中的一些金属离子被共沉淀,形成的锰氧化物对金属离子如Pb2+,Ni2+,Cu2+,Zn2+,Cd2+,Mn2+等具有很强的吸附能力[17-20]。这些被锰氧化物持留的 Cd2+,难以被 NH4OAc 置换出来[17],从而降低土壤Cd的有效性。小麦叶面喷施硫酸锰也能有效降低小麦对Cd的吸收,抑制Cd向籽粒的转移,表明Mn抑制小麦对Cd吸收机理可能同时发生在土壤和植株体内。
2.2.4 不同用量的活性炭与石灰配合施用对小麦吸收镉的影响
在施用石灰的基础上添加不同用量的环保专用活性炭,能够显著降低小麦籽粒和秸秆的Cd浓度和吸收量(表6)。从籽粒镉浓度来看,单施石灰和活性炭+石灰处理间的差异不显著,但高量活性炭处理籽粒Cd浓度最低。小麦籽粒的Cd吸收量变化趋势与Cd浓度一致,并且3个处理间的差异不显著,但都显著低于CK。施用活性炭降低了小麦籽/杆Cd的比例,高量活性炭处理优于低量处理。活性炭因具有巨大的比表面积、较高的孔隙结构及丰富的表面官能团,对金属离子吸附速率快、容量大而广泛用于废水处理,对镉的最大吸附量可高达38.03 mg/g[21]和47.85 mg/g[22]。通常认为,对镉的吸附起决定作用的是其表面化学性质,离子交换在吸附过程中发挥了重要的作用。本试验所用活性炭为环保专用碳经Na2S处理,对土壤Cd的吸附和钝化效果应优于普通活性炭。
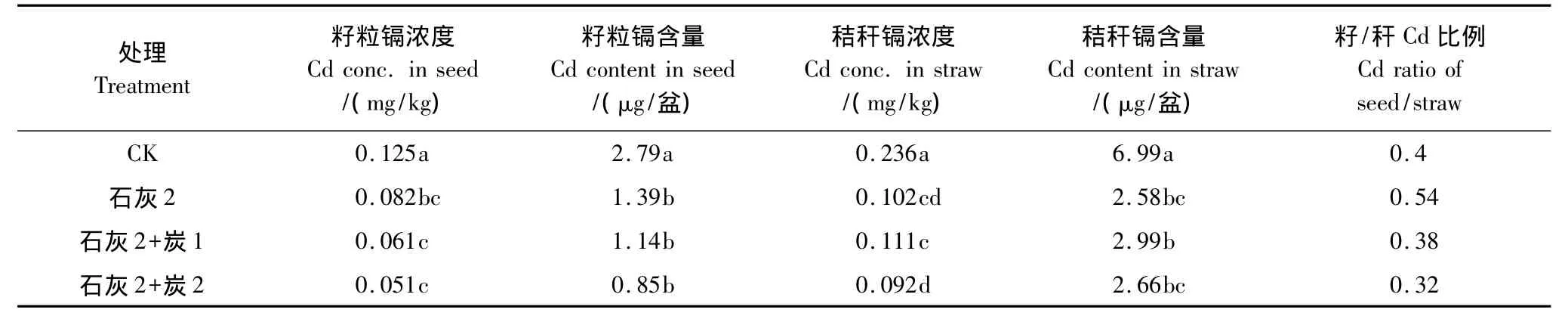
表6 不同用量的活性炭与石灰配合施用对小麦吸收镉的影响Table6 Cd uptake by wheat as affected by different rates(0.67,1.34g/kg)of activated carbon and lime
3 结论
单独或配合施用适量石灰、硫酸镁、硫酸锰、环保专用活性炭都能有效降低小麦对Cd的吸收,使小麦籽粒镉浓度低于国家限量指标。施用硫酸镁能显著降低小麦籽粒和秸秆Cd浓度和吸收量,其效果随用量增加而增加。低量硫酸锰能有效降低小麦籽粒和秸秆Cd浓度,高量反而增加小麦对Cd的吸收。石灰、活性炭单独施用或配合施用都能抑制小麦对Cd的吸收和Cd向籽粒的转移,但籽/杆Cd比例却随石灰用量呈明显的上升趋势。施用硫酸镁能同时减少小麦籽粒和秸秆中的Cd,而硫酸锰能明显增加小麦秸秆中Cd的含量,却抑制了Cd向籽粒的转移。叶面喷施硫酸镁降低小麦吸收镉的效果与土施硫酸镁相当,但叶面喷施硫酸锰却比土施硫酸锰显著降低了小麦籽粒中的镉浓度与吸收量。硫酸镁与硫酸锰,或石灰、硫酸镁和硫酸锰3种物质配合施用,对小麦籽粒镉浓度和吸收量的降低表现出明显的正交互作用,对抑制小麦体内镉从秸秆向籽粒的转移具有显著效果。
[1] Wang L Z.Study on the effects of cadmium on the seedling growth and the physiological indexes of wheat in seedling stage.Journal of Anhui Agricultural Sciences,2008,36(9):3529-3530.
[2] Zhu Z Y,Hao Y F,Li Y J,Liu Y J,Duan Y Q,Li Q,Guo J.Effects of Cd2+on chlorophyii content in flag leaf and grain yield of wheats.Acta Agriculturae Nucleatae Sinica,2011,25(5):1010-1016.
[3] Renella G,Landi L,Nannipieri P.Degradation of low molecular weight organic acids complexed with heavy metals in soil.Geoderma,2004,122(2/4):311-315.
[4] Strawn D G,Sparks D L.Effects of soil organic matter on the kinetics and mechanisms of Pb(II)sorption and desorption in soil.Soil Science Society of America Journal,2000,64(1):144-156.
[5] Li Y,Zhang G Y,Hi H J,Wei J.Effects of organic acids on speciation of lead in rhizosphere and their phytotoxicity.Ecology and Environment,2004,13(2):164-166.
[6] Appel C,Ma L.Concentration,pH,and surface charge effects on cadmium and lead sorption in three tropical soils.Journal of Environmental Quality,2002,31(2):581-589.
[7] Lan L,Yu H,Feng W Q,Qin Y S,Hu K,Liao M L,Wang CQ,Tu SH.Effects of secondary,micro-and beneficial elements on wheat growth and cadmium uptake.Journal of Soil and water Conservation,2010,24(5):54-58.
[8] Zhu Q H,Huang D Y,Liu G S,Zhu G X,Zhu H H,Liu SP.Effects and mechanism of lime and sepiolite on remediation of Cd contaminated soils.Journal of Soil and water Conservation,2009,23(1):111-116.
[9] Zhan SJ,Yu H,Feng W Q,Qin Y S,Liao M L,Wang CQ,Tu SH.Effects of different organic material and lime on wheat grow and cadmium uptake.Journal of Soil and Water Conservation,2011,25(2):214-217,231-231.
[10] Tessir A,Campbell P G C,Bission M.Sequential extraction procedure for the speciation of particulate trace metals.Analytical Chemistry,1979,51(7):844-851.
[11] Xiong M L.Cadium adsorption and availability as affected by soil liming.Research of Environmental Sciences,1994,7(1):35-38.
[12] Kashem A,Kawai S.Alleviation of cadmium phytotoxicity by magnesium in Japanese mustard spinach.Soil Science and Plant Nutrition,2007,53(3):246-251.
[13] Hermans C,Chen J,Coppens F,InzéD,Verbruggen N.Low magnesium status in plants enhances tolerance to cadmium exposure.New Phytologist,2011,92(2):428-436.
[14] Matovic'V,Plamenac Bulat Z,Djukic'-Cosic'D,Soldatovic'D.Antagonism between cadmium and magnesium:a possible role of magnesium in therapy of cadmium intoxication.Magnesium Research,2010,23(1):19-26.
[15] Matovic'V,Buha A,Bulat Z,Dukic'-C'osic'D.Cadmium toxicity revisited:focus on oxidative stress induction and interactions with zinc and magnesium.Archives of Industrial Hygiene and Toxicology,2011,62(1):65-76.
[16] Matovic'V,Buha A,Bulat Z,Dukic'-C'osic'D,Miljkovic'M,Ivaniševic'J,Kotur-Stevuljevic'J.Route-dependent effects of cadmium/cadmium and magnesium acute treatment on parameters of oxidative stress in rat liver.Food and Chemical Toxicology,2012,50(3/4):552-557.
[17] Tu SH,Racz GJ,Goh TB.Transformation of synthetic birnessite as affected by pH and manganese concentration.Clay and Clay Minerals,1994,42(3):321-330.
[18] Koyanaka H,Koyanaka S,Liang R,Uchida A.Manganese oxide(Mn2O3)as adsorbent for cadmium.Journal of Japan Society on Water Environment,2000,23(2):116-121.
[19] Turner A,Le Rouxa SM,Millwarda GE.Adsorption of cadmium toiron and manganese oxidesduring estuarine mixing.Marine Chemistry,2008,108(1/2):77-84.
[20] Fu G M,Allen H E,Cowan C E.Adsorption of cadmium and copper by manganese oxide.Soil Science,1991,152(2):72-81.
[21] Rao M R,Ramesh A,Rao G P C,Seshaiah K.Removal of copper and cadmium from the aqueous solutions by activated carbon derived from Ceiba pentandra hulls.Journal of Hazardous Materials,2006,129(1/3):123-129.
[22] Wang Z F,Zheng Z,Luo X Z,Zhang J B,Nie E,Pu JM.Adsorption of cadmium from aqueous solutions on activated carbon prepared from S.Alterniflora.Environmental Chemistry,2011,30(6):1081-1086.
参考文献:
[1] 王连臻.镉对小麦苗期生长及生理指标的影响.安徽农业科学,2008,36(9):3529-3530.
[2] 朱志勇,郝玉芬,李友军,刘英杰,段有强,李强,郭甲.镉对小麦旗叶叶绿素含量及籽粒产量的影响.核农学报,2011,25(5):1010-1016.
[5] 李瑛,张桂银,李洪军,魏静.有机酸对根际土壤中铅形态及其生物毒性的影响.生态环境,2004,13(2):164-166.
[7] 蓝兰,喻华,冯文强,秦鱼生,胡坤,廖鸣兰,王昌全,涂仕华.不同中微量及有益元素对小麦吸收镉的影响.水土保持学报,2010,24(5):54-58.
[8] 朱奇宏,黄道友,刘国胜,朱光旭,朱捍华,刘胜平.石灰和海泡石对镉污染土壤的修复效应与机理研究.水土保持学报,2009,23(1):111-116.
[9] 詹绍军,喻华,冯文强,秦鱼生,廖鸣兰,王昌全,涂仕华.不同有机物料与石灰对小麦吸收镉的影响.水土保持学报,2011,25(2):214-217,231-231.
[11] 熊明礼.石灰对土壤吸附镉行为及有效性的影响.环境科学研究,1994,7(1):35-38.
[22] 王正芳,郑正,罗兴章,张继彪,聂耳,浦君梅.互花米草活性炭对镉的吸附.环境化学,2011,30(6):1081-1086.
