不同作物两苗同穴互作育苗的生理生态效应
2013-09-07李伶俐郭红霞黄耿华李彦鹏杨铁钢
李伶俐,郭红霞,黄耿华,李彦鹏,杨铁钢,*
(1.河南农业大学农学院,郑州 450002;2.河南省农业科学院经济作物研究所,郑州 450002;3.河南省农业科学院农业部中原地区作物栽培科学观测试站,郑州 450002;4.濮阳市经济作物工作站,濮阳 457000)
实现作物工厂化育苗、机械化移栽,对提高土地资源和光热资源利用率,减少农作用工和劳动强度,提高农作生产效益,推动农作规模化、专业化生产,增加作物产量,确保粮食安全,稳定粮、棉、油、菜生产有重要的意义。但是,在作物工厂化育苗中所用轻型基质重复使用,则会导致作物幼苗素质降低,死苗严重,如不断换新基质则成本高而浪费,改用穴盘土壤基质育苗,则因为棉花、油菜、番茄等作物根系团聚力差,幼苗脆弱,起苗时根系和土壤不抱团,极易断苗伤根;另外,在机械化移栽中发现成捆无土作物幼苗分苗时易造成断根和脱根,而且无土幼苗没有根重极性,机栽喂苗下落立棵不稳而影响移栽质量。为了解决上述两个问题,我们进行了多方面探索研究,其中考虑到作物根系分泌物对作物生长、微生物分布、养分平衡有重要的影响,其化感自毒作用是连作障碍的主要因素[1-4],分析了重复所用育苗基质中的根系分泌物,结果发现其中2,4-二叔丁基苯酚、2,6-二叔丁基苯酚、邻苯二甲酸二丁酯和9—16碳烯酸甲酯等几种物质的含量比育苗初次使用基质中的明显增加,有研究表明,2,4-二叔丁基苯酚、邻苯二甲酸二丁酯等物质在土壤中积累会明显降低作物光合能力,抑制作物生长,降低抗病性[5-9],为此,用土壤做育苗基质,并基于不同作物间作可以提高作物的根系活力,增加对磷、铁等营养元素的吸收利用,改善土壤微生物结构和土壤酶活性,提高叶片光合能力,减轻自毒作用[10-21]等研究结果,又考虑到禾本科作物根系发达且柔韧性好,和棉花、油菜、花生等作物同穴互作育苗可能会提高幼苗根系团聚力,实现幼苗根系团聚抱钵不散落,确保起苗和移栽时幼苗根系完好无损,并形成根重极性,有利于机械移栽幼苗下落立稳,提高移栽质量,在没有前人进行不同作物两苗同穴互作育苗研究的情况下,尝试性的进行了棉花、油菜、番茄、花生、烟草和牡丹分别与小麦、玉米、谷子和高粱两苗同穴互作育苗的首创试验,结果发现,两苗同穴互作育苗既实现了作物幼苗根系团聚,同时提高了目的作物幼苗的素质。因此,本文在上述试验研究结果基础上,进一步研究了不同作物两苗同穴互作育苗土壤微生物、酶活性和根系分泌物等生理生态效应,以探明其提高目的作物幼苗素质的机理,为不同作物工厂化育苗技术提升和机械化移栽提供科学依据。
1 材料与方法
1.1 试验设计
采用532×280mm2具有200方形孔,孔径24mm,下孔径10mm,透水口孔径0.8mm,孔高45mm的育苗盘,用孔径5mm左右的筛子筛过的壤土做基质,播种前每盘用等量的水浇湿润,每孔播入目的作物和互作作物种子各一粒,设6个目的作物组,每个目的作物组设单作对照,试验处理分组及组合如下表1,每处理10盘,育苗期间每3d浇1次自制的营养液,塑料温棚温度控制在20—30℃,自然光照。
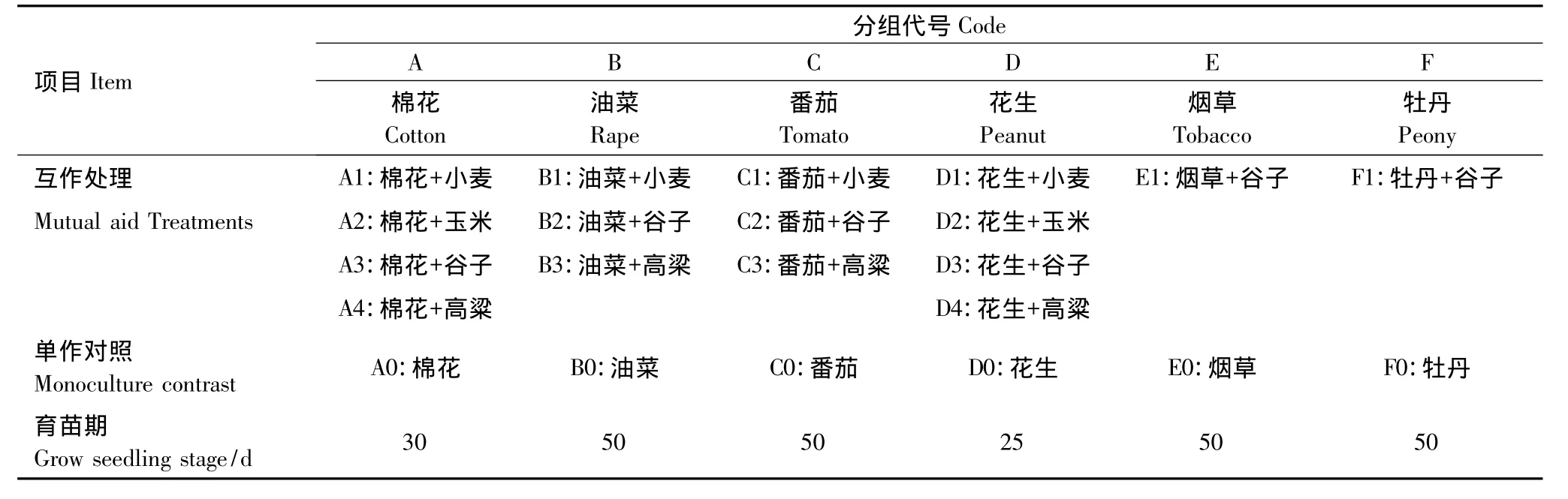
表1 不同作物两苗同穴互作育苗试验处理Table1 Experimental treatments of companion-planted grow seedlings of two crops in the same hole
1.2 测定项目与方法
1.2.1 土壤微生物
达育苗苗龄后,每处理取育苗钵土混合样,细菌采用牛肉膏蛋白胨琼脂平板表面涂布法;真菌采用马丁氏(Martin)培养基平板表面涂布法;放线菌采用改良高氏一号合成培养基平板表面涂布法[22]。结果以每g鲜土所含数量表示(CFU/g)。
1.2.2 土壤酶活性
脱氢酶活性采用TTC还原法测定;转化酶采用硫代硫酸钠滴定法测定;脲酶采用苯酚钠 比色法;多酚氧化酶采用邻苯三酚比色法[23-24]。
1.2.3 根系分泌物
(1)根系分泌物提取 参照刘秀芬等[25]的方法加以改良。两苗互作育苗达育苗苗龄后轻轻拔出幼苗,收集根际土混合样,风干研细,过4O目筛子,从中取出500g于三角瓶中,加入1000mL的80%乙醇,置于摇床上震荡24 h(180 r/min、25℃),真空过滤(漏斗上放置两层滤纸),然后在旋转蒸发仪上浓缩至10mL左右(42℃),收集蒸发后的溶液,同时做10个重复,最后把这10个重复的浓缩提取液混合后再浓缩至干,待蒸发皿冷却后加入甲醇5mL,再将蒸发皿中的甲醇入10 mL容量瓶中,再加入3 mL甲醇于蒸发皿中,倾入10 mL容量瓶中,并用甲醇定容至刻度,再用0.22μm有机滤膜过滤后,用于高效液相色谱法(HPLC)分析。
(2)仪器与试剂 用美国DIONEX公司ultimate3000高效液相色谱仪。2,4-二叔丁基苯酚、2,6-二叔丁基苯酚、邻苯二甲酸二丁酯和9-16碳烯酸甲酯标品分析纯均由北京飞美斯分析科技有限公司提供;甲醇,色谱纯,美国迪马公司(Dimark);水为超纯水,台湾艾科超纯水机制。
(3)色谱条件 参考陈会明等[26]的方法加以改良。色谱柱:Acclaim 120 C18反相柱 (5μm,250×4.6 mm),温度:室温(约25℃);检测器:紫外检测器;检测波长:选择保存波长190—400nm紫外光谱图。流动相梯度:0—5min内甲醇梯度变化范围为95%—100%;5—20 min内甲醇保持在100%;20—25 min内甲醇梯度变化范围为100%—95%;25—30 min内甲醇浓度保持在95%。流速:1.0 mL/min。
(4)标准溶液的配制 准确称取2,4-二叔丁基苯酚、2,6-二叔丁基苯酚、邻苯二甲酸二丁酯和9—16碳烯酸甲酯各0.5000g置于500 mL容量瓶中,用甲醇定容后振荡均匀,即得4种物质质量浓度各为1 g/L的混合标准储备液,再逐级用甲醇稀释至所需要的浓度。
1.2.4 ATP 含量
参照生物发光法(荧光素-荧光素酶法)[27]叶片组织ATP提取采用pH值7.8的甘氨酰-甘氨酸缓冲系统热提取法[28](内含1 mmol/L EDTA、1 mmol/LMgSO4、1 mg/mL 牛血清蛋白),标准 ATP 采用 Sigma Co.产品,取纯化的ATP溶于20 mmol/L Tris pH值7.8的缓冲液,作为ATP标准液,用FG-3000型发光光度计测定,整个测定在25℃恒温水浴下进行。
1.2.5 根系活力
每盘取5株棉苗根系,用TTC方法测定[29]。
1.2.6 可溶性糖含量
每盘取5株棉苗叶片活样,用蒽酮比色法测定[29]。
1.2.7 幼苗质量
每盘取棉苗10株,分别测量根鲜重、侧根数、苗,求平均值。
1.2.8 离床存活期和缓苗期
离床存活期为起苗后用保鲜袋封存保质存活天数;缓苗期为幼苗移栽大田后至出现新叶的天数。
2 结果分析
2.1 不同作物两苗同穴互作育苗对基质土壤微生物数量的影响
土壤微生物是土壤生物化学特性的重要组成部分,在土壤营养物质转化、有机质分解、有害物降解、肥力修复等方面起着重要的作用,并且可以产生生长刺激素和抗生素,从而抑制病原微生物生长,刺激作物生长[30]。细菌、放线菌和真菌是土壤微生物的三大主要类群,表2可见,不同作物两苗同穴互作育苗均比目的作物单作育苗显著影响了育苗土壤微生物数量和结构,表现育苗土壤中细菌和放线菌数量均显著提高,真菌数显著降低。有研究指出,当土壤中真菌数量及其组成比例提高时土传病害发生的危险性增加,细菌和放线菌数量及其组成比例增加,土传病害发生概率下降[31]。李云鹏等[32]研究发现根际放线菌数量增加、放线菌数量与真菌数量的比值提高,作物抗病性增强。可见,两苗互作育苗降低了育苗土壤真菌数量,增加了细菌和放线菌数量及其组成比例,有利于降低作物幼苗发病率。
2.2 不同作物两苗同穴互作育苗对基质土壤酶活性的影响
土壤微生物活性与土壤酶活性密切相关,土壤酶活性的大小可敏感地反映土壤中生化反应的方向和强度,脱氢酶、转化酶活性增强有利于土壤中有机质的转化;土壤脲酶直接参与土壤中含氮有机化合物的转化,其活性增强可提高土壤氮素供应水平;土壤中性磷酸酶能促进土壤中有机磷化合物水解,生成作物所能利用的无机态磷[33]。表3可见,各处理组不同作物两苗同穴互作育苗均比目的作物单作育苗显著提高了所测土壤酶活性,这为土壤营养环境的改善提供了生化基础。
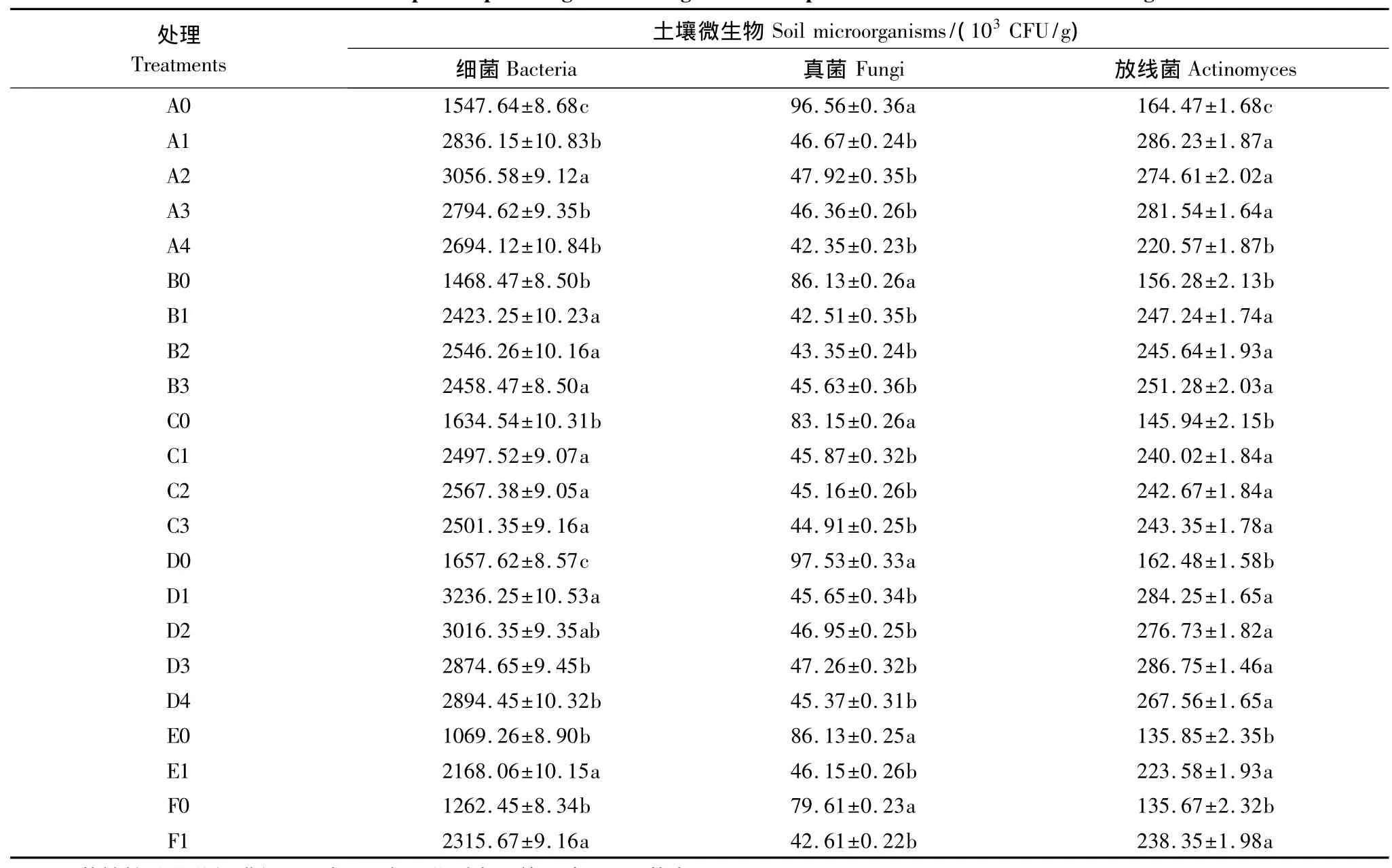
表2 不同作物两苗同穴互作育苗对基质土壤微生物数量的影响Table2 Effects of companion-planted grow seedlings of two crops in the same hole on soil microorganisms

表3 不同作物两苗同穴互作育苗对基质土壤酶活性的影响Table3 Effects of companion-planted grow seedlings of two crops in the same hole on activity of soil enzymes
2.3 不同作物两苗同穴互作育苗对基质土壤根系分泌物含量的影响
根系分泌物是植物与土壤进行物质、能量与信息交流的重要载体物质。2,4-二叔丁基苯酚、2,6-二叔丁基苯酚、邻苯二甲酸二丁酯、邻苯二甲酸二(2-乙基己基 )酯(DEHP)等化感物质浓度不同对作物生长、土壤酶活性和土壤微生物有不同程度的影响[5-9,34-36]。表4可见,各处理组互作育苗均比目的作物单作育苗显著降低了基质土壤中所测根系分泌物的含量。不同作物两苗互作育苗使育苗土壤中这些化感物质含量降低,可能是互作育苗提高了育苗土壤酶活性(表1),改善了育苗土壤微生物数量和结构(表2),从而促进了根系分泌物的分解代谢有关。

表4 不同作物两苗同穴互作育苗对基质土壤根系分泌物含量的影响(nmol/kg)Table4 Effects of companion-planted grow seedlings of two crops in the same hole on content of root secretion in matrix soil
2.3 不同作物两苗同穴互作育苗对目的作物某些生理特性的影响
表5可见,各处理组互作育苗均比目的作物单作育苗显著提高了目的作物的根系活力、叶片可溶性糖和ATP含量,棉花、油菜、番茄、花生分别与小麦、谷子互作育苗所测生理指标较与玉米、高粱互作的高,互作较好。目的作物根系活力强,叶片可溶性糖和ATP含量高,说明育苗期间目的作物长势好、光合能力高、储备能量多,为其移栽成活快缓苗奠定了物质和能量基础。
2.4 不同作物两苗同穴两苗互作对目的作物幼苗素质的影响
表5可见,不同作物两苗同穴互作育苗均比目的作物单作育苗显著提高了目的作物的根鲜重、侧根数和苗干重,离床存活期延长,缓苗期缩短,其中和小麦、谷子互作育苗,目的作物幼苗素质表现最好,根鲜重、侧根量、苗干重提高的最多,与根系活力、叶片可溶性糖含量、ATP含量提高最多相一致(表4);和玉米、高粱互作育苗,目的作物幼苗素质略有改善,苗干重、根鲜重、根系活力、叶片可溶性糖含量、ATP含量的提高量低于和小麦、谷子互作的,其主要原因可能是玉米、高粱长势较强所至。

表5 不同作物两苗同穴互作育苗对目的作物生理特性的影响Table5 Effects of companion-planted grow seedlings of two crops in the same hole on physiological characteristics of target crops
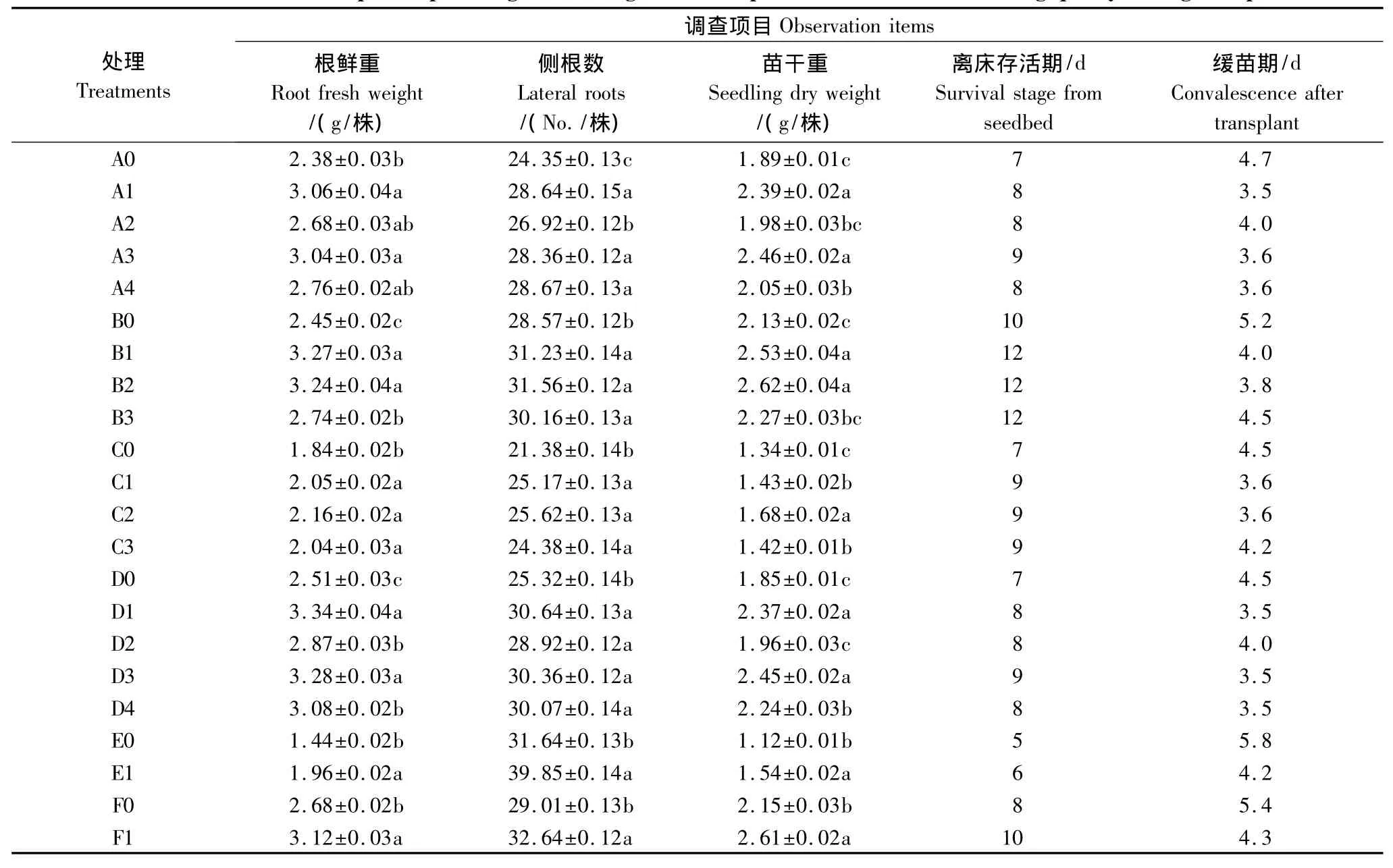
表6 不同作物两苗同穴互作育苗对目的作物幼苗素质的影响Table6 Effects of companion-planted grow seedlings of two crops in the same hole on seedling quality of target crops
3 小结与讨论
从本试验结果综合看,不同作物两苗同穴互作育苗提高了目的作物的根系活力、叶片可溶性糖含量和ATP含量,增加了目的作物幼苗根重、苗重和侧根数,使目的作物育苗离床存活期延长,栽后缓苗期缩短,表现互作促进,其中棉花+小麦、棉花+谷子、油菜+谷子、番茄+小麦、番茄+谷子、花生+小麦、花生+谷子、牡丹+谷子、烟草+谷子表现较好(前期试验中由于玉米籽大而出苗力强、长势旺,严重抑制了油菜、番茄、牡丹、烟草小籽作物出苗和生长,小麦、高粱也由于长势相对强抑制了牡丹、烟草的出苗和生长,所以本试验中小籽作物没有设这些互作育苗),这可能与互作育苗明显改善了育苗土壤微生物数量和结构,使土壤细菌和放线菌数量显著增加,真菌数显著降低(表2),并显著提高了育苗土壤酶活性(表3),促进了土壤养分转化和有害物质的分解,显著减少了育苗土壤中2,4-二叔丁基苯酚、2,6-二叔丁基苯酚、邻苯二甲酸二丁酯和9—16碳烯酸甲酯等根系分泌物的积累量(表4),增加了土壤养分,改善了单作自毒的土壤生态环境有关。不同作物间作可以提高作物的根系活力,改善土壤微生物结构和土壤酶活性,提高叶片光合能力,减轻自毒作用[10-21],刘广才等[37]研究表明小麦/玉米间作系统具有明显的氮、磷、钾养分吸收优势,促进了小麦和玉米增产优势,郝艳茹等[38]研究小麦/玉米间作以后,根系分泌有机酸的种类明显增加,根系体积和根活性吸收面积增加,这些研究结果直接或间接的支持了本试验结果。
大多数作物都存在根系分泌物等化感物质自毒作用,且研究还发现自毒作用经常是作物产生连作障碍的一个主要原因[7]。有研究表明,根系分泌物积累产生化感抑制作用,导致土壤微生物数量下降、多样性结构破坏,土壤微生物群落功能多样性下降,土壤酶活性降低,土壤生态系统恶化,进而显著抑制植株的生长,表现作物根系活力降低、叶片SOD活性及叶绿素含量下降,叶片中的MDA含量和细胞质膜相对透性增加,使植物抗病性下降[6-9,34-36,]。孙秀山等[1]研究报道,花生随连作年限增加,土壤和根际真菌数量显著增加,细菌和放线苗数量显著减少,土壤中碱性磷酸酶、蔗糖酶和脲酶活性逐年降低,花针期土壤及根际真菌显著抑制土壤磷酸酶活性;土壤细菌、土壤放线菌显著促进土壤磷酸酶活性,而根际真菌显著抑蔗糖酶和脲酶活性,土壤细菌和放线菌显著促进脲酶活性,本研究互作育苗比单作育苗土壤细菌和放线菌数量显著增加,真菌数量显著下降,土壤酶活性显著提高,得到孙秀山等研究结果的支持。李彦斌等[39]研究证明棉秆腐解物抑制棉花种子萌发,延长种子出苗时间,影响棉花植株生长,并随着秸秆腐解时间延长和秸秆还田数量增加,棉花叶净光合速率、气孔导度、蒸腾速率和胞间CO2浓度降低,李艳宾等[40],研究棉秆腐解物中含有邻苯二甲酸二丁酯等24种化感物质,也证明棉秆腐解提取物对棉花种子萌发及幼苗生长产生抑制作用,这说明棉花也存在化感自毒。王玉洁等[41]研究了2,6-二叔丁基苯酚和邻苯二甲酸二甲酯2种化感物质在50—500μmol/L浓度范围内处理茄子幼苗,茄子株高、茎粗、地上地下部干鲜重和根系活力都受到明显的抑制,丙二醛含量及超氧自由基产生速率增大,且随处理浓度的增加和处理时间的延长抑制作用加强。周宝利等[31]研究表明,以0.5 mmoL/L浓度邻苯二甲酸二甲酯处理茄子,增加了茄子根际微生物总量,降低真菌数量、增加了细菌和放线菌数量。李轶修[3]研究表明邻苯二甲酸二丁酯对茄子种子萌发及幼苗的生长具有低浓度促进,高浓度抑制作用.本试验不同作物两苗同穴互作育苗显著降低了2,4-二叔丁基苯酚、2,6-二叔丁基苯酚、邻苯二甲酸二丁酯和9—16碳烯酸甲酯物质在土壤中的积累,可能减轻了自毒危害,有利于幼苗生长。试验所测根系分泌物含量降低,土壤酶活性提高,可能与两苗互作育苗改善了土壤微生物结构,提高了土壤微生物活性,促进了有害物质的分解有关。至于试验处理中不同作物两苗同穴互作育苗为什么可以优化土壤微生物结构,提高土壤微生物活性,可能与各处理的不同作物根系物质友好互补有关,因为作物种类以及营养状况等都可影响根系分泌物的数量和种类,进而影响到土壤微生物数量和酶活性。
[1] Sun X S,Feng H S,Wan SB,Zuo X Q.Changes of main microbial strains and enzymes activities in peanut continuous cropping soil and their interactions.Acta Agronomica Sinica,2001,27(5):617-621.
[2] Wu F Z,Zhao F Y.Study on root exudates and continues cropping obstacle.Journal of Northeast Agricultural University,2003,34(1):114-118.
[3] Zheng Y P,Wang CB,Huang SZ,Wu ZF.Research on relieving peanut continuous cropping stress.Chinese Journal of Oil Crop Sciences,2008,30(3):384-388.
[4] Li Y B,Liu J G,Li F,Liu S J,Geng W.Allelopathic effect of aqueous extract of cotton.Chinese Journal of Eco-Agriculture,2008,16(6):1489-1494.
[5] Geng G D,Zhang SQ,Cheng Z H.A study on the allelopathy of dibutyl phthalate and its mechanism.Acta Agriculturae Universitatis Jiangxiensis,2008,30(6):1045-1048.
[6] Qin H,Lin X G,Chen R X,Yin R.Effects of DEHP on dehydrogenase activity and microbial functional diversity in soil.Acta Pedologica Sinica.2005,42(5):829-834.
[7] Li Y X,Zhou B L,Liu N,Fu Y W.Effect of different concentration dibutyl phthalate(DBP)on he germination and Seedlings growth of three vegetable Seeds.Acta Agriculturae Boreali Occidentalis Sinica,2009,18(2):217-220,224-224.
[8] Zhang X H,Zhang E H,Chai Q,He Q Z.Ren B C.Effects of phenol,2,4-bis(1,1-dimethylethyl)on photosynthetic characters of hops seedling.Journal of Gansu Agricultural University,2006,41(5):50-54.
[9] Zhang X H,Wang X X,Zhang E H.Allelopathic effect of phenol 2,4-bis(1,1-dimethylethyl)on microorganism of Hamulus lupulus L.(hops)rhizospheric soil.Chinese Journal of Eco-Agriculture,2008,16(6):1606-1608.
[10] XU Q,Cheng Z H,Lu T,Xie B Y.Effects of Intercropping on growth,nutrient uptake and rhizosphere Environment in plants.Acta Botanica Borea1ioccidentalia Sinica,,2010,30(2):0350-0356.
[11] Jiao N Y,Ning T Y,Zhao C,Hou L T,Li Z J,Li Y J,Fu G Z.Han B.Effect of nitrogen application and planting pattern on N and P absorption and use in maize-peanut intercropping system.Acta Agronomica Sinica,2008,34(4):706-712.
[12] Song Y N,Petra M,Zhang F S,Bao X G,Li L.Effect of intercropping on bacterial community composition in rhizoshpere of wheat.Acta Ecologica Sinica,2006,26(7):2268-2274.
[13] Song Y N,Wang H,Li C J,Zhang F S.Effect of wheat/soybean intercropping on Fe accumulation and mobilization in root apoplast.Acta Agronomica Sinica,2000,26(7):462-466.
[14] Zuo Y M,Zhang F S.Effects of peanut mixed cropping with different gramineous plants on apoplast iron accumulation and reducing capacity of peanut.Chinese Journal of Applied Ecology,2004,15(2):221-225
[15] Zuo Y M,Liu Y X,Zhang FS.Effects of improved iron nutrition of peanut intercropped with maize on carbon and nitrogen metabolism and nitrogenfixing of peanut nodule.Acta Ecologica Sinica,2004,24(11):2584-2589
[16] Zuo Y M,Li X I,Cao Y P,Zhang F S.The effects of peanut intercropped with maize on iron nutrition efficiency of peanut and intercropping advantage in sandy soil in henan province.Acta Agronomica Sinica,2003,29(5:658-663.
[17] Jiao N Y,Zhao C,Ning T Y,Hou L T,Fu Z G,Li Z J,Cheng M C.Effects of maize-peanut intercropping on economic yield and light response of photosynthesis.Chinese Journal of Applied Ecology,2008,19(5):981-985.
[18] Macario B J,Sara A F,Elsa V Z.Chemical characterization of root exudates from rice(Oryza sativa)and their effects on the chemotactic Response of endophytic bacteria.Plant and Soil,2003,249:271-277.
[19] Chai J,Huang P,Huang G B.Effect of intercropping on soil microbial and enzyme activity in the rhizosphere.Acta Pratacultural Sinica,2005,14(5):105-110.
[20] Ghosh P K,Manna M C,Bandyopadhyay K K.Interspecifie interaction and nutrient Use in soybean/sorghum inter-cropping system.Agronomy Journal,2006,98(4):1097-1108.
[21] Yadav RS,Tamfdar JC.Influence of organic and inorganic phosphorus supply on the maximum secretion of acid phosphatase by plants.Biology and Fertility of Soils,2001,34(3):140-143.
[22] Xu G H,Zeng H Y.The Guide of Soil Microorganisms Analytical Method.Beijing:Agriculture Press,1986.
[23] Guan SY.Soil Enzyme and Its Research Methods.Beijing:Chinese Agricultural Press,1987.
[24] Zhou L K.Soil Enzymology.Beijing:Science Press,1988.
[25] Liu X F,Ma R X,Yuan G L,Sun SE.Study on isolation,identification and bioactivity of allelochemicals in rhizolsphere.Acta Ecologica Sinica,1996,16(1):1-10.
[26] Chen H M,Wang C,Wang X,Liu J,Zhang F.Analysis of Phthalates in Cosmetics by HPLC-DAD.Journal of Instrumental,2004,23(4):61-64.
[27] Wang W G.Experiment Guide of Plant Physiology.Shanghai:Science and Technology Press,1985:115-118.
[28] Wang W G,Gu J B.Comparison of the methods for extracting ATP from plant leaves.Plant Physiology Communications,1986(5):54-55.
[29] Li H S.Plant physiological and biochemical experiment principle and technology.Experiment Beijing:Higher Education Press,2004.
[30] Wang Q,Tan Y F,Sun JX,Shi C J.Effect of reclaimed water on soil microorganism community in greenbelt.Grassland and Turf,2010,30(5):25-29.
[31] Zhou B L,Sun C Q,Han L,Wu J X,Lei B.Effects of Dibutyl Phthalate on Amount of Verticllium dahliae and Soil Microbial Composition in Rhizosphere of Eggplant.Acta Agriculturae Boreali-Sinica,2010,25(6):150-153.
[32] Li Y P,Zhou B L,Li Z P,Yin Y L,Jiang L L,Fu Y W.Relationships between grafted eggplant’s verticillium-resistance and rhizosphere soil biological activity.Chinese Journal Ecology,2007,26(6):831-834.
[33] Yang Q H,Han J F,He D X.Effects of liquid filmon the quantity of microorganisms and activity of enzymes in cotton field.Acta Ecologica Sinica,2005,25(6):1312-1317
[34] Gao Z H,Zhang X Y,Ge H B,Deng L J.Modeling the obstacle effects of strawberry root exudates.P1ant Nutrition and Fertilizer Science,2008,14(1):189-193.
[35] Yin R,Lin X G,Wang SG,Zhang H Y.Influence of phthalic acid esters in vegetable garden soil on quality of capsicum fruit.Agro-Environment Protection,2002,2l(10:l-4.
[36] Guo Y L,Li M H,Wu H T,Yuan L,Huang JG.Effects of root exudates on growth and nutrients uptake of tobacco seedlings.Plant Nntrition and Fertilizer Science,2007,13(3):458-463.
[37] Liu G C,Yang QF,Li L,Sun JH.Intercropping advantage and contribution of above-and-below ground interactions in wheat-maize Intercropping.Acta Phytoecologica Siniac,2008,32(2):477-484.
[38] Hao Y R,Lao X R,Sun W H,Peng S L.Lnteraction of roots and rhizosphere in the wheat-maize intercropping system.Rural Eco-Environment,2003,19(2):18-22.
[39] Li Y B,Liu JG,Cheng X R,Zhang W,Sun Y Y.The allelopathic effects of returning cotton stalk to soil on the growth of succeeding cotton.Acta Ecologica Sinica,2009,29(9):4942-4948.
[40] Li Y B,Zhang Q,Wan C X,Gong M F,Zhang L L.Alleiopathy and chemical constituents of decomposing products from cotton stalk.Cotton Science,2009,21(6):497-502.
[41] Wang Y J,Yu J H,Zang Y,Zhu H.Effects of two allelochemicals on growth and physiological characteristics of eggplant seedlings.Jouranl of Agriculyural University,2007,42(3):47-50.
参考文献:
[1] 孙秀山,封海胜,万书波,左学青.连作花生田主要微生物类群与土壤酶活性变化及其交互作用.作物学报,2001,27(5):617-621.
[2] 吴凤芝,赵凤艳.根系分泌物与连作障碍.东北农业大学学报,2003,34(1):114-118.
[3] 郑亚萍,王才斌,黄顺之,吴正锋.花生连作障碍及其缓解措施研究进展.中国油料作物学报,2008,30(3):384-388.
[4] 李彦斌,刘建国,李凤,刘淑娟,耿伟.棉花植株水浸提液化感效应的研究.中国生态农业学报,2008,16(6):1489-1494.
[5] 耿广东,张素勤,程智慧.邻苯二甲酸二丁酯的化感作用及其作用机理研究.江西农业大学学报,2008,30(6):1045-1048.
[6] 秦华,林先贵,陈瑞蕊,尹睿.DEHP对土壤脱氢酶活性及微生物功能多样性的影响.土壤学报,2005,42(5):829-834
[7] 李轶修,周宝利,刘娜,付亚文.邻苯二甲酸二丁酯对3种蔬菜作物种子萌发及幼苗生长的影响.西北农业学报,2009,18(2):217-220,224-224.
[8] 张新慧,张恩和,柴强,何庆祥,任宝仓.2,4-二叔丁基苯酚对啤酒花幼苗光合特性的影响.甘肃农业大学学报,2006,41(5):50-54.
[9] 张新慧,王霞霞,张恩和.2,4-二叔丁基苯酚对啤酒花根际土壤微生物数量的化感效应研究.中国生态农业报,2008,16(6);1606-1608.
[10] 徐强,程智慧,卢涛,谢宝英.间作对植株生长及养分吸收和根际环境的影响.西北植物学报,2010,30(2):0350-0356.
[11] 焦念元,宁堂原,赵春,侯连涛,李增嘉,李友军,付国占.施氮量和玉米-花生间作模式对氮磷吸收与利用的影响.作物学报,2008,34(4):706-712.
[12] 宋亚娜,Petra M,张福锁,包兴国,李隆.小麦/蚕豆,玉米/蚕豆和小麦/玉米间作对根际细菌群落结构的影响.生态学报,2006,26(7):2268-2274.
[13] 宋亚娜,王贺,李春俭,张福锁.小麦大豆间作对大豆根系质外体铁库累积与利用的影响.作物学报,2000,26(7):462-466.
[14] 左元梅,张福锁.不同禾本科作物与花生混作对花生根系质外体铁的累积和还原力的影响.应用生态学报,2004,15(2):221-225
[15] 左元梅,刘永秀,张福锁.玉米/花生混作改善花生铁营养对花生根瘤碳氮代谢及固氮的影响.生态学报,2004,24(11):2584-2589
[16] 左元梅,李晓林,曹一平,张福锁.河南省沙区玉米花生间作对花生铁营养效率及间作优势的影响.作物学报,2003,29(5):658-663.
[17] 焦念元,赵春,宁堂原,侯连涛,付国占,李增嘉,陈明灿.玉米-花生间作对作物产量和光合作用光响应的影响.应用生态学报2008,19(5):981-985.
[19] 柴强,黄鹏,黄高宝.间作对根际土壤微生物和酶活性的影响研究.草业学报,2005,14(5):105-110.
[22] 许光辉,郑洪元.土壤微生物分析方法手册.北京:农业出版社,1986.
[23] 关松荫.土壤酶及其研究法.北京:中国农业出版社,1987.
[24] 周礼恺.土壤酶学.北京:科学出版社,1988.
[25] 刘秀芬,马瑞霞,袁光林,孙思恩.根际区他感化学物质的分离,鉴定与生物活性的研究.生态学报1996,16(1):1-10
[26] 陈会明 王超 王星,刘娟,张帆.高效液相色谱二极管阵列检测器测定化妆品中的6种酞酸酯.分析测试学报,2004,23(4):61-64.
[27] 王维光.植物生理学实验手册.上海:科学技术出版社,1985:115-117.
[28] 王维光,顾俭本.从叶片中提取ATP方法的比较.植物生理学通讯,1986,(5):54-55.
[29] 李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2004.
[30] 王 齐,谭一凡,孙吉雄,师春娟.中水灌溉绿地对土壤微生物数量的影响.草原与草坪,2010,30(5):25-29.
[31] 周宝利,孙传齐,韩琳,武建霞,雷斌.邻苯二甲酸二丁酯对茄子根际土壤黄萎菌数量及土壤微生物组成的影响.华北农学报,2010,25(6):150-153.
[32] 李云鹏,周宝利,李之璞,尹玉玲,姜玲玲,付亚文.嫁接茄的黄萎病抗性与根际土壤生物学活性的关系.生态学杂志,2007,26(6):831-834.
[33] 杨青华,韩锦峰,贺德先.液体地膜覆盖对棉田土壤微生物和酶活性的影响.生态学报,2005,25(6):1312-1317.
[34] 高志华,张学英,葛会波,郑丽锦.草莓根系分泌物障碍效应的模拟研究.植物营养与肥料学报,2008,14(1):189-193.
[35] 尹睿,林先贵,王曙光,张华勇.农田土壤中酞酸酯污染对辣椒品质的影响.农业环境保护,2002,2l(10:1-4.
[36] 郭亚利,李明海,吴洪田,袁玲,黄建国.烤烟根系分泌物对烤烟幼苗生长和养分吸收的影响.植物营养与肥料学报,2007,13(3):458-463.
[37] 刘广才,杨祁峰,李隆,袁玲,黄建国.小麦/玉米间作优势及地上部与地下部因素的相对贡献.植物生态学报,2008,32(2):477-484.
[38] 郝艳茹,劳秀荣,孙伟红,彭少麟.小麦/玉米间作作物根系与根际微环境的交互作用.农村生态环境,2003,19(2):18-22.
[39] 李彦斌,刘建国,程相儒,张伟,孙艳艳.秸秆还田对棉花生长的化感效应.生态学报,2009,29(9):4942-4948.
[40] 李艳宾,张琴,万传星,龚明福,张利莉.棉秆腐解物的化感作用及其主要化学成分分析.棉花学报,2009,21(6):497-502.
[41] 王玉洁 郁继华 张韵,朱虹.两种化感物质对茄子生长及幼苗生理特性的影响.甘肃农业大学学报,2007,42(3):47-50.
