马尾松人工林火烧迹地不同恢复阶段中小型土壤节肢动物多样性
2013-09-07杨大星杨茂发尚小丽
杨大星,杨茂发,徐 进,尚小丽
(贵州大学昆虫研究所,贵州山地农业病虫害重点实验室,贵阳 550025)
土壤动物作为生态系统的重要组成部分,具有驱动物质循环和能量流动,促进土壤形成、养分矿化及植被的演替等重要作用[1-5],因其能反映生境的优越程度,故常被用作环境健康状况的指示生物[6-8]。
贵州地处我国西南喀斯特地区的中心[9],自实行退耕还林政策以来,大量的农业用地转变为森林。因马尾松(Pinus massoniana)生长速度快、适应能力强,所以常被用作喀斯特地区退耕还林的首要栽培树种而被大面积种植,并产生了巨大的经济效益和重要生态作用。然而,贵州是森林火灾发生较为频繁的地区之一[10],火干扰通过改变区域生态系统格局与过程,进而影响其生态服务功能[11]。国外对此开展了一系列相关研究,发现火干扰明显影响土壤动物的组成与分布[12],火干扰对土壤动物的影响可以是直接的致死作用,也可以是通过破坏其生存环境而改变其分布格局,火干扰后土壤动物的恢复速度也因火烧强度和植被差异而存在不同[13-17]。从目前来看,国内有关于火干扰与土壤动物相互关系的研究较少,在喀斯特地区更是鲜见报道。
本研究在贵州南部选取火烧后马尾松人工林不同恢复阶段中小型土壤节肢动物为研究对象,通过对火烧后中小型土壤节肢动物多样性的调查研究,探明中小型土壤节肢动物在火烧后的恢复动态,掌握中小型土壤节肢动物在不同恢复阶段的分布规律,研究结果可为森林火灾后森林生态系统的恢复重建提供土壤节肢动物方面的科学依据。
1 研究区概况
研究区位于贵州省黔南州惠水县境内的大龙乡排楼村与干昌村之间,地理位置106°34'—106°38'E,26°01'—26°03'N,平均海拔1100m,属亚热带季风气候,年均气温13.6—19.6℃,无霜期240—320d,年平均降雨量1100—1400 mm,年平均相对湿度80%—83%[18];区内地形复杂,喀斯特地貌广泛分布,植被主要有马尾松、茅栗(Castanea seguinii)、枫香(Liquidambar formosana)、青冈栎(Cyclobalanopsis glauca)、火棘(Pyracantha fortuneana)、芒萁(Dicranopteris dichotoma)等,其中马尾松人工林是该区最具代表性的森林类型之一[19]。土壤类型主要有黄壤、石灰土和紫色土等。
2 样地选择与研究方法
2.1 样地选择
在研究区内选取火烧后1.5个月马尾松人工林迹地(RS1)和火烧后1.5a马尾松人工林迹地(RS2)作为实验样地,并在RS1附近选1个未被火烧的马尾松人工林作为对照(CK)。火烧迹地的恢复时间为第1次采样日期与森林火灾发生日期的时间间隔。所选择的3个样地均为退耕还林后的马尾松林,退耕还林时间为10a。于2011年10月(秋季)和2012年2月(冬季)两次对所选样地进行中小型土壤节肢动物调查。各样地的自然概况见表1。
2.2 样本采集与处理
每个样地随机选取6个采样点,每个采样点间隔5 m以上,取样面积分为10 cm×10 cm,按0—5 cm、5—10 cm和10—15 cm自上而下分3层取土,每层取土样各1份,装入自封袋内,并做相应的标记,以备室内分离。同时在每个样点采集适量土壤样本,分析土壤理化性质。
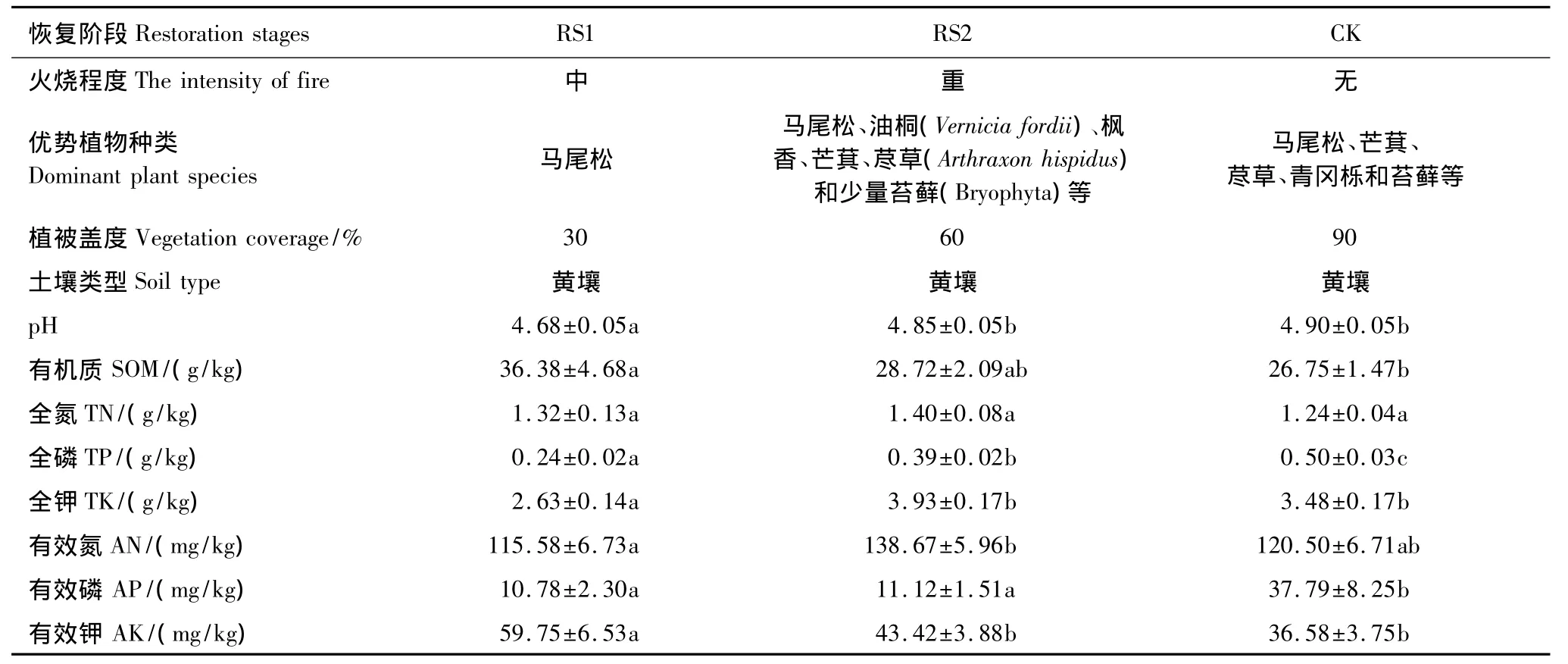
表1 不同恢复阶段自然概况(平均值±标准误,n=12)Table1 The natural conditions at different restoration stages(Mean±SE,n=12)
分离和鉴定 实验室内,用干漏斗法(Tullgren法)分离中小型土壤节肢动物,温度控制在35℃左右,分离时间为24 h。收集到的中小型土壤节肢动物根据《中国土壤动物检索图鉴》[20]、《蜱螨学》[21]和《幼虫分类学》[22]在体式显微镜(SMZ-168)和光学显微镜(B1 series)下对其进行分类鉴定,一般鉴定到科或属,并统计个体数量。
土壤理化分析 pH值采用电位法(水土比2.5∶1);有机质采用高温外热重铬酸钾氧化-容量法;全氮采用凯氏定氮法;全磷采用钼锑抗比色法;全钾采用火焰分光光度法;有效氮采用FeSO4-Zn还原-碱解扩散法;有效磷采用钼锑抗比色法;有效钾采用火焰分光光度法[23]。
2.3 数据分析处理
中小型土壤节肢动物群落多样性采用以下几个指数进行分析:

Pielou均匀度指数 E=H'/ln S
Simpson优势度指数 C=∑ Pi( )2
Margalef丰富度指数 D=(S-1)/ln N
式中,S为类群数,N为中小型土壤节肢动物总个体数,Pi为第i类群的百分比。
群落相似性

式中,j为两个群落共有的类群数,a和b分别为样地A和样地B的类群数,0<Cs<0.25为极不相似,0.25≤Cs<0.5为中等不相似,0.5≤ Cs<0.75为中等相似,0.75≤ Cs<1.0为极为相似。
对于服从正态分布的数据,采用单因素方差分析(One-way ANOVA)检验群落间的差异,若差异显著则用LSD法(方差齐性)和Tamhane法(方差不齐)进行多重比较。若数据不服从正态分布,则利用log(x+1)转换,如果仍不服从正态分布,则用Kruskal Wallis Test(H)进行非参数检验。使用Pearson系数(双尾检验)进行相关性分析。数据的分析处理在Microsoft Excel 2003和SPSS 16.0上进行,使用Origin8.5作图。
3 结果与分析
3.1 中小型土壤节肢动物的组成
两次调查共分离得到中小型土壤节肢动物15704只,隶属7纲13目89科134类(表2)。其中小奥甲螨属(Oppiella)和双节行军蚁属(Aenictus)为优势类群,占总个体数的35.93%;常见类群为符属(Folsomia)、盖头甲螨属(Tectocepheus)和奇属(Xenylla)等13类,占总个体数的45.95%;其余119类为稀有类群,占总个体数的18.12%。
不同样地间的中小型土壤节肢动物群落结构存在一定的差异。在 RS1中,优势类群为摇蚊科(Chironomidae)、小奥甲螨属和双节行军蚁属等4类,占RS1总个体数的80.07%;常见类群为拟上罗甲螨属(Epilohmannoides)、厚厉螨属(Pachylaelaps)和半懒甲螨属(Heminothrus)等4类,占RS1总个体数的9.41%;其余为稀有类群共40类,占RS1总个体数的10.51%。
在RS2中,双节行军蚁属和小奥甲螨属2类为优势类群,占RS2总个体数的34.27%;常见类群为奇属、爪甲螨属(Unguizetes)和符属等14类,占RS2总个体数的47.21%;其余为稀有类群共80类,占RS2总个体数的18.52%。
RS1的螨类与弹尾类数量的比值(A/C值)为15.83,高于RS2和CK的2.51和3.00。说明火烧干扰能在短时间内提高螨类相对数量,降低弹尾类相对数量。
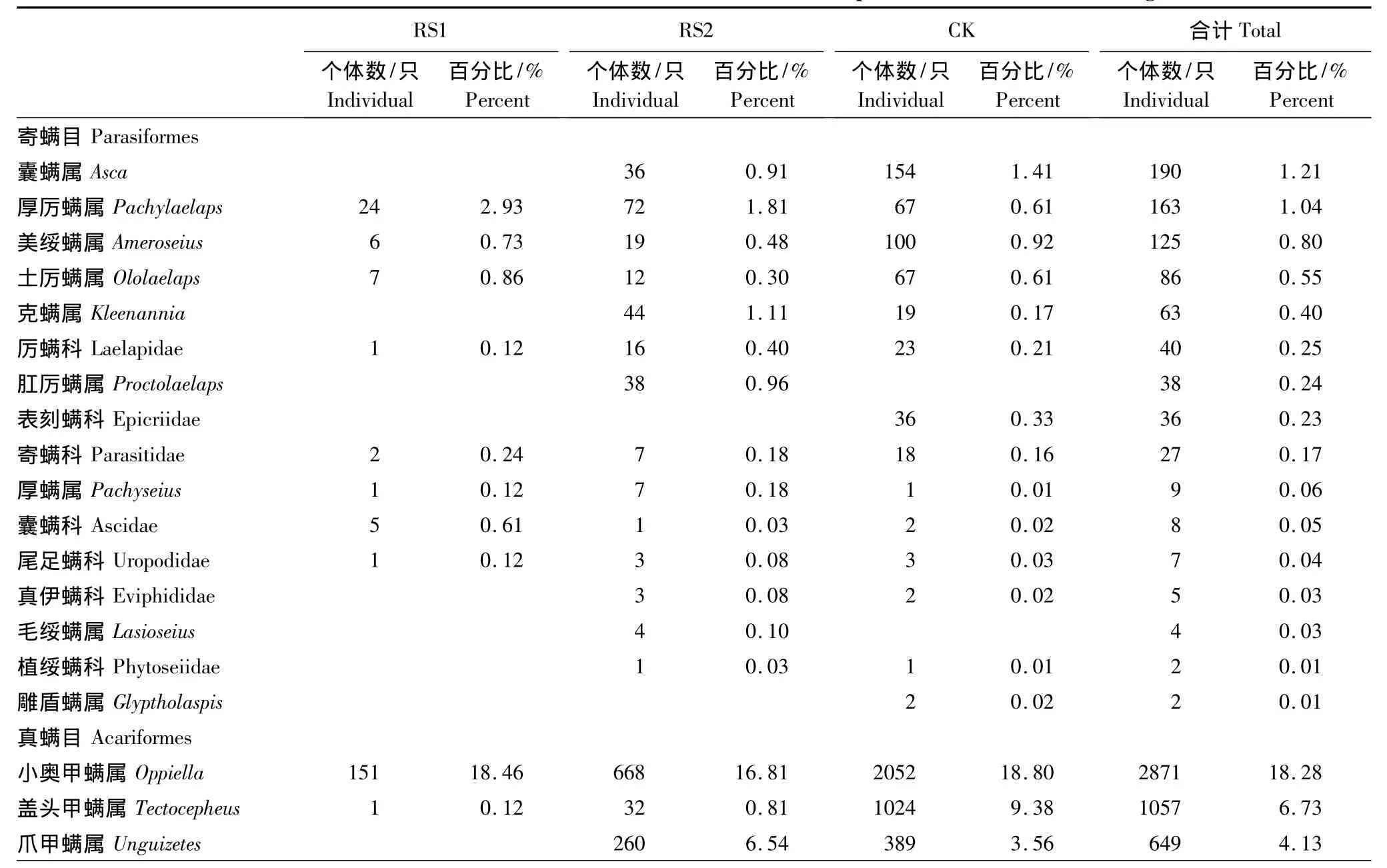
表2 不同恢复阶段中小型土壤节肢动物组成与数量Table2 The richness and abundance of soil meso-and microarthropod at different restoration stages
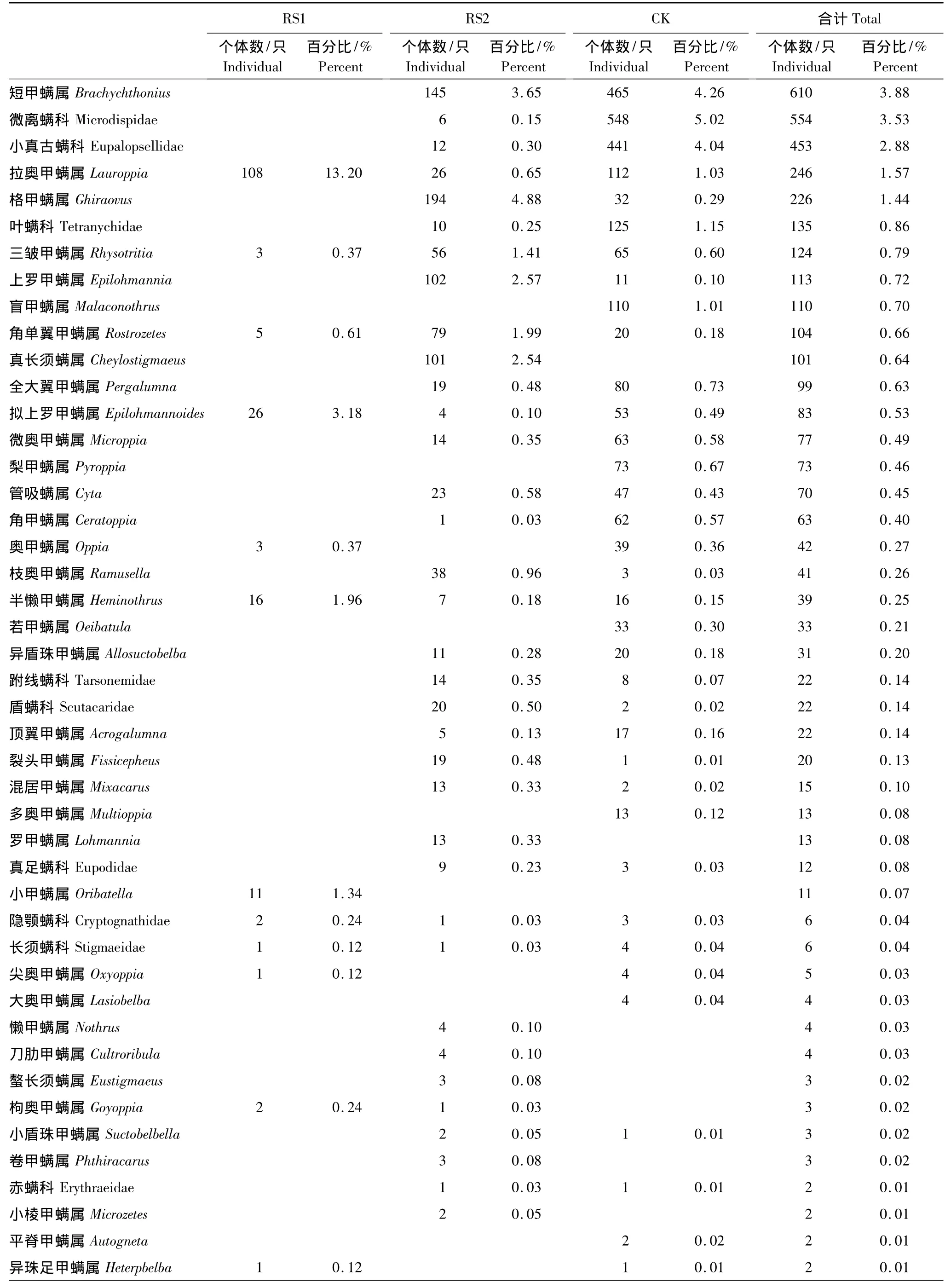
续表
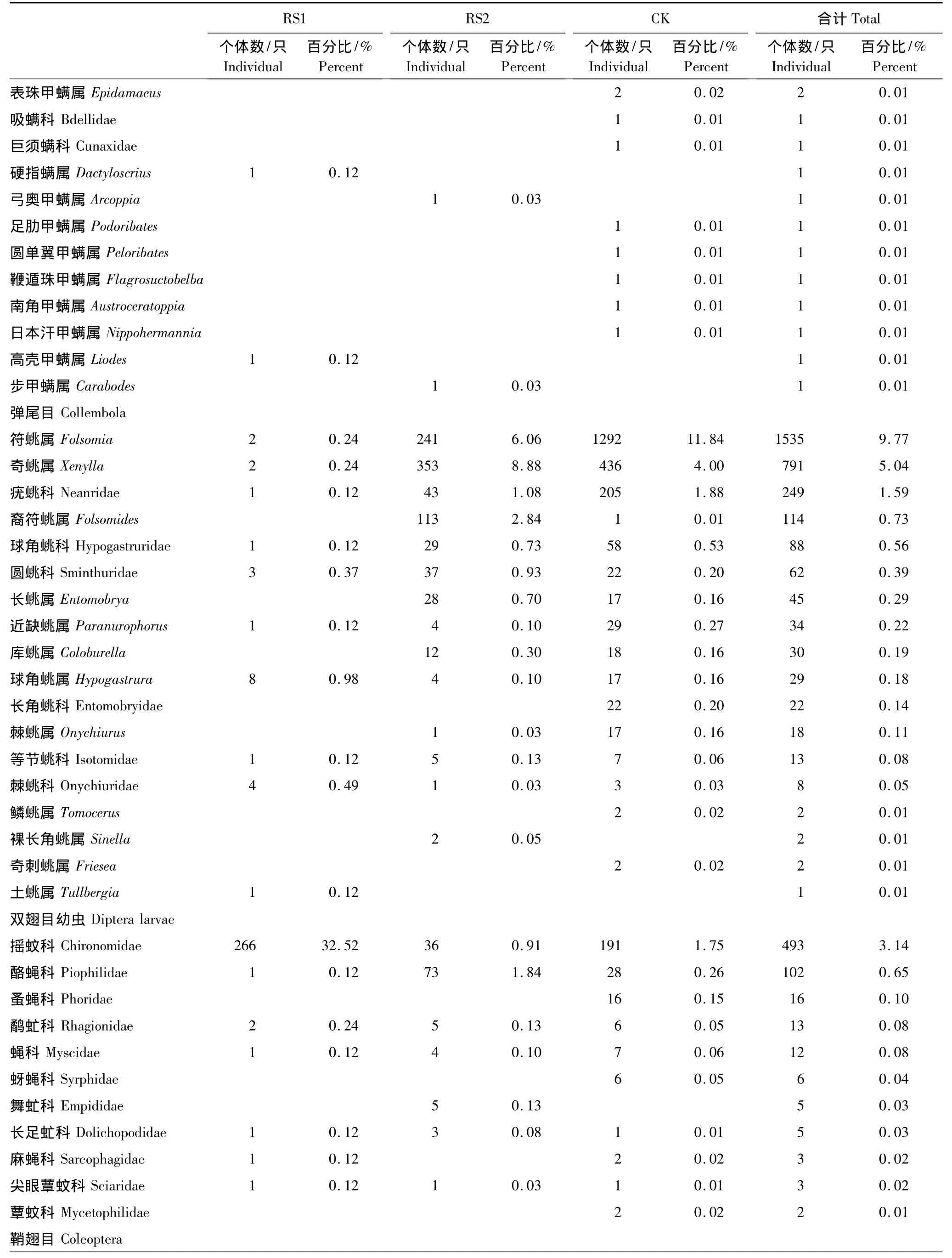
续表

续表
3.2 不同恢复阶段中小型土壤节肢动物垂直分布
中小型土壤节肢动物类群数和个体密度随土层深度增加而降低,但不同恢复阶段垂直分布情况有差异(图1)。秋季RS1和RS2类群百分比和密度百分比各层无显著差异;CK类群百分比(F=15.04,P<0.001)和密度百分比(F=7.09,P<0.01)垂直分布差异显著。冬季RS1类群百分比(F=10.16,P<0.01)和密度百分比(F=39.85,P<0.001)垂直分布差异显著;RS2类群百分比垂直分布差异显著(F=4.14,P<0.05),但密度百分比垂直分布差异不显著;CK类群百分比(F=283.25,P<0.001)和密度百分比(F=886.87,P<0.001)垂直分布差异显著。
很显然,在垂直分布表聚性上,RS1和RS2中小型土壤节肢动物的表聚性低于CK,而RS1和RS2垂直分布的差别不大,但季节波动较大。说明火烧干扰使中小型土壤节肢动物表聚性降低,垂直分布季节稳定性下降。
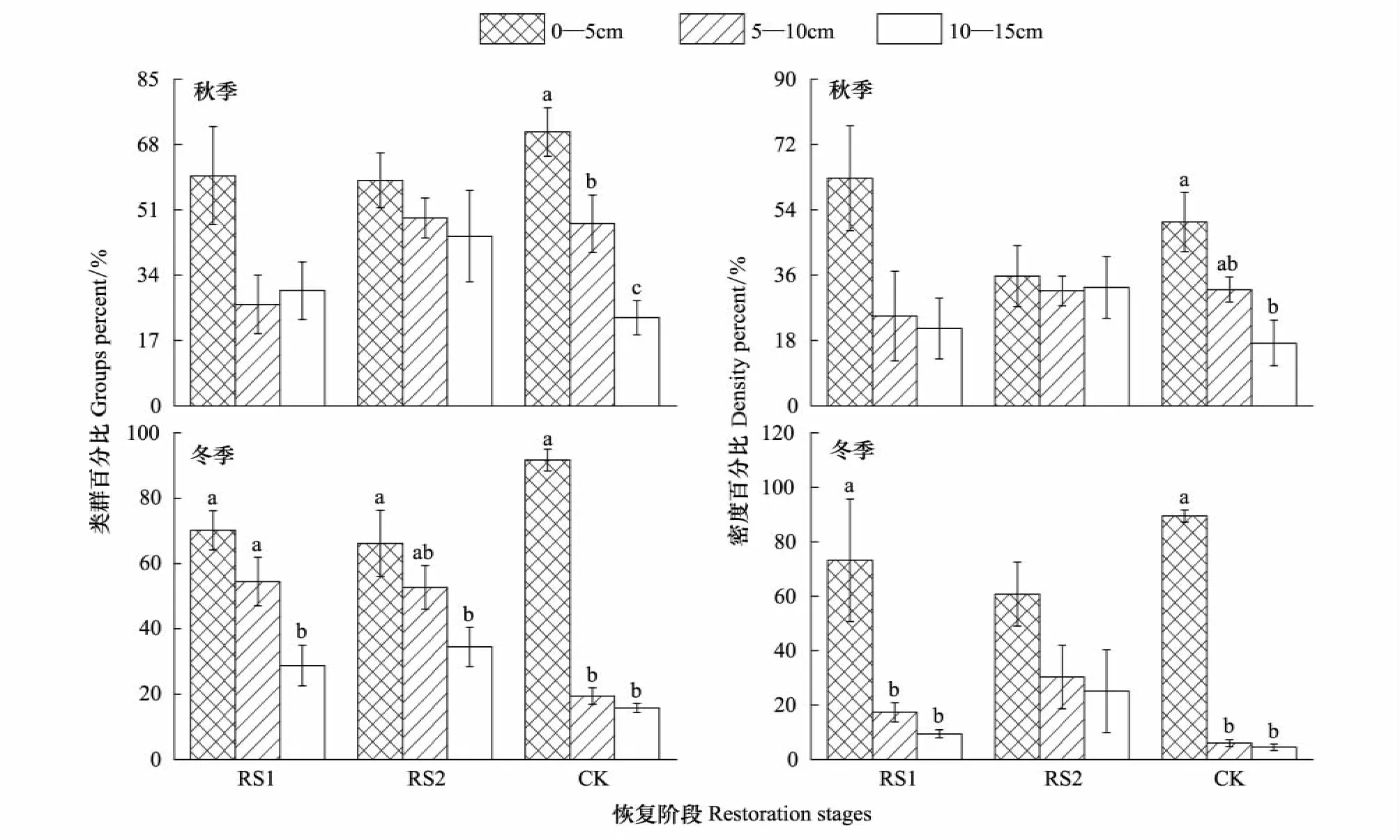
图1 不同恢复阶段中小型土壤节肢动物垂直分布(平均值±标准误)Fig.1 Vertical distribution of the group number and individual density of soil meso-and microarthropod at different restoration stages(Mean±SE)
3.3 不同恢复阶段中小型土壤节肢动物类群数和个体密度
不同恢复阶段中小型土壤节肢动物类群数和个体密度有所不同(图2)。秋、冬两季,CK和RS2类群数均无显著差异,但二者显著高于RS1(F秋=17.85,F冬=28.40,P<0.001);个体密度分布与类群数不同,秋季CK和RS2密度显著高于RS1(F=13.43,P<0.001),冬季CK显著高于RS1和RS2(F=23.04,P<0.001)。表明火烧干扰降低了中小型土壤节肢动物的类群数和个体密度,随着恢复时间的增加,马尾松人工林迹地中小型土壤节肢动物类群数和个体密度随之提高。
除RS1类群数外,不同恢复阶段类群数和个体密度冬季均显著增加,其中CK类群数和个体密度增加幅度最高,冬季类群数和个体密度分别为秋季的2.24倍和6.29倍。表明火烧迹地中小型土壤节肢动物群落的季节动态受恢复时间的影响。
3.4 不同恢复阶段中小型土壤节肢动物多样性
Shannon多样性指数、Margalef丰富度指数均表现为RS2最高,RS1最低;Pielou均匀度指数和Simpson优势度指数在不同季节有一定的差异(图3)。统计分析显示,秋季Simpson优势度指数(F=15.38,P<0.001)和Margalef丰富度指数(F=12.61,P<0.01)空间差异显著;冬季Shannon多样性指数(F=40.01,P<0.001)、Margalef丰富度指数(F=27.06,P<0.001)和Simpson优势度指数(F=16.23,P<0.001)空间差异显著,其余无显著空间差异性。不同恢复阶段间的差异情况见多重比较(图3)。
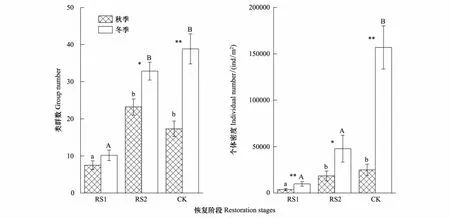
图2 不同恢复阶段中小型土壤节肢动物的水平分布(平均值±标准误)Fig.2 Horizontal distribution of soil meso-and microarthropod community at different restoration stages(Mean±SE)
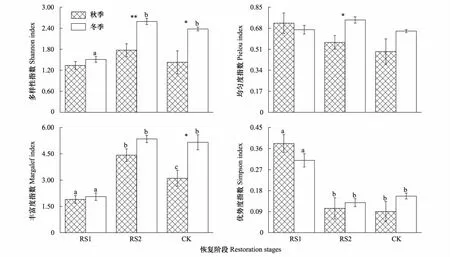
图3 不同恢复阶段中小型土壤节肢动物群落多样性(平均值±标准误)Fig.3 Diversities of soil meso-and micro arthropod community at different restoration stages(Mean±SE)
除RS1的Pielou均匀度指数和Simpson优势度指数外,不同恢复阶段多样性指数均表现为冬季高于秋季。其中,RS2的Shannon多样性指数(t=-3.86,P<0.001)和Pielou均匀度指数(t=-2.92,P<0.05),CK的Shannon多样性指数(t=-2.83,P<0.05)和Margalef丰富度指数(t=-3.02,P<0.05)季节差异显著。以上分析表明,不同恢复阶段中小型土壤节肢动物多样性存在差异,但不同季节差异程度有所不同。

表3 不同恢复阶段中小型土壤节肢动物相似性Table3 Similarities of soil meso-and microarthropod between different restoration stages
3.5 不同恢复阶段中小型土壤节肢动物群落相似性
秋季和冬季不同恢复阶段中小型土壤节肢动物相似性一致(表3),RS1与RS2之间的相似性最低,为中等不相似,RS2与CK之间的相似性最高,为中等相似。群落间相似性说明,随着恢复时间的增加,中小型土壤节肢动物群落间相似性增加。
在季节相似性上,RS2和CK均为中等不相似,RS1为极不相似。表明恢复时间短的群落结构稳定性最差,受季节变化的影响大,恢复时间长的群落结构稳定性较高,受季节变化的影响小。
3.6 土壤理化性质对不同恢复阶段中小型土壤节肢动物的影响
不同恢复阶段中小型土壤节肢动物与土壤理化性质的相关分析结果见表4。中小型土壤节肢动物类群数和个体密度与全钾显著相关(P<0.01),与其余土壤因子无显著相关。说明中小型土壤节肢动物的分布受全钾的影响较大。
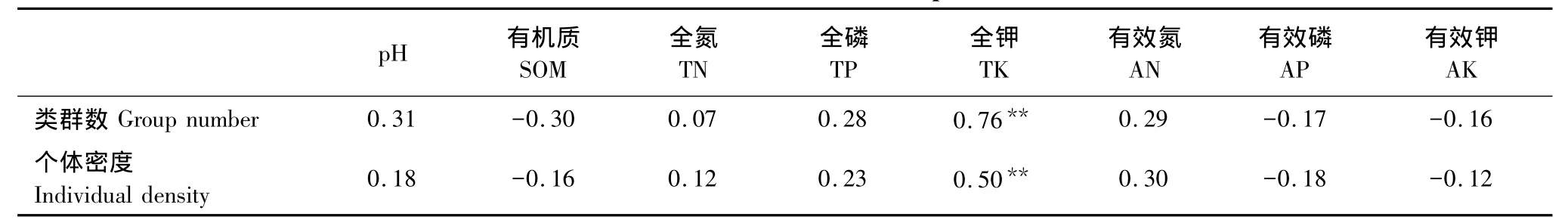
表4 中小型土壤节肢动物群落多样性与土壤因子的相关系数(n=36)Table4 Correlations between soil meso-and microarthropod diversities and soil factors
4 结论与讨论
4.1 中小型土壤节肢动物群落结构
已有的研究表明,螨类与弹尾类的比值(A/C)具有地带性特征,寒带<1,温带≈1,亚热带和热带>1[24]。本研究样地位于亚热带地区,马尾松人工林(CK)A/C值为3.00,符合普遍规律。与相近纬度的江西鹰潭地区的马尾松人工林(A/C=1.85)[25]相比,喀斯特马尾松人工林A/C值更高。从群落组成方面看,蚁类在东北大兴安岭火烧迹地为稀有类群[26],在本研究中为优势类群(表2),而在热带地区的火烧迹地中所占比例更大(29.56%)[27],随着纬度的降低,蚁类在土壤动物群落中所占的比例呈增加趋势。上述结果说明喀斯特地区土壤动物群落有较强的区域性特征。
不同土壤动物类群在不同恢复阶段的分布差异,一方面受自身的生物学特性的影响,另一方面,与不同恢复阶段为其提供的生存环境有关[28]。RS1、RS2和CK共有类群为34个,特有类群分别为5、21和27个,群落间物种组成差异较大。随着恢复时间的增加,不同恢复阶段特有类群数增加,群落间的相似性也表现出了相同的变化趋势。说明火烧干扰后马尾松人工林的恢复是一个生态环境不断改善的过程,恢复时间越长,群落结构越复杂。
RS1与RS2共有类群为37个,与CK共有类群为40个,群落间的共有类群数量并未与恢复时间、植被恢复状况表现出一致性,这可能与样地间的空间距离有关,RS1和CK两个样地相邻,与RS2空间距离较远,相对而言,RS1与CK之间物种的交流比与RS2更为频繁。因此,RS1和CK的物种组成更为接近,即空间距离近的土壤动物群落结构更为相似[29]。说明马尾松人工林迹地的生态恢复不仅与时间有关,周围生境的情况也有影响。
4.2 火灾对中小型土壤节肢动物多样性的影响
从本研究的结果来看,火烧干扰对中小型土壤节肢动物的影响在短时间内是负面的,森林火灾降低了中小型土壤节肢动物的类群数、个体密度和多样性,而随着恢复时间的增加,马尾松人工林火烧迹地中小型土壤节肢动物类群数、个体密度和多样性随之提高,这与以往的研究结果一致[26,30]。
植物是生态系统中的生产者,植被的类型、多样性和组成明显影响土壤动物的生存,植被类型越复杂土壤动物多样性程度越高[31-32]。RS1在火烧后林下植被和凋落物几乎完全消失,中小型土壤节肢动物的栖息环境和食物来源遭到严重破坏,一些以特定种类凋落物为食的中小型土壤节肢动物类群的生存和发展受到严重影响,多样性因此而下降。RS2在火烧干扰后,植被由马尾松林演替为针阔混交林,植被多样性提高,生存环境逐步得到改善,中小型土壤节肢动物类群数、个体密度和多样性随之提高。虽然RS2植物多样性与CK较为接近,但其植被盖度、凋落物和苔藓层厚度明显低于CK,这在一定程度上限制了中小型土壤节肢动物种类和数量的增长,然而植被状况差异并未使RS2多样性低于CK,这可能与人为干扰有关[33]。一般来说,人为干扰程度高的生境,土壤动物多样性较低[34],但适度的干扰有利于降低群落内的竞争排斥而维持较高的土壤动物多样性[35]。RS2靠近路边,可能存在适度干扰,使RS2多样性维持在较高水平,甚至超过了CK。
已有的研究显示土壤动物类群数和个体密度与pH值、有机质、全氮和全磷正相关,与全钾负相关[36-37]。由表1知火灾可以在一定程度上影响土壤理化性质,在本研究中,中小型土壤节肢动物的类群数和个体密度与土壤全钾显著正相关(P<0.01),与其它土壤因子相关性较低,说明在火烧迹地恢复过程中若能增加土壤全钾的输入可能会更有助于生态系统的恢复。
4.3 火灾对中小型土壤节肢动物季节动态的影响
RS1、RS2和 CK类群数在冬季分别提高了35.56%、41.73%和124.04%,个体密度分别提高了160.35%、159.31%和529.41%,火烧迹地中小型土壤节肢动物的季节增长速率接近,但远低于CK的增长速率,这可能与苔藓、凋落物有关。苔藓层通透性和保湿性好,具有独特的耐寒性,在冬季生长更为旺盛[38],能为土壤节肢动物提供丰富的食物资源和栖息环境;凋落物现存量则与土壤节肢动物群落密度显著正相关[39],秋冬季是凋落物增加的高峰期,由于不同生境植被盖度不同,凋落物的增加量也有不同。在苔藓植物和凋落物的影响下,火烧迹地土壤节肢动物在冬季的增长幅度也出现了差异。CK苔藓层厚,植被盖度高,凋落物在冬季增加量也相对较多,为土壤节肢动物提供了理想的越冬场所,冬季其类群数和个体密度增长速度也相应的高于RS1和RS2。RS2虽有少量苔藓,但呈斑块状分布,厚度薄,植被盖度也较CK低,冬季凋落物的增加量较少,苔藓和凋落物对中小型土壤节肢动物影响力有限,故在冬季RS2和RS1类群数和个体密度增长速度更为接近。以上分析说明,火烧干扰可通过改变中小型土壤节肢动物的生存环境而降低其季节敏感性。
喀斯特马尾松林迹地中小型土壤节肢动物类群数和个体密度冬季(2月)高于秋季(10月),与武夷山[40]和与鼎湖山类群数和个体密度季节变化规律相反(10月>2月)[41],与百花山[42]相似。气温和降水引起的土壤温湿度变化是导致土壤节肢动物产生季节差异的主要因素[43]。有研究显示,地表温度在14.3—24.3℃之间,是土壤动物生存最适宜的温度范围[44]。2011年夏秋两季贵州发生了严重的干旱,干燥炎热的气候条件可导致类群数和密度的下降。进入冬季后,降雨量增加,旱情缓解,中小型土壤节肢动物数量迅速增长,而一些昆虫进入土壤越冬也促进了冬季土壤节肢动物类群数和密度增加。
4.4 中小型土壤节肢动物垂直分布
拥有凋落物和(或)苔藓层的生境,土壤动物表聚性更为明显[29,31]。火烧干扰后,RS1林下植被已完全丧失,但部分未被烧死的中小型土壤节肢动物可在短时间内由土壤深层迁回地表[45],而少量活动能力较强物种的侵入(如蚂蚁)也能在一定程度上提高RS1表层土壤节肢动物的类群数和个体密度;虽然RS2有一定量的凋落物存在,但并未使RS2表聚性高于RS1,这可能与RS2存在人为活动干扰有关,人为活动干扰能降低土壤动物表聚性[36,46];相比之下,CK苔藓层厚,凋落物丰富,人为活动干扰小,中小型土壤节肢动物表聚性也最高。
致谢:野外调查得到了本校植物保护专业2008级本科生刘健锋、彭炳富和范迟飞同学的帮助,室内土壤节肢动物的分离得到了研究生吕召云和师沛琼同学的帮助,土壤甲螨的分类鉴定得到了研究生黄荣和梁文琴同学的帮助,杨洪老师在统计分析方面给予了诸多指导,郅军锐老师对写作给予帮助,在此一并致谢。
[1] Deyn G B,Raaijmakers C E,Zoomer H R,Berg M P,Ruiter P C,Verhoef H A,Bezemer T M,van der Putten W H.Soil invertebrate fauna enhances grassland succession and diversity.Nature,2003,422:711-713.
[2] Lavellea P,Decaënsb T,Aubertb M,Barota S,Blouina M,Bureaub F,Margerieb P,Moraa P,Rossic J P.Soil invertebrates and ecosystem services.Soil Invertebrates And Ecosystem Services,2006,42:3-15.
[3] González G,Seastedt T R.Soil fauna and plant litter decomposition in tropical and subalpine forests.Ecology,2001,82(4):955-964.
[4] Longcore T.Terrestrial Arthropods as Indicators of Ecological Restoration Success in Coastal Sage Scrub(California,U.S.A.).Restoration Ecology,2003,11(4):397-409.
[5] Höfer H,Werner H,Garcia M,Martius C,Franklin E,Römbke J,Beck L.Structure and function of soil fauna communities in Amazonian anthropogenic and natural ecosystems.European Journal of Soil Biology,2001,37(4):229-235.
[6] Barbercheck M E,Neher D A,Anas O,El-Allaf SM,Weicht T R.Response of soil invertebrates to disturbance across three resource regions in North Carolina.Environmental Monitoring and Assessment,2009,152:283-298.
[7] Fiscus D A,Neher D A.Distinguishing sensitivity of free-living soil nematode genera to physical and chemical disturbances.Ecological Applications,2002,12(2):565-575.
[8] Ruf A.A maturity index for predatory soil mites(Mesostigmata:Gamasina)as an indicator of environmental impacts of pollution on forest soils.Ecotoxicology and Environmental Safety,2005,9:290-299.
[9] Wei Y,Zhang JC,Yu Y C,Yu L F.Effects of Degraded Karst Vegetation Restoration on Soil Microbial Amount and Functional Diversity.Soils,2010,42(2):230-235.
[10] Xu SJ.Forecasting Forest Fire Occurrence from SatelliteMonitoring in Guizhou Province.Journal of West China Forestry Science,2011,40(2):98-100.
[11] Zhang X,Zhu J,Cui Y C,Huo D,Wang L L,Wu P,Chen J,Pan D Q,Yang C H.Influence of fire on a Pinus massoniana soil in a karst mountain area at the center of Guizhou Province,China.Acta Ecologica Sinica,2011,31(19):5809-5817.
[12] Dawes-Gromadzki Tracy Z.Short-term effects of low intensity fire on soil macroinvertebrate assemblages in different vegetation patch types in an Australian tropical savanna.Austral Ecology,2007,32:663-668.
[13] Malmström A.The importance of measuring fire severity—Evidence from microarthropod studies.Forest Ecology and Management,2010,260:62-70.
[14] Callaham Jr M A,Blair J M,Todd T C,Kitchen D J,Whiles M R.Macroinvertebrates in North American tallgrass prairie soils effects of fire,mowing,and fertilization on density and biomass.Soil Biology and Biochemistry,2003,35:1079-1093.
[15] Collett N.Short and long-term effects of prescribed fires in autumn and spring on surface-active arthropods in dry sclerophyll eucalypt forests of Victoria.Forest Ecology and Management,2003,182:117-138.
[16] Saint-Germain M,Larrivée M,Drapeau P,Fahrig L,Buddle C M.Short-term response of ground beetles(Coleoptera Carabidae)to fire and logging in a spruce-dominated boreal landscape.Forest Ecology and Management,2005,212:118-126.
[17] Wikars L O,Schimmel J.Schimmel Johnny.Immediate effects of fire-severity on soil invertebrates in cut and uncut pine forests.Forest Ecology and Management,2001,141:189-200.
[18] Xiao Y D,Ju H D,Zhang X Q,Ji P.Relationship between Fire-Danger Weather and Forest Fire in Qiannan Area.Scientia Silvae Sinicae,2011,47(10):128-133.
[19] Tian X L,Xia J,Xia H B,Ni J.Forest biomass and its spatial pattern in Guizhou Province.Chinese Journal of Applied Ecology,2011,22(2):287-294.
[20] Yin W Y.Pictorial Keys to Soil Animals of China.Beijing:Science Press,1998.
[21] Li L S,Li Y R.Acarology.Chongqing:Chongqing Press,1988.
[22] Zhong J M.Taxonomy of Insect Larva.Beijing:Agriculture Press,1990.
[23] Lu R K.Agricultural Chemical Analytical Methods for Soil.Beijing:China Agricultural Science and Technology Press,2000.
[24] Yin W Y.Soil Animals of China.Beijing:Science Press,2000.
[25] Liu M Q,Hu F,Li H X,Chen X Y,He Y Q.Soil Arthropod Communities Under Different Artificial Woodland Restored on Degraded Red Soil.Acta Ecologica Sinica,2002,22(1):54-61.
[26] Zhang X P,Zhang S H,Li J K.Eco-geographical analysis of soil animals in burned forest areas in Greater Hinggan Mountains.Geographical Research,2006,25(2):327-334.
[27] Yang X D.Comparison of the communities structure and seasonal changes in diversity of soil arthropod in tropical secondary forest,dry-rice land and fired remains.Acta Ecologica Sinica,2003,23(5):883-891.
[28] Yi L,You W H,Song Y C.Soil animal communities in the l itter of the evergreen broad-leaved forest at five succession stages in Tiantong.Acta Ecologica Sinica,2005,25(3):466-473.
[29] Wu D H,Zhang B,Bu Z Y,Chen P.The characteristics of community structure of soil mites from different habitats in Changchun area.Acta Ecologica Sinica,2006,26(1):16-25.
[30] Zhang SH,Zhang X P.Soil Animal Community Diversity in the Burned Areas of Great Xing'an Mountains,China.Chinese Journal of Applied and Environment Biology,2009,15(5):672-676.
[31] Huang X,Wen WQ,Zhang J,Yang WQ,Liu Y,Yan BG,Huang Y M.Soil Faunal Diversity Under typical alpine vegetationsin West Sichuan.Chinese Journal of Applied Ecology,2010,21(1):181-190.
[32] Lin Y H,Sun J B,Zhang F D.Characteristics of soil fauna community in forest floor at difierent climate zone.China.Acta Ecologica Sinica,2009,29(6):2938-2944.
[33] Ke X,Liang WJ,Yu WT,Xie R D,Weng CL,Yang Y M,Yin WY.Community structure and seasonal change of soil micro2arthropodes in the Lower Reaches of Liaohe River Plain under different land utilization.Chinese Journal of Applied Ecology,2004,15(4):600-604.
[34] Wu Y H,Cai Q N,Lin C W,Huang JJ,Cheng X.Effects of terrace hedgerows on so ilmacrofauna diversity.Acta Ecologica Sinica,2009,29(10):5320-5329.
[35] Bedano J C,Cantú M P,Doucet M E.Influence of three different land management practices on soil mite(Arachnida:Acari)densities in relation to a natural soil.Applied Soil Ecology,2006,32:293-304.
[36] Yin X Q,Wang H X,Zhou D W.Characteristics of soil animals'communities in dif ferent agricultural ecosystem in the Songnen Grassland of China.Acta Ecologica Sinica,2003,23(6):1071-1078.
[37] Wang H X,Yin X Q,Zhou D W.Ecological study on small-middle size soil animals in a compound ecosystem of farmland,grassland and woodland in the grassland region of Songnen Plain.Chinese Journal of Applied Ecology,2003,14(10):1715-1718.
[38] Zha G C,Liang L R,Zhou CQ.Community structure and diversity of arthropods in moss soil.Acta Ecologica Sinica,2003,23(6):1057-1062.
[39] Yang Z,Yang X D.Characteristics of floor litter and soil arthropod community in different types of subtropical forest in Ailao Mountain of Yunnan,Southwest China.Chinese Journal of Applied Ecology,2011,22(11):3011-3020.
[40] Wang SJ,Ruan H H,Wang JS,Xu Z K,Wu Y Y.Composition structure of soil fauna community under the typica l vegetations in the Wuyi Mountains,China.Acta Ecologica Sinica,2010,30(19):5174-5184.
[41] Lin Y H,Zhang F D,Zhang JQ,Ou Yang X J,Mo JM,Zhou GY.Preliminary investigation on temporal and spatial variation of structure of soil fauna community in different natural vegetations of Dinghushan.Acta Ecologica Sinica,2005,25(10):2616-2622.
[42] Fu B Q,Chen W,Gao W,Zhang L R.The soil invertebrate community and in popular davidiana+betula platyphylla forest in baihua mountain.Chinese Journal of Zoology,1997,32(2):10-15.
[43] Yang X D,Tang J W.Soil arthropod communities in different successional tropical secondary forests in Xishuangbanna,SW China.Chinese Journal of Applied Ecology,2004,15(6):988-994.
[44] Xu G L,Zhou G Y,Mo JM,Zhou X Y,Peng SJ.The responses of soil fauna composition to forest restoration in Heshan.Acta Ecologica Sinica,2005,25(7):1670-1677.
[45] Yang X D,Tang Y,Tang J W.Change in structure and diversity of soil arthropod communities after slash-and-burn of secondary forest in Xishuangbanna,Yunnan Province.Biodiversity Science,2001,9(3):222-227.
[46] Yin X Q,Zhong WY.Soil Animals in Leymus chinensis Grassland With Different Grazing Pressures.Acta Prataculturae Sinica,1997,6(4):71-75.
参考文献:
[9] 魏媛,张金池,俞元春,喻理飞.退化喀斯特植被恢复对土壤微生物数量及群落功能多样性的影响.土壤,2010,42(2):230-235.
[10] 徐盛基.贵州林火发生时间卫星监测动态分析.西部林业科学,2011,40(2):98-100.
[11] 张喜,朱军,崔迎春,霍达,王莉莉,吴鹏,陈骏,潘德权,杨春华.火烧对黔中喀斯特山地马尾松林土壤理化性质的影响.生态学报,2011,31(19):5809-5817.
[18] 肖云丹,鞠洪波,张雄清,纪平.黔南地区气象因子与森林火灾发生次数之间的关系.林业科学,2011,47(10):128-133.
[19] 田秀玲,夏婧,夏焕柏,倪健.贵州省森林生物量及其空间格局.应用生态学报,2011,22(2):287-294.
[20] 尹文英.中国土壤动物检索图鉴.北京:科学出版社,1998.
[21] 李隆术,李云瑞.蜱螨学.重庆:重庆出版社,1988.
[22] 钟觉民.幼虫分类学.北京:农业出版社,1990.
[23] 鲁如坤.土壤农业化学分析法.北京:中国农业出版社,2000.
[24] 尹文英.中国土壤动物.北京:科学出版社,2000.
[25] 刘满强,胡锋,李辉信,陈小云,何圆球.退化红壤不同人工林恢复下土壤节肢动物群落特征.生态学报,2002,22(1):54-61.
[26] 张雪萍,张淑花,李景科.大兴安岭火烧迹地土壤动物生态地理分析.地理研究,2006,25(2):327-334.
[27] 杨效东.热带次生林、旱稻种植地和火烧迹地土壤节肢动物群落结构特征及季节变化.生态学报,2003,23(5):883-891.
[28] 易兰,由文辉,宋永昌.天童常绿阔叶林五个演替阶段凋落物中的土壤动物群落.生态学报,2005,25(3):466-473.
[29] 吴东辉,张柏,卜照义,陈鹏.长春市不同土地利用生境土壤螨类群落结构特征.生态学报,2006,26(1):16-25.
[30] 张淑花,张雪萍.大兴安岭火烧迹地土壤动物的群落多样性.应用与环境生物学报,2009,15(5):672-676.
[31] 黄旭,文维全,张健,杨万勤,刘洋,闫帮国,黄玉梅.川西高山典型自然植被土壤动物多样性.应用生态学报,2010,21(1):181-190.
[32] 林英华,孙家宝,张夫道.我国重要森林群落凋落物层土壤动物群落生态特征.生态学报,2009,29(6):2938-2944.
[33] 柯欣,梁文举,宇万太,谢荣栋,翁朝联,杨毅明,尹文英.下辽河平原不同土地利用方式下土壤微节肢动物群落结构研究.应用生态学报,2004,15(4):600-604.
[34] 吴玉红,蔡青年,林超文,黄晶晶,程序.地埂植物篱对大型土壤动物多样性的影响.生态学报,2009,29(10):5320-5329.
[36] 殷秀琴,王海霞,周道玮.松嫩草原区不同农业生态系统土壤动物群落特征.生态学报,2003,23(6):1071-1078.
[37] 王海霞,殷秀琴,周道玮.松嫩草原区农牧林复合系统中小型土壤动物群落生态研究.应用生态学报,2003,14(10):1715-1718.
[38] 查广才,梁来荣,周昌清.苔藓土壤节肢动物群落及其多样性.生态学报,2003,23(6):1057-1062.
[39] 杨赵,杨效东.哀牢山不同类型亚热带森林地表凋落物及土壤节肢动物群落特征.应用生态学报,2011,22(11):3011-3020.
[40] 王邵军,阮宏华,汪家社,徐自坤,吴焰玉.武夷山典型植被类型土壤动物群落的结构特征.生态学报,2010,30(19):5174-5184.
[41] 林英华,张夫道,张俊清,欧阳学军,莫定生,周国逸.鼎湖山不同自然植被土壤动物群落结构时空变化.生态学报,2005,25(10):2616-2622.
[42] 傅必谦,陈卫,高武,张立荣.百花山山杨桦木林土壤动物群落及其季节动态.动物学杂志,1997,32(2):10-15.
[43] 杨效东,唐建维.西双版纳不同演替状态热带次生林土壤节肢动物群落特征.应用生态学报,2004,15(6):988-994.
[44] 徐国良,周国逸,莫江明,周小勇,彭闪江.鹤山丘陵退化生态系统植被恢复的土壤动物群落结构.生态学报,2005,25(7):1670-1677.
[45] 杨效东,唐勇,唐建维.热带次生林刀耕火种过程中土壤节肢动物群落结构及多样性的变化.生物多样性,2001,9(3):222-227.
[46] 殷秀琴,仲伟彦.羊草草地不同放牧强度下土壤动物的研究.草业学报,1997,6(4):71-75.
