多毛类底栖动物在莱州湾生态环境评价中的应用
2013-09-07李少文吕振波马元庆刘元进魏振华
张 莹,李少文,吕振波,马元庆,刘元进,魏振华,陈 玮
(山东省海洋水产研究所,山东省海洋生态修复重点实验室,烟台 264006)
多毛类动物在大型底栖动物群落功能中发挥重要作用,不仅是因为它在大型底栖动物群落中数量巨大,而且也因为它们取食方式的多样性,因此多毛类动物一直被认为是底栖动物物种丰富度和群落特征的最好指示生物[1]。当环境扰动增加时,底栖动物数量大量增加,并且被几种丰富的机会种占据优势地位。这些先锋物种就是通过摄食、掘穴和建管生活的多毛类,多毛类底栖动物生命周期短,成熟快,繁殖效率高[2],因此常作为环境扰动的指示生物,应用于生态环境评价参考。
莱州湾位于山东半岛的西北部,是一个半封闭的海湾区域,海湾内有许多人为活动,如工业,盐业以及水产养殖业。近些年来,随着入海河流带入莱州湾的污染物不断增加,莱州湾海水富营养化问题日趋严重,给莱州湾的环境和生物群落造成严重的危害[3]。因此,适时掌握莱州湾的生态环境质量状况与变化,对环境污染控制和海洋生态环境保护等具有重要意义。本文研究多毛类种类、数量组成的时空变化特征及其与环境因子的生态关系,以期应用于莱州湾生态环境质量状况评价。
1 材料与方法
1.1 研究海域及采样方法
1.1.1 研究海域
2011 年 5、8、10 月和 12 月,在莱州湾内进行了大面积调查,调查范围为 119°08'—120°09'E,37°20'—37°67'N,采取均匀布位的原则,共设置20个站位(图1)。
1.1.2 采样方法
使用0.1 m2的箱式采泥器,每站取样3次,分选泥样所用的网筛孔径为0.5 mm样品的处理、保存、计算和称重均按《海洋调查规范》(GB/T 12763.6—2007)进行[4]。

图1 采样站点示意图Fig.1 Sampling locations
1.2 沉积物分析
沉积物粒度采用马尔文粒度分析仪(Malvern,UK)将沉积物分为中砂(500—250μm)、细砂(250—63 μm)、粉砂(63—4μm)和粘土(4—1μm)4个类型。石油类采用荧光分光光度法,有机碳采用重铬酸钾氧化-还原容量法,重金属铅、镉、铜、锌、铬采用原子吸收分光光度法,砷和汞采用原子荧光法,所有样品分析均按照《海洋监测规范》(GB17378.5—2007)进行[5]。
1.3 数据处理
1.3.1 多样性特征指数
采用Margalrf丰富度指数(D)、Shannon多样性指数(H')和Pielou均匀度指数(J')综合分析站位种类组成多样性[6]。

式中,S为种类数,N为总个体数,pi为第i种底栖动物占总底栖动物密度的比例。采用PRIMER 5.2软件进行上述指数计算。采用SPSS统计软件利用单因素方差分析(ONE-WAY ANOVA)对上述指数在0.05水平进行显著性分析。
1.3.2 生态优势度
利用Pinkas相对重要性指数(IRI)确定种类在群落中的重要性[7]。将IRI值大于100的种类定义为重要种。

式中,Wi为第i种底栖动物的重量在总样品重量中所占的百分比(%),Ni为第i种底栖动物的个体数在总样品个体数中所占的百分比(%),Fi为第i种底栖动物在取样站位的出现率(%)。
1.3.3 群落聚类分析与非度量多维标度排序分析
不等刘大夫说完,尹爱群忽然站了起来,跪在地上,对着刘大夫对面的空着的椅子磕头,砰砰地响,声泪俱下,样子很瘆人:老婆啊,我错了,你饶了我吧!之后抖成一团,倒地不起。刘大夫急忙和几个护士把他抬到床上,打了一针镇静剂。过了好一阵,尹爱民才恢复了正常。
对各站位多毛类动物密度进行4次方根转换,然后采用Bray-Curtis相似性系数,建立站位Q型二维矩阵,进而采用均值法聚类和非度量多维坐标排序分析。
1.3.4 ABC曲线
丰度/生物量比较曲线(ABC曲线)[8],并用W(胁强系数)作为ABC曲线法的一个统计量,分析多毛类群落受干扰程度。W公式为:

式中,Bi和Ai为ABC曲线中种类序号对应的生物量和数量的累积百分比,S为出现物种数。当生物量优势度曲线在数量优势度之上时,W为正,反之为负。ABC曲线绘制和W统计的计算均使用PRIMER 5.2软件[8]。
1.3.5 BOPA指数
采用底栖动物多毛类机会种和端足目动物指数(BOPA index)来研究调查站位的污染情况[9],其公式为:

式中,fP为多毛类机会种的个体总数与样本个体总数的比值,fA为端足目动物的个体总数与样本个体总数的比值。根据BOPA指数值的范围将生态质量状况分为5个等级,优良,无污染(0.0—0.04576);良好,有轻度污染(0.04576—0.13966);一般,有中度污染(0.13966—0.19382);较差,有重度污染(0.19382—0.26761);恶劣,有较严重的污染或无生命位点(0.26761—0.30130)。
1.3.6 群落生态特征与水环境相关分析
用PRIME-5软件的BIO-ENV指数分别对底栖动物和春、夏、秋、冬4个季节的沉积物环境因素进行相关性分析。
2 结果
2.1 多毛类种类、数量组成及优势种
本次调查共鉴定莱州湾多毛类60种,春、夏、秋季数量相当,分别为43、44和44种,冬季数量较少,为35种。4季平均生物密度为548.7个/m2,其中,夏、秋2季生物密度分别为841.8和752.5个/m2,显著高于冬季生物密度(P<0.05),而春季生物密度与其它季节差异不显著。4季平均生物量为2.79 g/m2,其中春、秋2季较高,生物量分别为4.10和3.44 g/m2,显著高于冬季生物量1.14 g/m2(P<0.05),而夏季生物量为2.49 g/m2,与其它3个季节差异不显著(表1)。

表1 莱州湾多毛类动物密度与生物量分布Table1 Density and biomass constitutions of polychaete species in Laizhou Bay
利用Pinkas相对重要性指数(IRI)确定种类在群落中的重要性,结果显示,春季,绝对优势种为异足索沙蚕,优势度IRI为5489,其次为小头虫(IRI=2008)。夏季,绝对优势种为丝鳃虫,IRI值为3960。秋季,优势种为日本中磷虫和丝鳃虫,优势度IRI值分别为2925和1383。冬季,优势种为寡节甘吻沙蚕和不倒翁虫,IRI值分别为2241和1372(表2)。
2.2 种类多样性分析
Margalef丰富度指数(D)、Shannon多样性指数(H')和Pielou均匀度指数(J')从不同侧面测定种类多样性,综合分析比较莱州湾全年20个调查站位多毛类底栖动物多样性程度,结果见表3,站位S04、S06、S07、S11、S16 和 S17 的种类多样性较高,而站位 S01、S05、S08、S13、S14、S15、S18、S19 和 S20 的种类多样性较低。
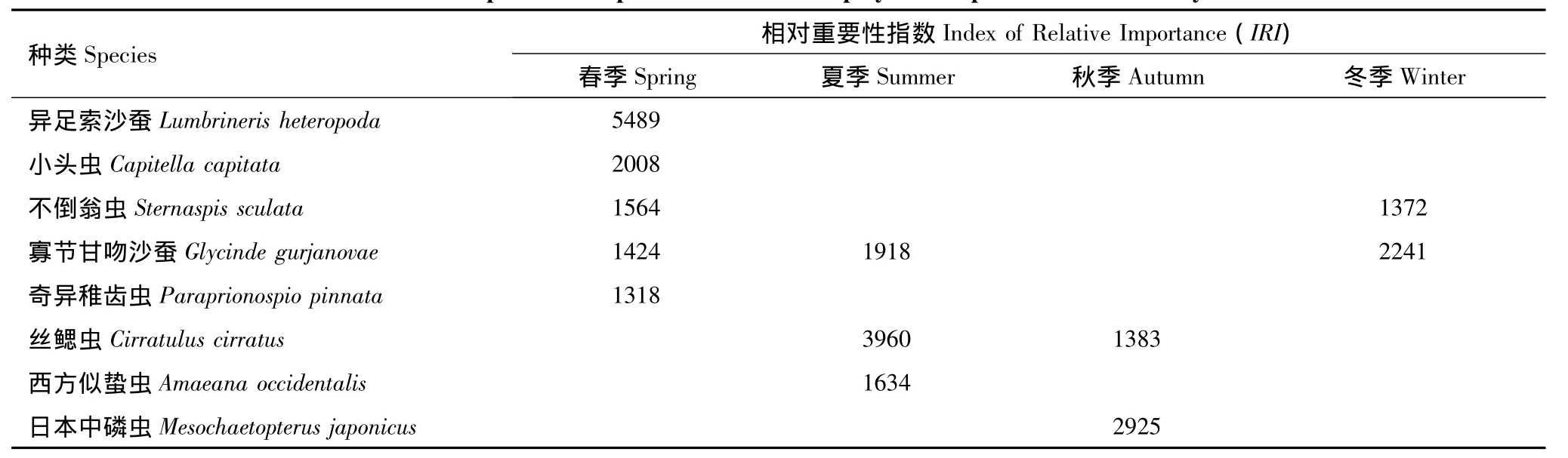
表2 莱州湾多毛类动物优势种组成特征Table2 Important components of dominant polychaete species in Laizhou Bay
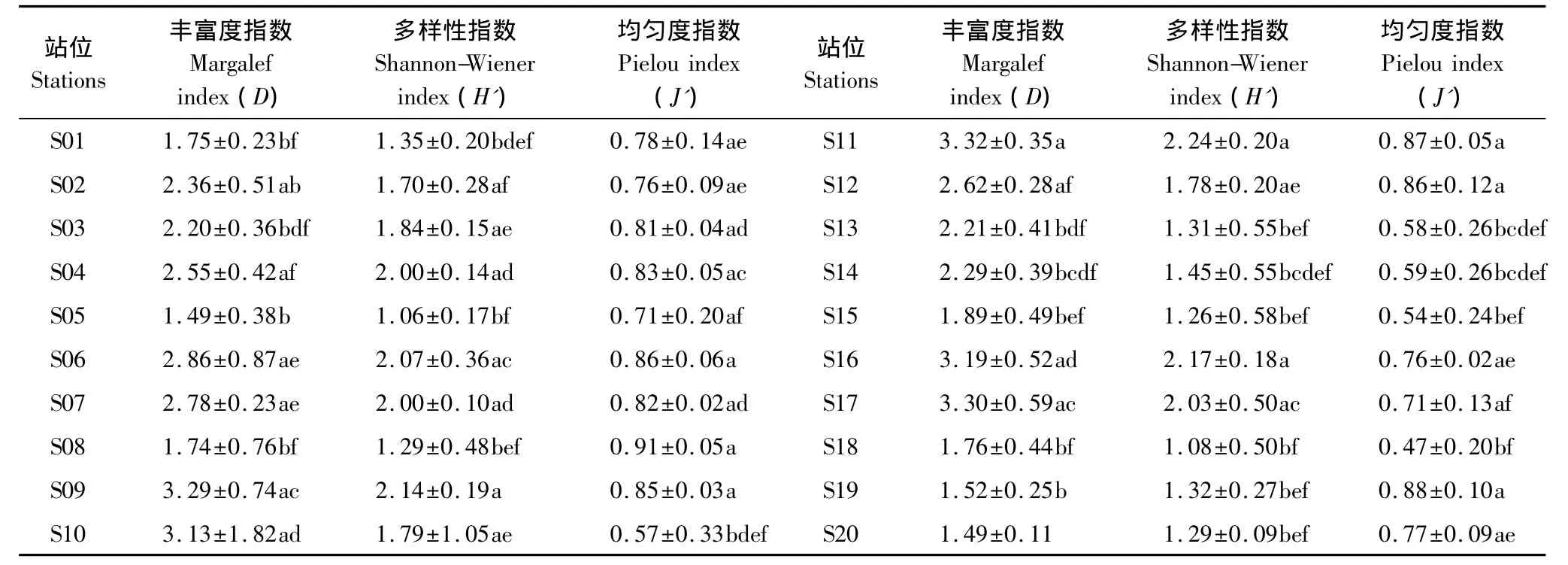
表3 莱州湾多毛类动物的Margalef丰富度指数、Shannon-Wiener多样性指数和Pielou均匀度指数Table3 Margalef index,Shannon-Wiener index and Pielou index of polychaete in Laizhou Bay
2.3 群落时空分布聚类和排序
以站位作为组合单元采用均值法作聚类谱系图和非度量多维座标排序点阵图(胁强<0.20),从图2可以看出全年莱州湾多毛类底栖动物可分为2个聚群:第一聚群由站位S19和S20构成,另一聚群由剩余其它站位构成。

图2 调查站位的聚类分析图(左)和NMDS排序图(右)Fig.2 Group average clustering(left)and NMDS ordination(right)of sampling stations in Laizhou Bay
2.4 ABC曲线分析
根据莱州湾20个站位全年多毛类动物的丰度和生物量数据做ABC曲线(图3)。由图3可知,ABC曲线中丰度优势度曲线和生物量曲线相交,表明群落处在中等干扰状态,多毛类动物群落逐渐由一种或几种个体较小的种类占优势。
2.5 BOPA指数
利用BOPA指数来研究春、夏、秋、冬4季各调查站位的污染情况,结果见图4。春季,有2个站位(站位S15和S16)为中度污染,BOPA指数分别为0.14和0.15,这两个站位获得的底栖动物中多毛类机会种小头虫(S15:215个/m2;S16:260个/m2)和奇异稚齿虫(S16:230个/m2)丰度较高。夏季,S14站位为重度污染,BOPA指数高达0.24,此站位获得的多毛类机会种丝鳃虫丰度非常高,达到3320个/m2。秋季和冬季,所有站位的环境质量状况为优良或者良好。

图3 ABC曲线以及W统计值Fig.3 ABC curves and W value of polychaete communities in the Laizhou Bay

图4 莱州湾底栖动物各站位的BOPA指数Fig.4 BOPA index calculated for the stations in the Laizhou Bay
2.6 沉积物的粒度组成
采用中砂(500—250μm)、细砂(250—63μm)、粉砂(63—4μm)和粘土(4—1μm)粒级组份,将沉积物分为3个类型,分别为粉砂、粉砂质砂和质砂粉砂(图5)。中砂仅存在S08站位,占0.80%。S14站位具有最高的细砂比例,为56.28%,S15站位含有最高的粉砂比例,为97.42%。
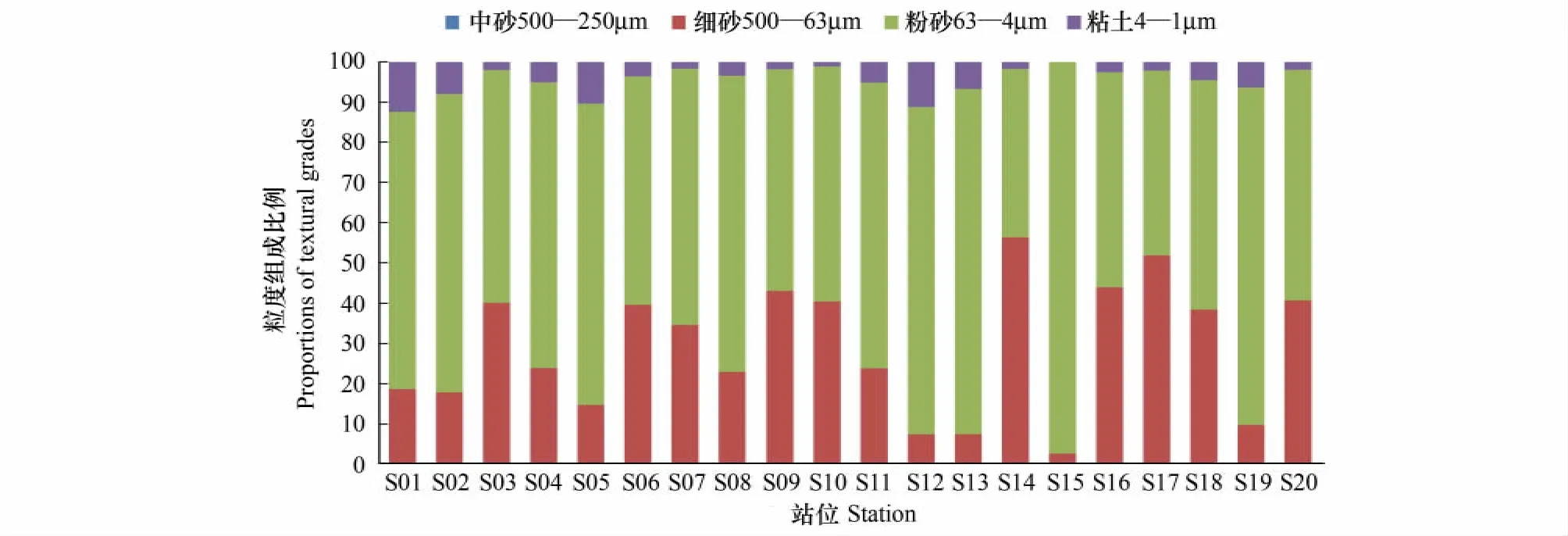
图5 莱州湾20个调查站位沉积物组成Fig.5 Sediment texture in Laizhou Bay
2.7 底栖动物与环境因子的相关性分析
通过BIO-ENV指数分别对春、夏、秋、冬4个季节的沉积物理化因子与多毛类栖息密度进行Spearman相关分析(表4)。结果表明,春季,影响最大的单个环境因子为中砂(ρs=0.467),其次是镉(ρs=0.438),这2个环境因子与沉积物含水率、汞和细砂共同构成了影响多毛类密度的最优多重环境因子(ρs=0.863)。夏季,影响最大的环境因子为铜,它与石油类、汞、中砂和细砂构成了最优环境因子组合(ρs=0.915)。秋季,影响最大的单个环境因子为镉(ρs=0.596),但是综合分析表明,由有机碳含量、含水率、铜、中砂和粉砂组成的多重环境因子才是影响栖息密度的环境组合因素。冬季,含水率、汞、镉、中砂和细砂与多毛类密度的相关因素最高,ρs=0.863。
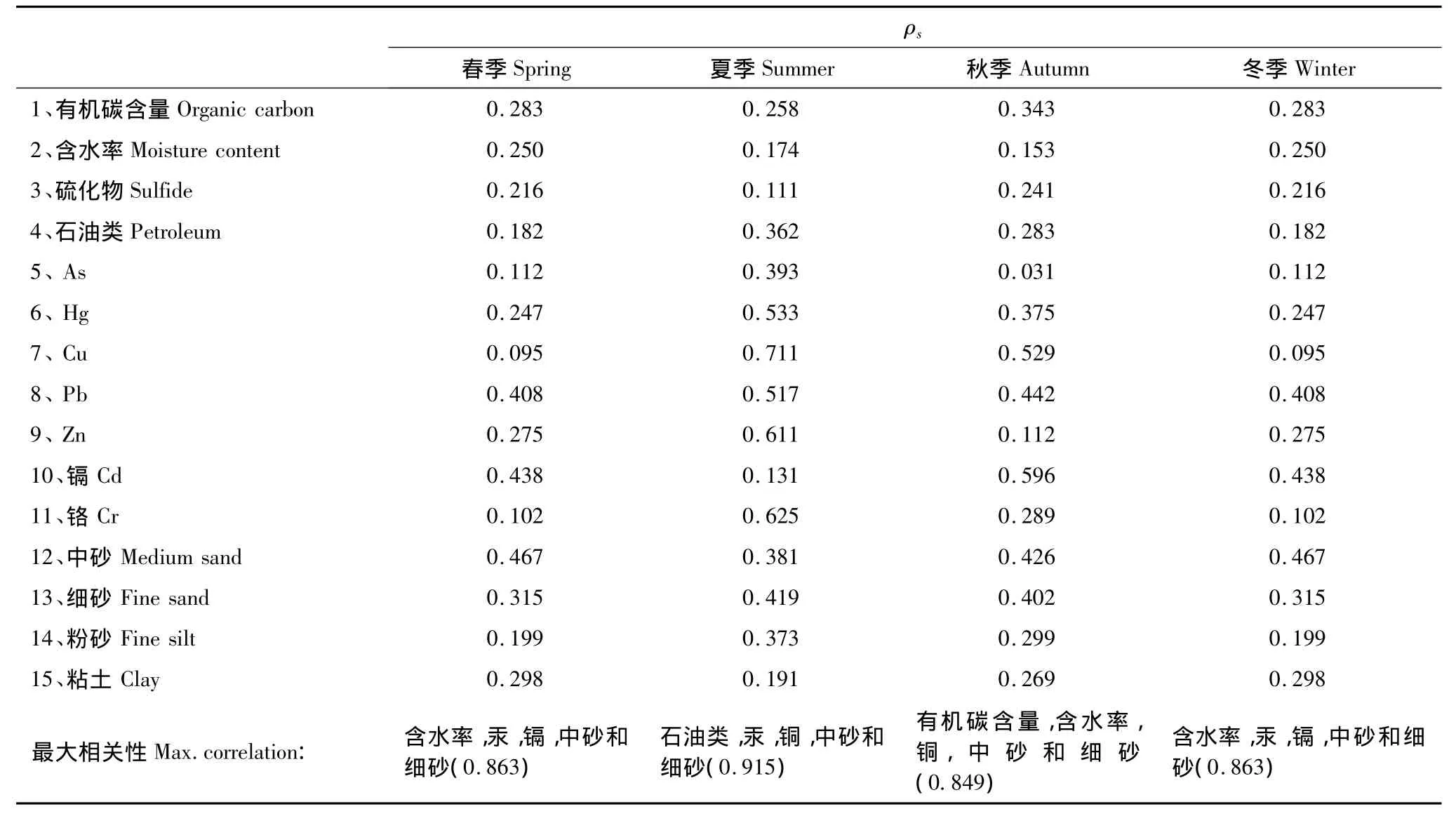
表4 BIO-ENV显示多毛类动物栖息密度与沉积物理化因子的相关关系Table4 Summary of results from BIO-ENV analyses of 20 stations in Laizhou Bay
3 讨论
3.1 多毛类动物生态特征与生境的关系
多毛类在底栖动物群落功能中发挥重要作用,它们被认为是海洋生物多样性的指示生物,亦被认为是环境扰动的最好指示生物。季节变化对多毛类具有较大的影响,本次调查共鉴定多毛类60种,春、夏、秋3季数量相当,其中,春、秋2季生物量较高,夏、秋2季生物密度较高。春季,多毛类进入生长繁殖季节,许多新个体进入群落,同时,春季浮游生物大量繁殖,给多毛类等底栖动物提供了充足的食物来源,这也有可能是造成春季多毛类生物量较高的原因[10]。夏、秋2季优势种丝鳃虫和日本中磷虫栖息密度分别高达3960和8455个/m2,因此,这2个季节多毛类生物密度在4个季节中较高。优势种中,丝鳃虫、奇异稚齿虫与小头虫同为机会种。Pearson和Rosenberg早在1978年就指出[11],多毛类机会种在沉积环境有机质含量增加时,迅速增殖,是环境污染或人为扰动后的先锋底栖动物。以小头虫为代表的机会种,常年栖居于有淡水注入的黑色泥沙中,被作为海洋有机物污染区的指示种。小头虫世代更新快,周年能产生幼虫,既以浮游幼虫,又以底栖幼虫进行种群补充,能在短期内大量发展,在扰动的软相海洋沉积物底栖群落演替中起主要作用[12]。多毛类优势种中,机会种种类占了37.5%,预示了莱州湾多毛类动物群落可能受到了环境污染的影响。
种类多样性在国内外普遍被用来监测淡水、海水底栖动物群落结构的变化,是一个较好的评价工具[13]。综合分析比较莱州湾全年20个调查站位多毛类底栖动物多样性程度,结果显示,站位S04、S06、S07、S11、S16和 S17的种类多样性较高,而站位S01、S05、S08、S13、S14、S15、S18、S19和 S20的种类多样性较低。种类多样性与多种环境因素相关,在不同的时间和空间尺度上的自然或人为扰动都会导致底栖动物群落组成和生物多样性的变化[14]。多样性较高的几个站位主要集中在湾东部,表明湾东部多毛类动物群落较稳定,抗干扰和修复能力较强,此底层海域生物生存环境良好。而多样性较低的站位主要集中在莱州湾的湾西部和南部,较低站位的共同特点是沿着海岸带,靠近陆源河流注入的水域,对这几个站位影响较大的河流有黄河、小清河、白浪河和潍河等。近年来,随着工业生产的发展,大量工业废水和生活污水直接排入河中,使入海河口附近水域富营养化和重金属含量超标,营养物质的大量输入,重金属的污染,有可能造成多毛类动物种类数的下降,亦造成多样性的降低。
莱州湾多毛类动物可分为2个聚群:第一聚群由站位S19和S20构成,另一聚群由剩余其它站位构成。站位S19和S20北部水域经常进行大规模的箱体养殖扇贝活动,阻碍了此区域水体交换能力,密集的养殖活动也给海洋生态系统带来了巨大影响。另外,在调查中还发现,夏季S19和S20站位附近拖网作业的渔船较多,改变了原来的底质环境,短期内对多毛类底栖动物群落的直接影响表现为种类减少、丰度及生物量降低。底质环境的稳定需要较长的时间,在这个过程中,可能会出现多毛类群落结构改变的现象。
3.2 多毛类动物群落与沉积物理化特征的相关关系
BIO-ENV分析结果表明,5个最佳环境变量组合相关系数ρs>0.8,表明沉积物理化性质对多毛类动物群落结构的影响是相当巨大的。春、夏、秋、冬4季结果显示,沉积物粒度是最主要环境因子。先前研究表明,软底沉积环境中,底栖动物群落分布与沉积物粒度最为相关,沉积物类型是底栖动物群落组成的主导因素[15]。1985年Rygg研究了挪威峡湾底栖动物群落多样性与重金属Cu、Pb、Zn和有机碳的相互关系,结果表明,Cu和有机碳与底栖动物群落多样性呈显著的负相关关系[16]。1986年McLusky等表明Cu与底栖动物群落多样性具有明显的负相关性,并且存在高浓度致死现象[17]。重金属(Zn、Cu、Pb和 Cr)与底栖动物群落多样性具有负相关性,影响底栖动物群落的分布。本研究与先前结果相符,有机碳含量、Hg、Cu和Cd是影响莱州湾多毛类底栖动物特征的主要环境因子。BIO-ENV指数表明,春、秋、冬3季含水率与多毛类动物群落具有较高的相关性。沉积物的含水率也是影响磷等地球化学元素释放的一个重要参数。因为含水率的大小直接影响到沉积物的再悬浮程度,而沉积物的再悬浮过程是磷等在沉积物与上覆水之间重新分配的重要途径[18]。然而,未衡量的其它物理、化学和生物因素及相互作用也可能参与影响莱州湾多毛类动物分布模式。
3.3 多毛类动物在莱州湾生态质量状况评价中的应用
多毛类环节动物在环境监测中具有重要应用,1986年Warwick提出用丰度/生物量比较曲线(ABC曲线)法来监测人为扰动或环境污染对大型底栖动物群落的影响[19]。ABC曲线是对整个底栖动物群落进行统计性分析,从生物量和丰度优势度的差别可以直观反应出群落组成中机会种与竞争型物种间比例是否均衡,由图3可知,ABC曲线中生物量曲线和丰度曲线相交,表明多毛类动物群落处在中等干扰状态。当群落受到中等程度的污染扰动时,个体较大的种的优势度被削弱,丰度和生物量优势度的不均等程度减弱,丰度和生物量曲线接近重合,或出现部分交叉。这是由于当群落受到中度污染时,生物量占优势的大个体消失,在数量上占优势的种是个体较小的种,在此情况下种内丰度的分布与生物量分布优势难分[20]。本文中多毛类动物群落的生物量曲线和丰度曲线相交,说明某些机会种的数量开始增加,莱州湾可能受到了一定程度的污染。
利用BOPA指数评估河口和海岸带沉积环境的健康状况具有重要意义[9]。多毛类和端足目底栖生物是环境扰动的指示生物。当环境扰动增加时,生物体数量大量增加,并且被几种丰富的机会种占据优势地位。这些先锋物种就是通过摄食、掘穴和建管生活的多毛类,它们生命周期短、成熟快、繁殖效率高。端足目动物在缺氧的沉积物中建管,建立小型氧化缸,促进海底的氧化过程和硝化过程,它们亦被认为是结构生物,可作为环境修复的指示生物[21]。本研究中,莱州湾的污染站位中,底栖动物群落情况为低丰度端足目和高丰度多毛类机会种。春季,有2个站位(站位S15和S16)为中度污染,BOPA指数分别为0.14和0.15,这两个站位获得的机会种小头虫和奇异稚齿虫丰度较高。夏季,S14站位为重度污染,BOPA指数高达0.24,此站位获得的机会种丝鳃虫的丰度非常高,达到3320个/m2。通过对沉积物化学因子指标比较分析,春季,站位S15重金属含量都符合《海洋沉积物质量》(GB—18668)一类标准,站位S16只有金属Cd含量超标,其余都符合一类标准。夏季,站位S14重金属含量也都符合一类标准。因此,莱州湾的部分站位多毛类动物群落受到扰动,是否由于沉积环境污染引起还有待深入探讨。
[1] Sparks-McConkey P J,Watling L.Effects on the ecological integrity of a soft-bottom habitat from a trawling disturbance.Hydrobiologia,2001,456(1/3):73-85.
[2] Calabretta C J,Oviatt C A.The response of benthic macrofauna to anthropogenic stress in Narragansett Bay,Rhode Island:a review of human stressors and assessment of community conditions.Marine Pollution Bulletin,2008,56(10):1680-1695.
[3] Hao Y J,Wang Z L,Zhu M Y,Li R X,Sun P X,Xia B,Chen L Q.Investigation and assessment of nutrients and phytoplankton diversity in the Laizhou Bay.Advances in Marine Science,2005,23(2):197-204.
[4] General Administration of Quality Supervision,Inspection and Quarantine of the People's Republic of China,Standardization Administration of the People's Republic of China.The Specification for Oceanographic Survey-Part 4:Marine Chemical Elements Survey.Beijing:Standards Press of China,2007.
[5] General Administration of Quality Supervision,Inspection and Quarantine of the People's Republic of China,Standardization Administration of the People's Republic of China.The Specification for Marine Monitoring-Part 5:Sediment Analysis.Beijing:Standards Press of China,2007.
[6] Li G G.The application of Diversity Index.Marine Sciences,1981,(2):4-8.
[7] Pinkas L,Oliphant M S,Iverson I L K.Food habits of albacore,bluefin tuna,and bonito in California waters.Fishery Bulletin,1971,152:1-105.
[8] Clarke K R,Warwick R M.Change in Marine Communities:An Approach to Statistical Analysis and Interpretation.2nd ed.Plymouth:PRIMERE,2001.
[9] Dauvin JC,Ruellet T.Polychaete/amphipod ratio revisited.Marine Pollution Bulletin,2007,55(1/6):215-224.
[10] Zhao Y Q,Chen Q Z,Zeng JG,Gao A H,Huang Y J,Shou L,Liao Y B.Relationship between environmental factors and temporal and spatial variation of benthic polychaetes in intertidal flats of Jiaojiang estuary.Journal of Fishery Sciences of China,2009,16(4):580-587.
[11] Pearson T H,Rosenberg R.Macrobenthic succession in relation to organic enrichment and pollution of the marine environment.Oceanography and Marine Biology Annual Review,1978,16:229-231.
[12] Zhang Y,Liu Y J,Zhang Y,Xu B Q,LüZ B.Ecological characteristics of benthic polychaete community and its responses to environmental change in Laizhou Bay,Shandong Province of East China.Chinese Journal of Ecology,2012,31(4):888-895.
[13] Li Y Q,Ding M L.Marine Pollution Biology.Beijing:Ocean Press,1981.
[14] Wang Z X,Sun P X,Liu C X,Fan S L,Zang J Y.Preliminary study on ecology of benthic polychaeta in coastal waters of Qingdao.Marine Environmental Science,2011,30(1):41-43.
[15] Sanders H L.Benthic studies in Buzzards Bay.I.Animal-sediment relationships.Limnology and Oceanography,1958,3(3):245-258.
[16] Rygg B.Effect of sediment copper on benthic fauna.Marine Ecology-Progress Series,1985,25:83-89.
[17] McLusky D S,Bryant V,Campbell R.The effects of temperature and salinity on the toxicity of heavy metals to marine and estuarine invertebrates.Oceanography and Marine Biology,1986,24:481-520.
[18] Zhu G W,Gao G,Qin B Q,Zhang L,Luo L C.Geochemical characteristics of phosphorus in sediments of a large shallow lake.Advances in Water Science,2003,14(6):714-719.
[19] Warwick R M.A new method for detecting pollution effects on marine macrobenthic communities.Marine Biology,1986,92(4):557-562.
[20] Zhang Y,LüZ B,Xu Z F,Liu Y H,Jin Y.Ecological characteristics of macrobenthic communities and their relation to water environmental factors in four bays of southern Shandong Peninsula.Acta Ecologica Sinica,2011,31(15):4455-4467.
[21] Goméz-Gesteira J L,Dauvin J C.Amphipods are good bioindicators of the impact of oil spills on soft-bottom macrobenthic communities.Marine Pollution Bulletin,2000,40(11):1017-1027.
参考文献:
[3] 郝彦菊,王宗灵,朱明远,李瑞香,孙丕喜,夏滨,陈力群.莱州湾营养盐与浮游植物多样性调查与评价研究.海洋科学进展,2005,23(2):197-204.
[4] 国家质检总局,国家标准化委员会.海洋调查规范第4部分:海水化学要素调查.北京:中国标准出版社,2007.
[5] 国家质检总局,国家标准化委员会.海洋监测规范第5部分:沉积物分析.北京:中国标准出版社,2007.
[6] 李冠国.多样性指数的应用.海洋科学,1981,(2):4-8.
[10] 赵永强,陈全震,曾江宁,高爱根,黄逸君,寿鹿,廖一波.椒江口潮间带多毛类动物时空分布与环境因子的关系.中国水产科学,2009,16(4):580-587.
[12] 张莹,刘元进,张英,徐炳庆,吕振波.莱州湾多毛类底栖动物生态特征及其对环境变化的响应.生态学杂志,2012,31(4):888-895.
[13] 李永祺,丁美丽.海洋污染生物学.北京:海洋出版社,1991.
[14] 王宗兴,孙丕喜,刘彩霞,范士亮,臧家业.青岛近海底栖多毛类生态学初步研究.海洋环境科学,2011,30(1):41-43.
[18] 朱广伟,高光,秦伯强,张路,罗潋葱.浅水湖泊沉积物中磷的地球化学特征.水科学进展,2003,14(6):714-719.
[20] 张莹,吕振波,徐宗法,刘义豪,靳洋.山东半岛南部海湾底栖动物群落生态特征及其与水环境的关系.生态学报,2011,31(15):4455-4467.
