氟啶胺在土壤中的吸附解吸与淋溶特性
2013-09-07许秀莹宋稳成王鸣华南京农业大学植物保护学院江苏南京0095农业部农药检定所北京0006
许秀莹 ,宋稳成 ,王鸣华 * (.南京农业大学植物保护学院,江苏 南京 0095;.农业部农药检定所,北京0006)
农药在土壤环境中的行为和归宿,包括迁移、滞留(吸附解吸、浸渍等)、转化(生物、化学及光降解)是农药环境安全性评价的重要内容,其中农药在土壤-水环境中的吸附-解吸是影响其行为和归宿的支配要素之一[1].
氟啶胺是由日本石原株式会社开发的2,6-二硝基苯胺类低毒杀菌剂,对交链孢属、葡萄孢属、食植性螨类和十字花科植物根肿病等均有良好预防效果[2-4],常用于防治辣椒疫病、马铃薯和番茄晚疫病[5].Draper等[6]表明,接触环境残留的氟啶胺可引发哮喘病和皮炎等破坏人类免疫系统的疾病.目前有关氟啶胺的环境行为的研究较少.骆爱兰等[7-8]研究了氟啶胺对土壤中过氧化氢酶、蔗糖酶活性的影响,但氟啶胺在土壤中吸附解吸和迁移特性方面的研究还未见报道.
本文通过研究氟啶胺在 3种土壤中的吸附解吸和淋溶特性,为氟啶胺在土壤环境中的安全评价及合理使用提供科学依据.
1 材料与方法
1.1 试验材料与仪器
氟啶胺标准品(质量分数 98.24%,农业部农药检定所).乙酸乙酯、乙腈、丙酮、氯化钠、无水硫酸钠均为分析纯(南京化学试剂有限公司).Agilent7890A气相色谱仪带电子捕获检测器(μ-ECD)(美国 Agilent科技有限公司).R-200型旋转蒸发仪(瑞士BUCHI公司).N-EVAP111型氮吹仪(美国Organomation公司).BS110S型电子天平(北京塞多利斯天平有限公司).MUL9000(A)-H-30型超纯水系统(南京总馨纯水设备有限公司).ZQLY-180恒温振荡培养箱(上海知楚仪器有限公司).
1.2 土壤样品
供试土壤为江西红壤、南京黄棕壤和东北黑土.土壤均采自大田表层 0~15cm 耕作层,对大田的用药以及耕作历史进行调查表明土壤未受污染,采回后自然风干碾磨,过2 mm筛后密封备用,基本理化性质表1.
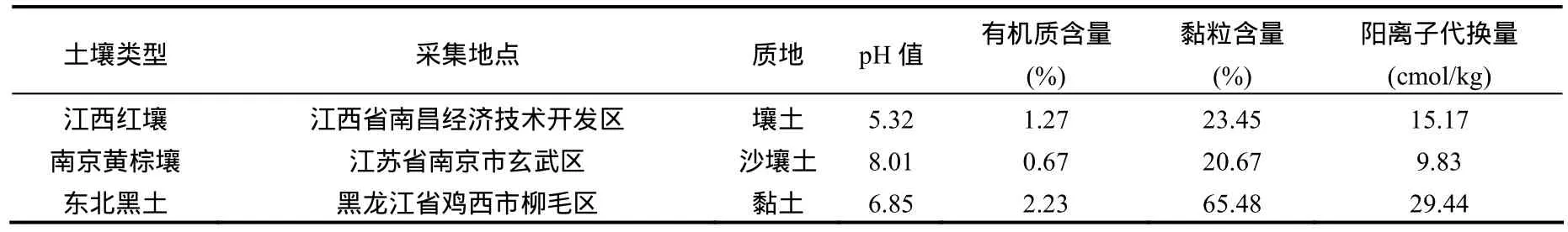
表1 供试土壤的理化性质Table 1 Physical and chemical properties of the test soils
1.3 试验方法
1.3.1 吸附试验 在一系列250mL具塞三角瓶中分别称取2.0g供试土壤.吸附动力学试验中每个三角瓶中加入50.0mL浓度为3.0mg/L的氟啶胺溶液(0.01mol/LCaCl2溶液配制),于恒温振荡器(25±1)℃以120r/min振荡,分别于0, 0.5, 2, 4, 6,8, 12, 24h取土壤悬浊液于4000r/min离心10min,上清液加入40mL×2乙酸乙酯萃取2次,合并提取液,经无水硫酸钠过滤至 150mL圆底烧瓶,旋转蒸发仪浓缩近干,氮吹仪吹干,2mL丙酮定容,气相色谱检测.吸附等温试验以每个三角瓶中分别加入50mL浓度为0.05, 0.5, 1, 2.5, 5mg/L的氟啶胺溶液(0.01mol/LCaCl2溶液配制),于恒温振荡器(25±1)℃以120r/min振荡24h.离心测定上清液中氟啶胺的浓度.
1.3.2 解吸试验 将1.3.1离心后的土壤再加入与 1.3.1离心得到上清液相同体积的0.01mol/LCaCl2水溶液进行振荡.解吸动力学试验于0, 0.5, 2, 4, 6, 8, 12, 24h取样分析.解吸等温试验于 24h后取样.离心测定上清液中氟啶胺的浓度.
以上所有试验均重复3次,同时设置未加土壤的农药水溶液(0.01mol/LCaCl2介质)为空白对照.
1.3.3 土壤迁移试验 称取400g(±0.1g)过2mm筛的土壤,装于塑料管中(内径5cm、柱长35cm),装成30cm高的土柱,在上端添加1cm厚的石英砂,柱中加水至土壤饱和持水量的60%.将0.5mL的氟啶胺 1000μg/mL的甲醇母液标样加于土柱上层,蠕动泵 30mL/h的速度用 0.01mol/LCaCl2水溶液淋洗土柱10h.淋洗完毕后,收集淋出液,将土柱均匀切成 3段,分别测定各段土壤及淋出液中农药含量.
1.4 色谱条件
色谱柱 DB-1701(30m×0.32mm×0.25μm)毛细管柱.进样口温度 250℃,进样量:1μL.进样模式:不分流.载气(N2):1mL/min.尾吹气:40mL/min.柱温:起始 60℃,保留 1min,以30℃/min 升至 270℃,保留 5min.检测器 300℃.氟啶胺在 0.05~10.00mg/L浓度范围内线性良好,相关系数达0.9997.
水样回收率测定:分别将50mL水与3种土壤各2g混匀,4000r/min离心10min,取上清液分别添加理论浓度为0.05, 0.5, 1, 5mg/L的氟啶胺水溶液,40mL×2乙酸乙酯萃取2次,合并提取液,经无水硫酸钠过滤至150mL圆底烧瓶,旋转蒸发仪浓缩近干,氮吹仪吹干丙酮定容气相色谱检测.每个添加浓度设3个平行,2组重复.
回收结果表明,基质水样中,4个浓度的平均回收率为90%~95%,RSD<1%.
1.5 计算方法
根据我国“化学农药环境安全评价试验准则”[9]进行计算:
吸附率:A=100(M-Ce·V0)/M=100X/M(1)式中:A为吸附率;M为未加土壤的农药水溶液平衡时农药含量,mg;Ce为经土壤吸附平衡时水相中农药浓度,mg/L;V0为水溶液体积,mL;X为吸附于土壤中的农药量,mg.
式中:D为解吸率;C为解吸液中农药的质量浓度,mg/L;V为解吸试验后水相体积,mL.

式中:Cs为吸附平衡时土壤吸附的氟啶胺浓度,mg/kg;Ce为平衡溶液中氟啶胺浓度,mg/L;Kf(mg1-1/n·L1/n/Kg)为吸附常数;1/n为吸附系数.
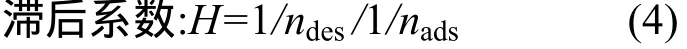
式中:nads为吸附经验常数;ndes为解吸经验常数.
有机质吸附常数(KOM)、吸附自由能(ΔG,KJ/mol)计算公式如下:

式中:R为气体摩尔常数,8.314J/(K·mol);T为绝对温度,K.
土柱淋溶:根据三段土壤及淋出液中的农药含量,分别求出其占总量的百分比.

式中:Ri为各组分中农药含量的比例,%;mi为各组分中农药质量,mg;i=1,2,3,4,分别表示组分 0~10cm、10~20cm、20~30cm 土壤及淋出液;M为农药添加总量,mg.
2 结果与讨论
2.1 氟啶胺在土壤中的吸附-解吸动力学特性
质量平衡试验表明,在振荡的 24h内未发现氟啶胺因微生物分解、水解或光解而明显降解.
土壤对有机物的吸附可分为快速反应阶段和慢速平衡阶段[10].由图1可知,氟啶胺与土壤溶液接触1h可以完成快速吸附阶段,溶液中氟啶胺的比例急剧降低,2~12h为慢速平衡阶段,12~24h间,溶液中氟啶胺的浓度保持一致,此时可认为吸附已达到平衡,因此,确定平衡时间为24h.吸附与解吸是性质相反的过程,吸附越快则解吸越慢,如图2所示,3种土壤解吸在8h左右达到平衡.为保证氟啶胺在土壤中的吸附与解吸达到完全平衡,试验统一确定24h作为平衡时间.
吸附动力学试验结果表明,氟啶胺在 3种土壤中的吸附能力顺序是:东北黑土>江西红壤>南京黄棕壤;其吸附率分别为 90.34%、78.21%、70.09%.
解吸动力学试验结果表明,氟啶胺在 3种土壤中的解吸能力顺序是:南京黄棕壤>江西红壤>东北黑土,即吸附能力越强则解吸能力越弱.

图1 吸附时间与吸附率的关系Fig.1 Relationship between adsorption rate and adsorption time

图2 解吸时间与解吸率的关系Fig.2 Relationship between desorption rate and desorption time
2.2 氟啶胺在土壤中的等温吸附特性
将试验数据采用吸附模型拟合.结果表明氟啶胺的吸附等温线符合 Freundlich方程(表2).Kozak等[11]发现土壤中的有机质含量对农药的吸附-解吸起着重要的作用,尤其是非离子型农药.一般情况下,OM 含量高,吸附越强.氟啶胺在3种土壤中的吸附常数分别为:东北黑土 311.88,江西红壤 202.23,南京黄棕壤 119.34,将吸附常数与与土壤有机质含量、土壤阳离子交换量、黏粒含量以及 pH值进行回归分析,得到回归方程分别为Y=122.57X+40.782,R2=0.9973;Y= 9.3774X+40.981,R2=0.9690;Y=3.5606X+81.07,R2=0.8586;Y=-25.503X+382.7,R2=0.1269.结果表明土壤有机质含量、阳离子代换量和黏粒含量与吸附系数有良好的相关性,而pH值与吸附系数相关性较差.
有研究表明[12],n值的大小与土壤有机质的均匀性、土壤吸附位点的分布、土壤的硬度、土壤有机质的熟化程度均有关,n值越低,土壤吸附位点的分布越复杂,有机质熟化程度越高.由表 2可以看出,东北黑土的土壤有机质熟化程度高,吸附位点的分布更复杂.
氟啶胺在 3种土壤中的吸附等温线见图 3.通常吸附等温线有 3种类型即 S、L、H型.Calvet[13]研究表明,Freundlich等温吸附方程中,1/nads通常可以用来表示吸附过程的强烈程度,吸附机理不同是产生这种吸附强烈程度差异的原因,当 1/nads>1,该类等温吸附线属于 S型,表明在低浓度的情况下,与土壤的亲合力比与水相的亲和力要弱,随着浓度的增加,与土壤亲合力增加,吸附增加;而如果 1/nads<1,该类等温吸附线属于L型,表明在较低浓度下与土壤的亲和力比对水的亲和力要强,而随着浓度的增加,与土壤的亲和力降低,吸附减弱.图3可以看出,氟啶胺在南京黄棕壤上有较高的亲和力,随着吸附位点被连续占领,寻找吸附位点越来越困难,因此随着浓度的增加,吸附平衡浓度趋于平缓.在东北黑土和江西红壤的吸附等温线为 S型,表明氟啶胺在较低浓度下与水分子有较强的亲和力,随着浓度增加与土壤亲和力增强.

表2 氟啶胺在三种土壤中的吸附解吸参数Table 2 The adsorption-desorption parameters of fluazinam in three soils

图3 氟啶胺在三种土壤中的吸附等温线Fig.3 Adsorption isotherms of fluazinam in three soils
2.3 氟啶胺在土壤中的等温解吸特性
Barriuso等[14]把吸附与解吸的不可逆现象定义为解吸的滞后效应.Cox[15]把滞后作用定义为吸附-解吸等温线拟合参数n值的百分比,用H(Hysteretic Index)表 示 .O’Connor 等[16]用Freundlich方程中拟合参数1/ndes/1/nads比值作为滞后程度指标.1/ndes/1/nads=1表示无滞后效应;1/ndes/1/nads<1表示正滞后效应;1/ndes/1/nads>1表示负滞后效应.由表2结果可知,氟啶胺在黑土和黄棕壤中的解吸为正滞后作用,红壤中为无滞后作用.这种差异可能与土壤的理化性质及吸附解吸机制有关,有待进一步验证.
2.4 氟啶胺在土壤中的吸附自由能
土壤吸附自由能(ΔG)的大小是反映土壤吸附特性的重要参数,根据其大小可以推断土壤吸附的机制,当吸附自由能变化|ΔG|<40kJ/mol时为物理吸附;反之为化学吸附.物理吸附的吸附平衡速率较快,吸附是可逆过程;而化学吸附的吸附平衡速率较慢,吸附是不可逆过程.
由表 2可以看出,3种土壤对氟啶胺农药的吸附的自由能变化均为负值,表示土壤对农药的吸附为放热反应,降低温度有利吸附作用进行;3种土壤对氟啶胺的吸附的自由能变化均小于40kJ/mol,因此均属于物理吸附,即其吸附主要发生在土壤表面.
2.5 氟啶胺在土壤中的淋溶特性
淋溶作用是指农药随渗透水在土壤中垂直向下的过程,是农药与水-土壤颗粒之间吸附-解吸和分配的一种综合行为,农药的移动性强弱是评价农药对地下水安全性的重要依据之一.实验室常采用土柱淋溶法模拟自然界土壤中农药的迁移情况.结果表明氟啶胺在南京黄棕壤中移动性略强于东北黑土和江西红壤.在 0~10cm 土柱段氟啶胺含量东北黑土中为88.68%,江西红壤中为80.76%,南京黄棕壤中为 0;10~20cm土柱段氟啶胺含量东北黑土中为11.32%,江西红壤中为19.24%,南京黄棕壤中为 76.05%;20~30cm 土柱段氟啶胺含量东北黑土和江西红壤中为0,南京黄棕壤中为23.95%.根据各段土柱中农药的百分含量可将农药的移动性能进行等级划分,东北黑土和江西红壤属难淋溶等级,南京黄棕壤属较难淋溶等级[9].
3 结论
3.1 批量平衡法结果表明,氟啶胺在3种土壤中的吸附能力大小顺序为东北黑土>江西红壤>南京黄棕壤,解吸能力相反,吸附以物理吸附为主.
3.2 氟啶胺在3种土壤中的吸附常数分别为:南京黄棕壤 119.34,江西红壤 202.23,东北黑土311.88,与土壤有机质含量、阳离子代换量和粘粒含量有良好的相关性.
3.3 氟啶胺在南京黄棕壤上的等温吸附曲线呈L型,在东北黑土和江西红壤的吸附等温线为 S型.在东北黑土中属易吸附,江西红壤和南京黄棕壤属较易吸附.
3.4 氟啶胺在江西红壤和东北黑土中难淋溶,南京黄棕壤较难淋溶.
[1]欧晓明,张 俐,裴 晖,等.新农药硫肟醚在土壤中的降解 [J].中国环境科学, 2005,25(6):705-709.
[2]Johnson D A, Atallah Z K.Timing fungicide applications for managing sclerotinia stem rot of potato [J]. Plant Disease,2006,90(6):755-758.
[3]Matheron M E, Porchas M. Comparative ability of six fungicides to inhibit development of phytophthora gummosis on citrus [J].Plant Disease, 2002,86(6):687-690.
[4]Mitani S, Sugimoto K, Hayashi H, et al. Effects of cyazofamid againstPlasmodiophora brassicae Woroninon Chinese cabbage[J]. Pest Management Science, 2003,59(3):287-293.
[5]Dowley L J, O′ Sullivan E. Activity of fluazinam against late blight of potatoes [J]. Irish Journal of Agricultural and Food Research, 1995,34(1):33-37.
[6]Draper A, Cullinan P, Campbell C, et al. Occupational asthma from fungicides fluazinam and chlorothalonil [J]. Occupational and Environmental Medicine, 2003,60(1):76-77.
[7]骆爱兰,余向阳.氟啶胺对土壤中蔗糖酶活性及呼吸作用的影响[J]. 中国生态农业学报, 2011,19(4):902-906.
[8]骆爱兰,余向阳.氟啶胺胁迫对土壤过氧化氢酶活性的影响 [J].江苏农业科学, 2011,39(6):478-480.
[9]化学农药环境安全评价试验准则 [S].
[10]赵俊岭.农药西维因在土壤上的吸附行为机理研究 [D]. 北京:北京交通大学, 2008.
[11]Kozak J, Weber J B, Sheets T J. Adsorption of prometryn and metolachlor by selected soil organic matter fractions [J]. Soil Science, 1983, 136(2):94.
[12]Tang Z W, Zhang W, Chen Y M. Adsorption and desorption characteristics of monosulfuron in Chinese soils [J]. Journal of Hazardous Materials, 2009,166(2/3):1351-1356.
[13]Calvet R. Adsorption of organic chemicals in soil [J].Environmental Health Perspectives, 1989,83:145-177.
[14]Barriuso E, Laird D A, Koskinen W C, et al. Atrazine desorption from smectites [J]. Soil Science Society of American Journal,1994,58(6):1632-1638.
[15]Cox L. Sorption-desorption of imidacloprid and its metabolites in soils [J]. Journal of Agricultural and Food Chemistry, 1997,45(4):1468-1472.
[16]O′Connor G A, Wierenga P J, Cheng H H, et al. Movement of 2, 4,5-T through large soil columns [J]. Soil Socience, 1980,130(3):157-162.
