酸性镀铜液中氯离子含量测定
2013-09-06韩迎春周锦兰
韩迎春,周锦兰
(华中科技大学 化学与化工学院实验中心,湖北 武汉 430074)
可溶性氯化物中氯含量的测定是大学分析化学实验的重要内容,一般采用银量法(包括莫尔法、佛尔哈德法、法扬司法等)测定[1-3]。因易受实际样品中其他有色离子、体系的色度和浊度等因素的干扰,银量法存在硝酸银稳定性差及滴定终点难以有效判断等缺点[4-6],导致检测结果重现性差,准确性不理想,而且不适合微量氯离子的测定,硝酸银用量较大,试剂价格昂贵,实验成本较高。
在电镀镀液中氯离子含量对镀层光亮度和阳极行为有较大的影响,溶液的氯离子含量必须保持在20~80mg/L之间[7-8]。如果低于20mg/L ,镀层会出现条纹,烧焦等现象;超过80mg/L,则阳极产生钝化,铜离子浓度下降[9]。适量的氯离子不但可配合光亮剂得到饱满全光亮镀层,促进阳极溶解,减少一价铜的影响,还可以降低镀层内应力[10],但氯离子含量过高或过低都将使镀层性能恶化[10-11]。因此,建立对镀液中微量氯离子的准确检测和控制方法十分必要。本文探索了“酸性镀铜溶液中微量氯离子含量测定”实验课题,建立了用氧化钡为沉淀剂、用过氧化氢为氧化剂消除相关离子的干扰、用离子选择电极法测定酸性镀铜液中微量氯离子含量的新方法。
1 实验部分
1.1 仪器及试剂
仪器:pHS-3C型酸度计、JB-1A型磁力搅拌器(上海雷磁仪器厂);pCl-1型氯离子选择电极(上海精密科学仪器有限公司);参比电极为217型饱和双桥甘汞电极(上海精密科学仪器有限公司),内管溶液用氯化钾饱和溶液(3mol/L),外套管溶液用硝酸钾溶液(1moL/L)。
试剂:氯化钾、硝酸钾、硝酸、基准氯化钠(国药集团化学试剂有限公司)。
1.2 实验原理
氯离子选择性电极是由AgCl和Ag2S的粉末混合物压制成的敏感膜,当将氯离子选择性电极浸入含Cl-溶液中,可产生相应的膜电势,其大小与Cl-活度α(Cl-)的对数值成线性关系。
以氯离子选择性电极为指示电极,饱和双桥甘汞电极为参比电极,插入试液中组成工作电池。当氯离子浓度在1~10-4mol/L范围内时,在一定的条件下,电池电动势可随溶液中氯离子活度的变化而变化,其变化规律符合Nernst方程:
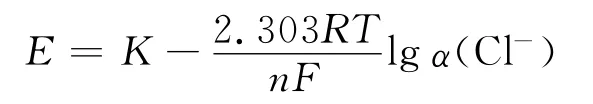
式中:E为电动势;K值取决于温度和电极特性等条件,这些条件确定后其值为常数;R为气体常数;T为温度;F为法拉第常数;n为电极反应中传递的电子数。在一定条件下电动势与溶液中氯离子活度的对数值成线性关系,作E-lgα(Cl-)图得一直线,根据样品的E,查标准曲线求出待测溶液中Cl-的浓度。
1.3 实验方法
1.3.1 试剂配制
总离子强度调节剂溶液(TISAB)的配制:将0.5 mol/L的硝酸溶液与2.5mol/L的硝酸钾溶液按体积比为1∶2混合。
氯离子标准溶液的配制:将基准氯化钠于500~600℃的马沸炉灼烧1h,在干燥器中冷却后,准确称取0.250g氯化钠并置于50mL的小烧杯中,用去离子水溶解后转入100mL的容量瓶中,稀释至刻度、摇匀。氯离子标准溶液的浓度为2.50g/L。
1.3.2 标准曲线的绘制
分别取氯化钠标准溶液0.250、0.500、1.000、2.000、3.000、4.000mL,并分别置于6个50mL的容量瓶中,再向每个容量瓶中加入10mL TISAB离子强度调节溶液、5滴稀硝酸(水与硝酸体积比为1∶1),定容,配成 NaCl质量浓度分别为12.5、25.0、50.0、100、150、200mg/L的标准待测液。标准溶液分别置于50 mL的烧杯中,将氯离子选择电极和参比电极插入溶液中,在搅拌下测定不同体系的电位。作E-lgα(Cl-)图,即得标准曲线。
1.3.3 待测液的制备
准确量取电镀液50mL,置于500mL烧杯中,加50mL去离子水,加适量氧化钡,调节体系pH为7~8,在烧杯上加盖表面皿后,将溶液微热;待体系沉淀的颜色由淡蓝色变为浅棕色后,停止加热;冷却至室温后,向溶液中慢慢加入10mL、30%的H2O2,反应30 min,过滤;滤饼用去离子水反复冲洗,滤液浓缩至60~70mL,将滤液转移至100mL容量瓶中,加入1mL稀硝酸(水与硝酸体积比为1∶1),定容。
1.3.4 测定待测液的电位
准确量取制备的待测电镀液25mL并置于50mL的容量瓶中,加入10mL TISAB溶液,定容为50mL后测定体系的电位。
2 结果与讨论
2.1 标准曲线与电极稳定性
将指示电极和参比电极浸入去离子水中洗涤,洗至体系的电位值低于-260mV后,测定氯离子系列标准溶液平衡电位。同时,为确定电极稳定性,将标准溶液在24h内进行3次平行测定,结果见表1。
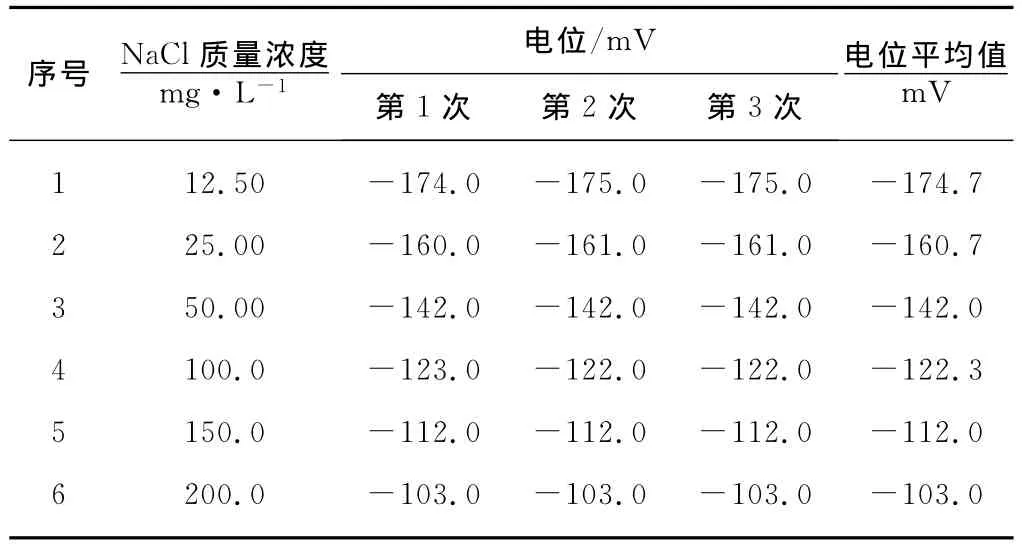
表1 氯离子系列标准溶液平衡电位
由表1可知,在连续测定过程中,电位的最大漂移值为1mV,表明电极具有良好的稳定性。将表1中的电位平均值对氯离子浓度对数作图,结果见图1。由图1可知,标准液在12.5~200mg/L范围,其质量浓度对数与电位具有很好的线性关系,线性方程为E=44.66 + 60.36lgα(Cl-),线性相关系数 R=0.9961,满足电镀液中氯离子浓度的测定。
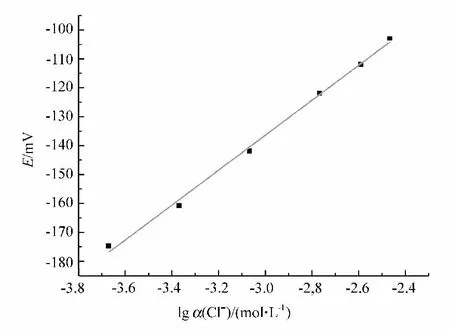
图1 含氯标准液的E-lgα(Cl-)曲线
2.2 待测试样的处理
酸性电镀液中含有大量的Cu2+、、硫添加剂及少量CN-。由行业标准(DL/T 502.4)的火力发电厂循环水中氯化物电极法测定方法可知,当测定体系中有大量时,极微量的S2-与CN-均干扰测定,故需经预处理后方能测定。除去的最佳物质为含钡化合物,为防止其他干扰物质的引入,选用BaO作沉淀剂。BaO在体系中发生如下反应:

BaO的加入,使体系产生了大量沉淀,其BaO加入量可由体系的pH值来控制,溶液的pH值为7~8较为适宜。除去后的溶液,还应消去硫化物及氰根的干扰。据文献[12]报道,电镀液中的氰根可通过H2O2(双氧水)除去。因此在除的基础上,向溶液中加入H2O2消除其他干扰离子。
2.3 待测液中氯含量的测定结果
按标准溶液的测定方法,测定4种不同电镀液的电位,为减少系统误差,每个样品重复测定3次,电位取平均值,结果见表2。原镀液氯含量=待测氯含量(mmol/L)×58.5c(NaCl)×4(稀释倍数),c(NaCl)为NaCl的浓度(mol/L)。

表2 电镀液的平衡电位及氯含量
2.4 加标回收率测试
取2号电镀液4份。每份12.50mL,分别加入2.500g/L的标准溶液0.500、1.000、1.500、2.000mL,加标样品按上述镀液处理方法处理后,配成50.0mL待测液,测定加标溶液电位,并计算氯含量。结果见表3。

表3 加标回收实验结果
由表3可知,样品测定的回收率在95.37%~103.5%之间,平均回收率为99.5%,加标回收率的相对标准偏差为3.6%
3 结论
用离子选择电极法测定酸性镀铜液中的微量氯离子,应先通过BaO沉淀剂消除,用H2O2消去硫化物及CN-的干扰,在此基础上用氯离子选择电极方法测定镀铜液中微量氯离子的含量,该方法灵敏度高,重现性好,实验结果准确、可靠。
(References)
[1]南京大学.无机及分析化学实验[M].3版.北京:高等教育出版社,1998:140-141.
[2]华中师范大学,东北师范大学,陕西师范大学.分析化学[M].3版.北京:高等教育出版社,2001:238-245.
[3]华东理工大学化学系,四川大学化工学院.分析化学[M].5版.北京:高等教育出版社,2003:193-196.
[4]张雨青.电位法测定循环水中的氯离子[J].光谱实验室,2012,29(3):1659-1662.
[5]于长珍,付二红.离子选择电极法测定水中氯含量[J].化学分析计量,2010,19(1):40-42.
[6]刘德晔,朱醇.电感耦合等离子体质谱法测定水样中氯含量[J].理化检验:化学分册,2012,48(9):1117-1118.
[7]董强,欧阳贵.酸性镀铜镀液中氯离子的分析测定及调整方法[J].电镀与涂饰,2006,25(10):56-58.
[8]曾华梁,吴仲达,陈均武,等.电镀工艺手册[M].北京:机械工业出版社,1997:176-180.
[9]杨敬娥.一种测定酸性镀铜溶液中氯离子含量的方法[J].电镀与涂饰,1998,17(4):28-29.
[10]胡荣宗,王建华,吕建平.离子色谱法测定酸性镀液中微量氯离子[J].厦门大学学报,2000,39(6):798-802.
[11]张允诚,胡如南,向荣.电镀手册[M].2版.北京:国防工业出版社,1997:295.
[12]郭崇武.漂水和双氧水组合处理含氰废水方法研究[J].电镀与精饰,2006,28(6):38-39.
