FAM64A基因对宫颈癌细胞周期调控的影响
2013-09-04徐瑲,杜刚,艾青,兰欢
徐 瑲,杜 刚,艾 青,兰 欢
(1 泸州医学院,四川泸州 646000;2 重庆医科大学)
FAM64A基因又名CATS,最早是在检测与网格蛋白组装淋巴髓系白血病基因(CALM)相互作用的酵母双杂交实验中被发现[1]。其在胸腺、脾和结肠组织中高表达,cDNA全长1517 bp,编码含238和248个氨基酸的两种异构体,蛋白分子量分别为26、27.5 kD。FAM64A蛋白定位于细胞核内,其表达可显著增加CALM基因和致白血病的CALM/AF10融合蛋白在细胞核内的定位。
目前,关于FAM64A基因生物学功能的报道在国内外还非常少,仅有2篇,即FAM64A蛋白可能参与细胞的增殖过程[2],以及可作为(APC/C分裂后期促进复合体)的作用底物促进细胞分裂由中期向后期转变[3]。但是,目前关于FAM64A在肿瘤细胞周期调控等方面的作用尚不清楚。为进一步探讨FAM64A在肿瘤细胞中的生物学功能以及其作为分子靶点用于肿瘤治疗的潜在价值,2012年11月~2013年3月,本研究观察了FAM64A在细胞周期中的表达变化、对化疗药物的敏感性,并通过siRNA抑制FAM64A的表达,观察其对宫颈癌HeLa细胞周期的影响。
1 材料与方法
1.1 材料 人宫颈癌HeLa细胞系为本实验室保存。采用DMEM培养基培养,培养基中添加10%胎牛血清(FBS)和青霉素(100 IU/mL)/链霉素(100 IU/mL),于CO2培养箱中培养。DMEM、FBS、Lipofectamine RNAiMAX、Trizol购于Invitrogen公司;PrimeScriptRT Reagent Kit购于 TaKaRa公司;阿霉素(ADR)、胸腺嘧啶脱氧核苷、诺考达唑和碘化乙啶购自Sigma公司。
1.2 方法
1.2.1 细胞DNA损伤模型制备 收集对数期生长的HeLa细胞,细胞计数仪计数,以10×105/mL接种至10 cm直径细胞培养皿(密度约为100%);置于CO2细胞培养箱培养24 h后,加入ADR至终浓度1 μmol/L;根据不同实验要求在加药后0~48 h收集细胞,制备细胞总RNA进行下一步实验。
1.2.2 M 期同步化 参照 Knehr等[4]和 Whitfield等[5]的方法,采用胸腺嘧啶脱氧核苷/诺考达唑阻断法,进行细胞M期同步化。具体实验程序略述如下:收集处于对数期生长的HeLa细胞,细胞计数仪计数,以5×105/mL接种至10 cm直径细胞培养皿。24 h后换用含2 mmol/L双重胸腺嘧啶脱氧核苷的DMEM培养基,培养17~18 h。PBS洗涤3次,换用正常DMEM培养基培养4 h。换用含100 ng/mL诺考达唑的DMEM培养基,培养12 h,此时约有90%的细胞被阻滞在M期。收集包括漂浮细胞在内的所有细胞,PBS洗涤2次,换用正常DMEM培养基重新接种于10 cm直径细胞培养皿,此时细胞周期阻滞得以释放,细胞将依次进入 G1、S、G2、M 期。在释放后 0、4、8、12、16、18 h收集细胞,分别制备单细胞悬液和总RNA样品,进行FACS、RT-PCR分析。
1.2.3 siRNA的设计、合成和筛选 以 GeneBank公布的FAM64A mRNA序列为模板,通过Dharmacon公司的软件在线设计FAM64A的短链干扰siRNA。一共设计3种候选序列,并设立1个阴性对照siRNA,委托上海GenePharma公司进行体外化学合成。获得FAM64A的短链干扰siRNA后,进行瞬时转染,分别制备细胞裂解液和总RNA,采用半定量RT-PCR方法筛选确认高效的PRR11 siRNA。
1.2.4 瞬时转染 短链 siRNA转染采用 Lipofectamine RNAiMAX试剂进行。以6孔板为例,每孔中加入500 μL opti-MEMⅠ和30 pmol siRNA,混合后再加入5 μL RNAiMAX,混匀后室温放置20 min。此时以不含抗生素的DMEM培养基制备细胞悬液,细胞计数仪计数,使细胞密度达(10~40)×104/mL。每孔中加入2.5 mL细胞悬液,与 siRNA混合液混合后,CO2细胞培养箱培养48~72 h。转染后48~72 h收集细胞,制备总RNA后进行下一步实验分析。
1.2.5 FAM64A表达水平检测 采用常规半定量RT-PCR方法。收集正常传代生长和处理后的HeLa细胞,参照Invitrogen公司Trizol使用说明书提取细胞总 RNA。取 1 μg 总 RNA,加入 1 μL 50 μmol/L随机引物、1 μL 10 mmol/L dNTP Mixture,DEPC 水补足至10 μL,65℃温育5 min,冰上冷却后依次加入 4.5 μL DEPC 水、4 μL 5 × PrimeScriptTMBuffer、0.5 μL 40 U/μL RNase Inhibitor 和 1 μL Prime-ScriptTMRTase,30℃ 温育 10 min,42℃ 温育 60 min,70℃ 15 min终止反应,cDNA产物原液稀释20倍后用作PCR模板。GAPDH作为内参对照,PCR扩增反应体系:1 μL 10 × PCR buffer、1 μL 2.5 mmol/L dNTPs、20 × cDNA 模板1 μL、0.1 μL Taq 酶(5 U/μL)、0.4 μL 10 μmol/L 上下游引物混合液,双蒸水补足至10 μL。扩增程序:95℃变性2 min,然后用逐步程序95℃ 15 s、60℃ 15 s、72℃ 20 s完成19~35个循环,最后72℃延伸5 min。2%琼脂糖凝胶电泳检测PCR扩增产物,EB染色,凝胶成像系统照相。
1.2.6 细胞周期分析 收集细胞,PBS洗涤,加入1 mL无水乙醇混悬细胞,4℃放置4 h以上或过夜。低速离心收集细胞,PBS洗涤,加入500 μL FACS缓冲液(PBS+0.1%BSA+0.01%NaN3)混悬细胞。再加入 2.5 μL 10 mg/mL 的 RNase,室温放置 15 min。然后加入25 μL 1 mg/mL的碘化丙啶(PI),室温避光放置15 min,流式细胞仪上机分析。
1.2.7 统计学方法 采用SPSS15.0统计软件。数据以表示,组间比较采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 DNA损伤后FAM64A表达水平变化 ADR作用细胞 0、3、6、12、24、48 h 时,RT-PCR 检测FAM64A基因灰度值分别为 6.78±0.57、2.48±0.31、2.50 ±0.38、1.72 ±0.17、0.78 ±0.09、0.41 ±0.05;3、6、12、24、48 h 时点与 0 时点比较,P 均 <0.05。见图1。
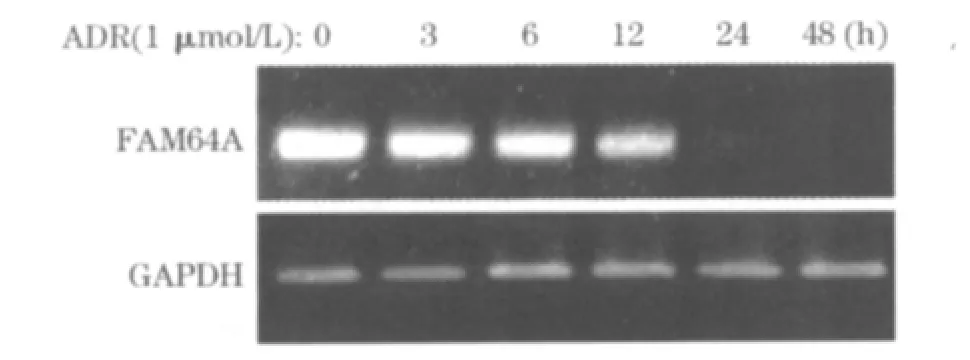
图1 ADR作用不同时间点的HeLa细胞FAM64A基因电泳图
2.2 M期细胞同步化分析结果 在细胞同步化后,采用细胞流式分析不同时间点的细胞周期分布情况,约90%的HeLa细胞被阻滞在M期,释放后的细胞依次同步进入 G1、S、G2、M 期,并回到 G1期,证实同步化处理成功。见表1。
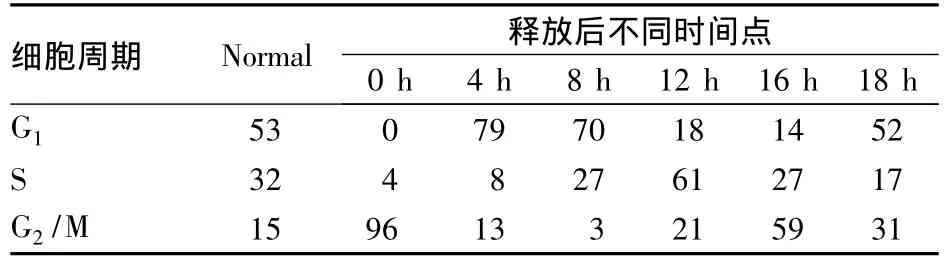
表1 同步化细胞释放后不同时间点细胞周期分部情况(%)
2.3 同步化细胞释放后FAM64A表达水平变化同期化细胞释放后 0、4、8、12、16、18 h,RT-PCR 检测 FAM64A 基因灰度值分别为 0.72 ±0.18、0.45 ±0.11、0.64 ±0.14、0.52 ±0.11、0.94 ±0.22、0.54 ±0.13;4、12、16 h 时点与 0 时点比较,P 均 <0.05。见图2。

图2 同步化细胞释放后不同时间点FAM64A基因电泳图
2.4 FAM64A siRNA对FAM64A表达的影响 本研究共合成了3个针对FAM64A mRNA编码区不同靶点的 siRNA(siRNA1、siRNA2、siRNA3),同时设置siRNA转染对照组。对照组、siRNA1组、siRNA2组、siRNA3组转染后48 h FAM64A基因表达灰度值分别为1.19 ±0.18、0.55 ±0.09、0.57 ±0.11、0.77±0.17;siRNA1组、siRNA2组、siRNA3组与对照组比较,P均 <0.05。结果显示,siRNA1抑制FAM64A表达的效果最好,用于后续实验。见图3。
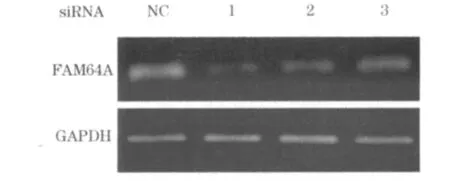
图3 转染48 h后FAM64A基因电泳图
2.5 FAM64A表达抑制对HeLa细胞周期的影响在转染FAM64A siRNA1后48 h,使用流式细胞术分析FAM64A表达抑制对HeLa细胞周期的影响,结果见表2。
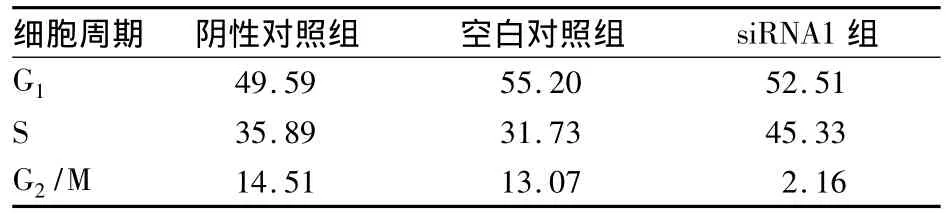
表2 FAM64A表达抑制对HeLa细胞周期的影响(%)
3 讨论
恶性肿瘤的发生是一个多因素作用、多基因参与、经过多个阶段才最终形成的极其复杂的生物学现象,其中癌基因和抑癌基因表达失调,进而诱发细胞生长失控在肿瘤的发生发展中起着至关重要的作用[6,7]。FAM64A 基因是新近发现的参与细胞周期调控的基因,可能与细胞的生长增殖以及肿瘤的发生有关。因此,开展FAM64A基因在肿瘤细胞中的周期调控及其对细胞周期等的影响的研究,对于阐明其在肿瘤发生发展中的作用具有重要意义。
本研究发现,在ADR处理HeLa细胞构建的细胞损伤模型中,FAM64A的表达量随着时间进程显著降低。ADR是一种化疗药物,可阻断DNA和RNA的合成[8,9],并通过刺激内源性 p53、p21WAF1/CIP1和Bcl-2家族的表达增加而诱导细胞凋亡[10]。本研究结果提示,FAM64A参与了细胞损伤的应答过程,其作用机制可能是在细胞周期调控过程中参与DNA的合成,也可能通过增加细胞的抗凋亡活性从而促进肿瘤的发生。
细胞周期是由多个正性和负性调节因子有序而严格调控的过程,原癌基因和抑癌基因产物直接或间接参与周期内信号传导,从而对细胞周期和细胞增殖进行调控,任何一种调节步骤的失调都会导致细胞增殖的紊乱继而引起癌症的发生[11]。在细胞周期表达谱分析中我们也发现,FAM64A是一个G2/M期基因,它和已知的G2/M期基因Plk1一样,在G2/M期表达水平升高,而在 G1、S期表达降低[12,13],提示 FAM64A 是一个参与细胞生长增殖的癌基因。Zhao等[3]发现,FAM64A扩散性地分布于有丝分裂细胞,而不与染色体、着丝粒、纺锤体和中心体相互结合,提示FAM64A在细胞质中发挥作用而参与细胞周期调控。此外,虽然FAM64A可推动有丝分裂中期向后期转变,但它并不影响G2/M期检测点蛋白的水平,抑制其表达也不引起检测点的偏移。本研究也发现,siRNA诱导的FAM64A表达沉默可诱发HeLa细胞的S期停滞,而未出现如Plk1一样的G2/M期停滞[14,15]。 由 此 提 示,FAM64A可能与S期相关蛋白相互作用而在细胞周期进程中发挥作用。在未来的工作中,还需要大量的实验来探讨FAM64A在细胞周期调控中的相互作用蛋白及具体作用机制,从而进一步阐明其在肿瘤发生发展中的作用机制和功能。
总之,本研究发现,FAM64A能增加细胞的抗凋亡活性并参与细胞周期的调控,它可能是一个潜在的肿瘤治疗靶点,为进一步研究FAM64A在肿瘤中的作用奠定基础。
[1]Archangelo LF,Gläsner J,Krause A,et al.The novel CALM interactor CATS influences the subcellular localization of the leukemogenic fusion protein CALM/AF10[J].Oncogene,2006,25(29):4099-4109.
[2]Archangelo LF,Greif PA,Hölzel M,et al.The CALM and CALM/AF10 interactor CATS is a marker for proliferation[J].Mol Oncol,2008,2(4):356-367.
[3]Zhao WM,Coppinger JA,Seki A,et al.RCS1,a substrate of APC/C,controls the metaphase to anaphase transition[J].Proc Natl Acad Sci U S A,2008,105(36):13415-13420.
[4]Knehr MB,Poppe M,Enulescu M,et al.A critical appraisal of synchronization methods applied to achieve maximal enrichment of HeLa cells in special cell cycle phase[J].Exp Cell Res,1995,217(2):546-553.
[5]Whitefield ML,Sherlock G,Saldanha AJ,et al.Identification of genes periodically expressed in the human cell cycle and their expression in tumors[J].Mol Bio Cell,2002,13(6):1977-2000.
[6]Hanahan D,Weinberg RA.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[7]Dang LH,Bettegowda C,Agrawal N,et al.Targeting vascular and avascular compartments of tumors with C.novyi-NT and anti-microtubule agents[J].Cancer Biol Ther,2004,3(3):326-337.
[8]Momparler RL,Karon M,Siegel SE,et al.Effect of adriamycin on DNA,RNA,and protein synthesis in cell-free systems and intact cells[J].Cancer Res,1976,36(8):2891-2895.
[9]Pigram WJ,Fuller W,Hamilton LD.Stereochemistry of intercalation:interaction of daunomycin with DNA[J].Nature New Biol,1972,235(53):17-19.
[10]Bilim VN,Tomita Y,Kawasaki T,et al.Adriamycin(ADM)induced apoptosis in transitional cell cancer(TCC)cell lines accompanied by p21 WAF1/CIP1 induction[J].Apoptosis,1997,2(2):207-213.
[11]Orlando DA,Lin CY,Bernard A,et al.Global control of cell-cycle transcription by coupled CDK and network oscillators[J].Nature,2008,453(7191):944-947.
[12]Hamanaka R,Smith MR,O'Connor PM,et al.Polo-like kinase is a cell cycle-regulated kinase activated during mitosis[J].J Biol Chem,1995,270(36):21086-21091.
[13]Lee KS,Yuan YL,Kuriyama R,et al.Plk is an M-phase-specific protein kinase and interacts with a kinesin-like protein,CHO1/MKLP-1[J].Mol Cell Biol,1995,15(12):7143-7151.
[14]Reagan-Shaw S,Ahmad N.Silencing of polo-like kinase(Plk)1 via siRNA causes induction of apoptosis and impairment of mitosis machinery in human prostate cancer cells:implications for the treatment of prostate cancer[J].FASEB J,2005,19(6):611-613.
[15]Lan H,Zhu J,Bu Y,et al.Rapid functional screening of effective siRNAs against Plk1 and its growth inhibitory effects in laryngeal carcinoma cells[J].BMB Rep,2010,43(12):818-823.
