声致化学发光法应用于水果中抗氧化剂对OH·清除能力的研究
2013-09-04聂迎春毛青青吕家根
鲁 芳,段 晶,聂迎春,毛青青,吕家根,*
(1.陕西师范大学化学化工学院,陕西西安710062;2.青海师范大学化学系,青海西宁810008)
研究证明[1-2],足够强度的超声波可以产生空化现象,在空化气泡崩塌的瞬间可以产生高温、高压的热点,并伴随声致发光。空化所产生的这些极端的物理条件和能量足以使 H2O发生裂解,产生OH·[2-6]。如果溶液中存在化学发光试剂,如 luminol(鲁米诺)、lucigenin(光泽精)等,则与超声所产生的自由基迅速氧化发光试剂产生很强的化学发光,被称之为声致化学发光(sonochemiluminescence,SCL)[7-8]。有关超声空化产生 OH·和 SCL 已有许多深入的研究[6,9-10],并且推断出 SCL 强度与 OH·的量有关。由此可见,超声可作为一种OH·的生成源,而SCL可作为定量测量水溶液中OH·的有效工具。基于此,SCL法可以实现抗氧化剂清除OH·能力的评价。目前,已有的抗氧化性的研究方法[11-17],都是通过测量剩余的OH·的量来间接测定抗氧化剂清除OH·的能力。然而,由于OH·的反应活性大,寿命短、存在浓度低,其本身很难单独稳定存在。因此,这些方法也就受到了一定的约束,而SCL具有如下潜在的优势:物试剂的产生OH·可以仅仅对抗氧化剂清除OH·的能力进行评价;能在线、均相产生OH·使整个反应避免混合和扩散过程的影响;声致化学发光与OH·的产生同步进行,可以获得对OH·的直接、灵敏、快速的测定;使用仪器及实际简单。基于此,本实验构建了SCL分析法并应用于抗氧化剂对OH·的清除能力的评价,利用水在声场作用下产生的OH·,OH·氧化luminol发出强烈的声致化学发光,而抗氧化剂的加入将会猝OH·因而清除声致化学发光,通过测量SCL的清除情况可以实现抗氧化剂对OH·清除能力的评价。众所周知,水果不仅可以提供人体所需的维生素、矿物质和纤维素等,而且还含有许多植物抗氧化物质,如VC、VE、类黄酮、花色素等,这些物质具有较强的抗氧化活性,因此,在最优条件下,对柳叶桔、草莓、圣女果、猕猴桃、苹果、西瓜、油桃、菠萝、甜瓜、大红柚、火龙果、赣南脐橙十二种水果在体外模拟生理条件下的OH·清除能力进行了评价。
1 材料与方法
1.1 材料与仪器
柳叶桔、草莓、圣女果、猕猴桃、苹果、西瓜、油桃、菠萝、甜瓜、大红柚、火龙果、赣南脐橙 均购自当地超市。
水果抗氧化剂储备液 十二种水果取果肉部分,各称取50.0g于200.0mL二次水中,匀浆5min,减压过滤,滤液2000 r/min离心5min,收集上层液备用。
Luminol 陕 西师 范 大学 自制;NaCl、KCl、KH2PO4、NaHPO4·12H2O 分析纯,均购自国药集团化学试剂有限公司。
(1)0.01 mol/L pH7.4 PBS缓冲液 准确称取NaCl 0.80g,KCl 0.20g,KH2PO40.20g,Na2HPO4·12H2O 2.90g,二次水溶解并定容于1000mL容量瓶中,充分摇匀备用。
(2)1.0×10-2mol/L luminol储备液 准确称取luminol 1.772g,用0.01mol/L NaOH溶解后,二次水定容于1000mL棕色容量瓶中,放置暗处保存,两周使用。使用时,用pH7.4 PBS缓冲液稀释至所需浓度实验用水为二次蒸馏去离子水。
MPI-A型多功能化学发光/生物发光分析系统西安瑞迈电子科技有限公司;DH48S-S时间继电器 上海卓一电子有限公司;超声发生器 由商品化仪器改装,功率为35W;陶瓷电压片 深圳市安之能电子技术有限公司;多功能食品加工机 香港福尔康有限公司;H-1650高速离心机 长沙湘仪离心机仪器有限公司。
1.2 SCL分析装置构造
SCL分析装置如图1所示。仪器装置由化学发光仪、光电倍增光、计算机、时间继电器、超声发生器、声致发光池、注射器、废液管链接构成。
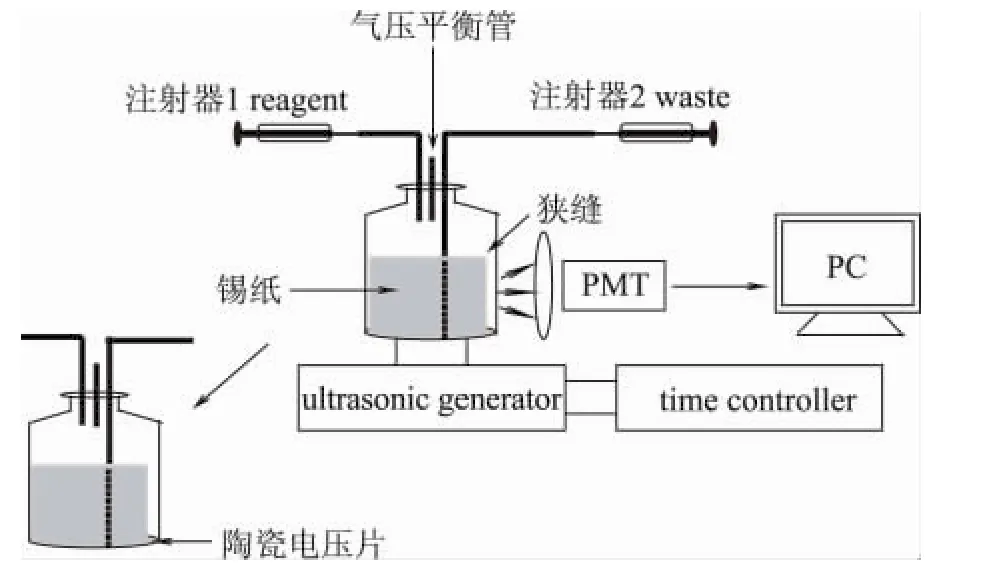
图1 声致化学发光分析示意图Fig.1 Schematic diagram of the SCL system
在光电倍增管暗盒内安装声致化学发光池。声致化学发光池由一个地部半径2.5cm,体积15mL的玻璃小瓶加工而成,用砂轮将玻璃瓶底部打磨掉,以环氧树脂粘结一相同直径的陶瓷电压片,陶瓷电压片的正负两极分别通过导线与超声发生器连接。玻璃瓶口用橡胶塞盖住并用环氧树脂胶密封,橡胶塞上分别插上三根内径为1mm聚氯乙烯管,其中两短一长,两个短管分别用于进样和保持声致化学发光池内外气压平衡,长度为1cm,长管用于废液的输出,为6cm。样品管和废液管连接一段硅胶管传出光电倍增管壳体外,声致化学发光池池体周围包一层锡纸用来减少光的反射,增强声致化学发光,留1cm宽的狭缝作为声致化学发光的入射缝。一定体积的样品溶液通过注射器推入到声致化学发光池后,打开时间继电器,时间继电器按设置好的工作模式循环开关,当溶液受到超声辐射时,发出SCL信号,超声停止则SCL消失。光电倍增管将接收到的信号转换成电信号输入计算机,计算机对输入的信号进行数据处理并记录SCL随时间的谱图,根据谱图逢高进行定量分析。一次测定结束后,用注射器将池体中的废液抽出,用超纯水清洗3次后,重复以上过程,进行下一次测定。
1.3 实验方法
将流路图按图1所示连接,开启化学发光仪,超声发生器,设置化学发光仪负高压为600V。分别进行声致化学发光池中溶液体积、超声脉冲作用时间、超声脉冲间隔以及luminol浓度对SCL强度和精密度影响的考察。
1.3.1 声致化学发光池溶液体积的考察 声致化学发光池中溶液体积影响SCL的强度和精密度。在固定luminol浓度为1.0×10-6mol/L,超声脉冲作用时间为0.5s,超声脉冲间隔时间为10s的情况下,分别考察在1.0~10.0mL不同溶液体积对SCL强度和精密度的影响。
1.3.2 超声脉冲作用时间的考察 超声脉冲作用时间影响SCL的强度和精密度。在固定luminol浓度为1.0×10-6mol/L,超声脉冲间隔时间为10s,声致化学发光池中溶液体积为5mL的情况下,考察了在0.1~10s时间范围内超声脉冲作用时间对SCL强度和精密度的影响。
1.3.3 超声脉冲间隔的考察 超声脉冲间隔影响SCL的强度和精密度。在固定luminol浓度为1.0×10-6mol/L,超声脉冲作用时间为0.1s,声致化学发光池中溶液体积为5mL的情况下,考察了在2~18s时间范围内超声脉冲间隔时间对SCL强度和精密度的影响。
1.3.4 luminol浓度的考察 发光试剂luminol浓度是影响SCL强度和精密度的决定因素。在超声脉冲作用时间为0.1s,超声脉冲间隔时间为10s,声致化学发光池中溶液体积为5mL的情况下,考察了在1.0×10-7~1.0 ×10-3mol/L 范围内不同浓度的 luminol溶液对SCL强度和精密度的影响。
1.3.5 水果抗氧化能力的测定 在luminol浓度为1.0×10-3mol/L,超声脉冲作用时间为0.1s,超声脉冲间隔时间为10s,声致化学发光池中溶液体积为5mL的最优实验条件下,对选定的十二种水果的抗氧化能力进行了测定。具体操作如下:准确移取2.5mL,1.0×10-3mol/L鲁米诺溶液和2.5mL二次水于10mL烧杯中,用注射器将5.0mL将溶液导入声致化学发光池,开启时间继电器,超声发生器按设定的时间循环工作5次,检测到的声致化学发光强度为I0,关闭时间继电器,用注射器将声致化学发光池中的废液导出,用二次水将其清洗3次;准确移取2.5mL,1.0×10-3mol/L鲁米诺溶液和2.5mL不同浓度的样品溶液于10mL烧杯中,重复以上测定,检测到声致化学发光强度为I,以清除率表示抗氧化活性的能力强弱。
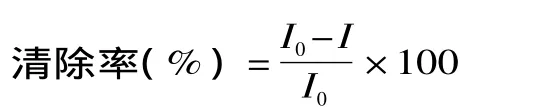
2 结果与讨论
2.1 声致化学发光池溶液体积的影响
图2显示了在1.0~10.0mL不同溶液体积对SCL强度和精密度的影响。结果表明,当溶液体积小于5.0mL,SCL强度随样品体积的增大而增大,超过5.0mL,SCL强度增大的趋势不明显。从测定结果的相对标准偏差值可以看出,当溶液体积为5.0mL时可以得到最好的精密度。因此,后续实验选用溶液体积为5.0mL。

图2 溶液体积对声致化学发光重现性的影响Fig.2 The effect of solution vloume on SCL
2.2 超声脉冲作用时间的影响
图3显示了在0.1~10s时间范围内,超声脉冲时间对SCL体系强度和精密度的影响。结果表明,当超声脉冲作用时间越长体系的精密度越差,当超声脉冲作用时间为0.1s时,体系的精密度最好。这可能是由于超声空化气泡崩塌时所产生的瞬间高温带来的热量累积使得体系本体溶液的温度不断上升,而本体溶液的温度变化恰恰不利于SCL分析体系的精密度。因此,相对短的超声脉冲作用时间有利于得到相对好的重现性。故后续实验中,选择超声脉冲作用时间为0.1s。
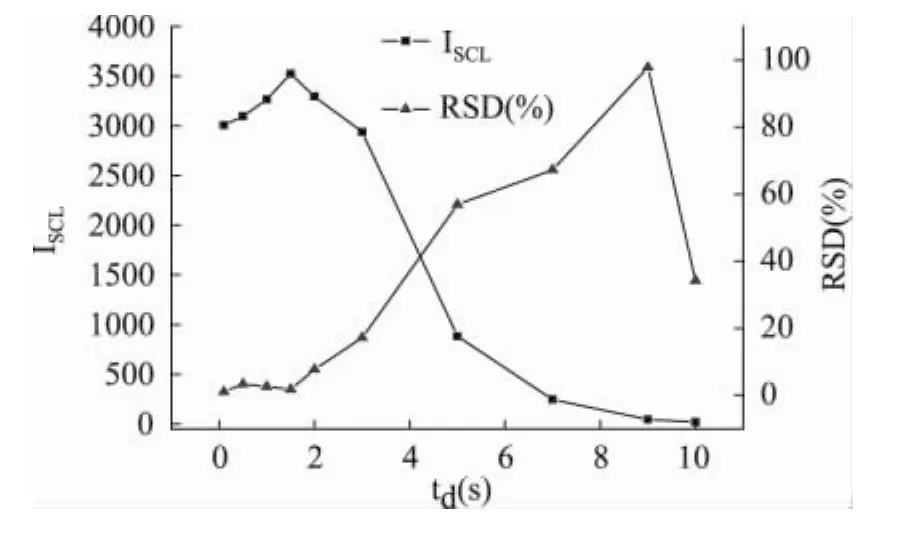
图3 超声脉冲时间td对声致化学发光重现性的影响Fig.3 The effect of ultrasonic pulse duration tdon SCL
2.3 超声脉冲间隔的影响
如图4显示了在2~18s范围内,考察了超声脉冲间隔对SCL强度和精密度的影响。结果表明,超声脉冲时间间隔越长,体系的精密度越好,超声脉冲间隔超过10s后,体系的精密度基本趋于平稳,因此,在后续实验中,选择超声脉冲间隔为10s。
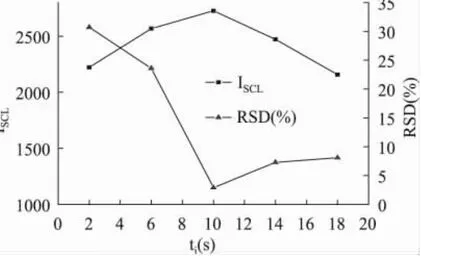
图4 超声脉冲时间间隔ti对声致化学发光重现性的影响Fig.4 The effect of ultrasonic pulse duration interval tion SCL
2.4 luminol浓度的影响
图5显示了在 1.0 ×10-7~1.0 ×10-3mol/L 范围内,luminol不同浓度对SCL强度和精密度的影响。结果表明,发现随鲁米诺浓度的增大,SCL强度逐渐增大,当浓度为1.0×10-3mol/L时发光强度最大且有很好的精密度。此外,相对于超声所产生的OH·的浓度,这一浓度下luminol分子已经大大过量,可以保证超声所产生的OH·完全反应,因此,在后续实验中选用鲁米诺浓度为1.0×10-3mol/L。
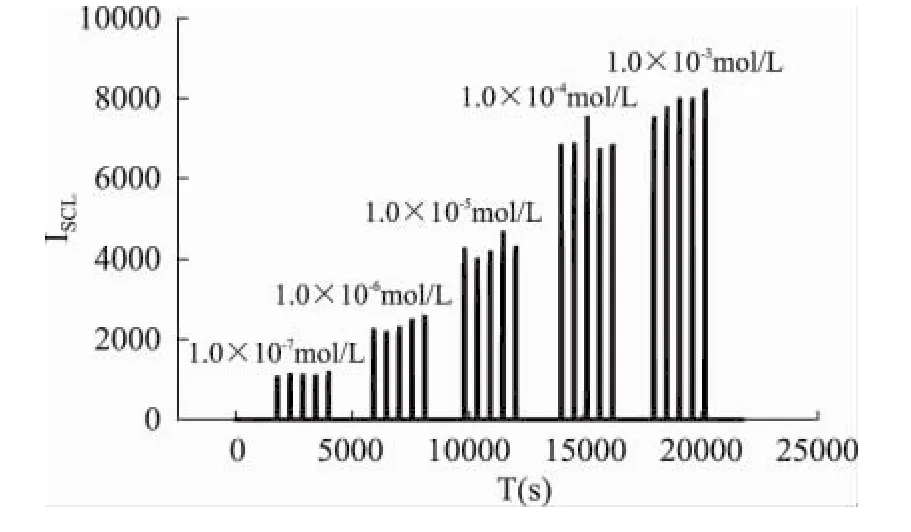
图5 鲁米诺浓度对声致化学发光强度的影响Fig.5 The effect of luminol concentration on SCL
2.5 缓冲溶液的选择
为了实现模拟生理条件下的体外测定抗氧化剂清除OH·的能力,我们选择使用pH7.4的生理缓冲液。考虑到OH·的强氧化性和超声空化对有机物的降解作用,我们选择使用纯无机盐PBS缓冲溶液。
2.6 十二种水果的抗氧化性的比较
在最优条件下,实验考察了在SCL体系中加入不同浓度的柳叶桔、草莓、圣女果、猕猴桃、苹果、西瓜、油桃、菠萝、甜瓜、大红柚、火龙果、赣南脐橙水果汁液后对SCL强度的影响,并计算了相应的清除率,结果如表1所示。
一般用发光清除率的50%的样品浓度IC50值来评价样品对 OH·的清除能力。IC50越小,样品清除OH·的能力越强,反之,IC50越大,样品清除OH·的能力越弱。由表2中的线性方程计算出十二种水果的IC50值。结果表明,赣南脐橙清除OH·的能力最强,甜瓜清除OH·的能力最弱。
从实验结果可以看出,不同水果的抗氧化活性存在较大的差异,主要的原因除了种类不同外,可能的影响因素还包括水果采收时的成熟度、种植生长条件、地域差异、采收后的贮存条件、抗氧化活性物质在水果中含量的高低、抗氧化物质组成以及不同的抗氧化活性物质相互之间的作用有关。从抗氧化性方面分析,所测的十二种水果的抗氧化活性与文献中测定的结果基本一致[19-22],对自由基的清除活性顺序为赣南脐橙>大红柚>柳叶桔>菠萝>猕猴桃>草莓>火龙果>圣女果>苹果>油桃>西瓜>甜瓜。最强的与最弱的相差6倍。
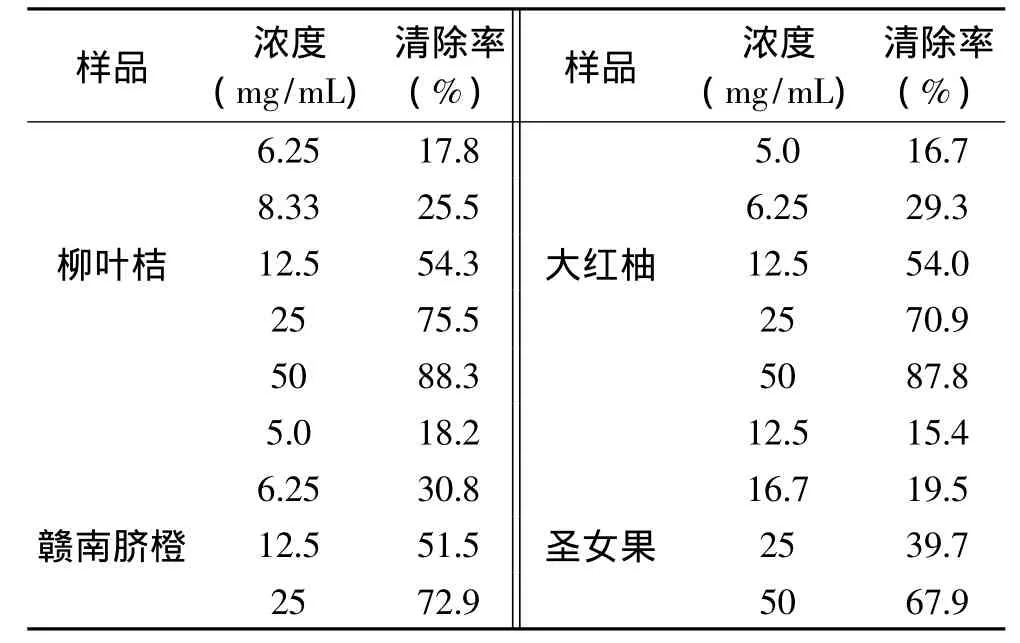
表1 12种水果对OH·清除的结果Table 1 The OH·scavenging capacities of twelve kinds of fruits

续表

表2 12种水果的OH·清除率与声致化学发光的关系(n=5)Table 2 The linear relationship between the term,SCL and the OH·scavenging capacities of twelve kinds of fruits(n=5)
3 结论
3.1 采用SCL分别测定了十二种水果对OH·清除的能力,实验结果表明,十二种水果清除自由基的活性顺序为:赣南脐橙>大红柚>柳叶桔>菠萝>猕猴桃>草莓>火龙果>圣女果>苹果>油桃>西瓜>甜瓜。
3.2 我们建立的SCL法,具有分析频率高、稳定性好、操作简单、安全快速、耗费低、灵敏度高的优点,可用于多种果蔬、饮料制品、天然产物及药物的抗氧化性的研究,进一步拓宽了声致化学发光法的应用领域。
[1]冯若,李化茂.声化学及其应用[M].合肥:安徽科技出版社,1992.
[2]Suslick K S.Sonochemistry[J].Science,1990,247:1439-1445.
[3]Makino K,Mossoba M M,Riesz P.Chemical effects of ultrasound on aqueous solution:Evidence for·OH and·H by Spin Trapping[J].Journal of the American Chemical Society,1982,104:3537-3539.
[4]Suslick K S.The chemical effects of ultrasound[J].Scientific American,1989,260:80-86.
[5]Fischer C H,Hart E J,Henglein A.Ultrasonic irradiation of water in the presence of18,18O2:Isotope exchange and isotopic distribution of H2O2[J].Journal of Physical Chemistry,1986,90:1954-1956.
[6]Hart J,Henglien A.Sonochemistry of aqueous solution:H2-O2combustion in cavitation bubbles[J].JournalofPhysical Chemistry,1987,91:3654-3656.
[7]Duca M D,Yeager E,Davies M O,et al.Isotopic techniques in the study of the sonochemical formation of hydrogen peroxide[J].Journal of the Acoustical Society of America,1958,30:301-307.
[8]McMurray H N,Wilson B P.Mechanistic and spatital study of ultrasonically in duced luminol chemiluminescence[J].Journal of Physcal Chemistry A,1999,103:3955-3962.
[9]Petrier C,Lamy M - F,Francony A,et al.Sonochemical degradation of phenol in dilute aqueous solution:comparison of the reaction reats at 20 and 487 kHz[J].Journal of Physical Chemistry,1994,98:10514-10520.
[10]Ashokkumar M,Hodnett M,Zeqiri B,et al.Acoustic emission spctra from 515 kHz cavitation in aqueous solution containing surface- active solutes[J].Journal of the American Chemical Society,2007,129:2250-2258.
[11]Park P J,Je J Y,Kim S K.Free radical scavenging activity of chitooligosaccharides by electron spin resonance spectrometry[J].Journal of Agricultural and Food Chemistry,2003,51:4624-4627.
[12]Koleva I I,Niederlalnder H A G,Van Beek Y A.Application of ABTS radical cation for selective on-line detection of racidal scavengers in HPLC evaluates[J].Analytical Chemistry,2001,73:3373-3381.
[13]王川.葡萄籽单宁的抗氧化性研究[J].食品科技,2009,34(2):184-187.
[14]李华,李勇,吴莹,等.ABTS+法测定葡萄酒抗氧化活性的研究[J].西北农林科技大学学报:自然科学版,2009,37(11):90-96.
[15]李春阳,许时婴,王璋.DPPH法测定葡萄籽原花青素清除自由基的能力[J].食品与生物技术学报,2006,25(2):102-106.
[16]吴建中,欧仕益,汪勇.甘蔗叶中黄酮类物质的提取及其抗氧化性研究[J].现代食品科技,2009,25(2):165-167.
[17]Hirayama O,Yida M.Evaluation of hydroxyl radiealscavenging ability by Chemiluminescence[J].Analytical Biochemistry,1997,251:297-299.
[18]方敏,王耀峰,宫智勇.15种水果和33种蔬菜的抗氧化活性研究[J].食品科学,2008,28(10):97-100.
[19]郭长江,韦京豫,杨继军,等.66种蔬菜、水果抗氧化活性的比较研究[J].营养学报,2003,25(2):203-207.
[20]余小林,孟凌华,邓瑞君,等.数种果蔬的抗氧化活性评价[J].食品科学,2001,22(12):52-56.
[21]张名位,郭宝江.果蔬抗氧化作用研究进展[J].华南师范大学学报:自然科学版,2001,4:115-121.
