大腹园蛛次壶腹腺丝的表达
2013-09-04杨子江陈格飞孟清
杨子江,陈格飞,孟清
东华大学生物科学与技术研究所,上海 201620
蜘蛛丝 (Spider silk) 是一种天然蛋白质纤维,材料学特性卓越[1-2],作为一种生物大分子多聚物,易于生物降解且具有良好的生物兼容性,被越来越多地用于药载运输和细胞组织工程等多方领域[3-6]。蜘蛛可分泌 6种蛛丝纤维,其中次壶腹腺丝 (又称临时捕获丝) 主要用于加固蛛网和捕猎等,具有和牵引丝相似的优良材料学性能,但不同的是,在水环境中临时捕获丝不发生超收缩现象,这一特点使其具有特殊的应用价值[6-9]。
现今,蛛丝蛋白的研究多以牵引丝 (Major ampullate silk) 和鞭毛状丝 (Flagelliform) 为主,主要通过其特征模块的改造和拼接,表达出串联的重组蛛丝蛋白,进行相关方面的研究[10-13]。而这些重组蛛丝远远缺失了天然蛛丝的性质及研究价值,如何实现仿生蛛丝的表达是当今首要解决的问题。自 1997起科学家就开始尝试采用各类系统表达蛛丝蛋白,包括大肠杆菌、酵母、昆虫、烟草、老鼠以及山羊等[2,14]。由于蛛丝蛋白序列重复度高且甘氨酸 (Glycine) 和丙氨酸(Alanine) 含量大 (高于60%),导致表达中容易出现特殊的 mRNA二级结构、转录不完全和翻译提前终止等现象,因而常出现表达量低、产物可溶性差、大小不均一等结果,到目前为止,尚没有一个合适的表达系统可用于蛛丝蛋白的大规模生产。
近期,世界上首次报道了大腹园蛛Araneus ventricosus临时捕获丝蛋白 (Minor ampullate spidroin,MiSp) 全长编码基因序列,该蛋白序列富含Gly和 Ala (约为64%),且主要由GX、GXX、GXXX和poly-A等重复模块组成[15]。为A. ventricosusMiSp全序列以及其他丝蛋白基因的表达,寻求合适的表达系统,本研究以大肠杆菌BL21(DE3) 的表达为参照,在毕赤酵母GS115中首次尝试了MiSp重复编码区的部分序列的表达。该序列长1 348 bp,我们将它分别导入GS115和 BL21(DE3) 表达载体 pPic3.5和 PKT,并在GS115及 BL21(DE3) 中诱导表达。表达产物经Ni-NTA纯化后由SDS-PAGE和Western blotting检测,结果表明两种系统都可成功表达该段序列,且可溶性好。相比而言,优化后的毕赤酵母GS115系统的表达水平 (产量/产率:相对表达量) 明显高于大肠杆菌BL21(DE3),就自身未优化前也有很大提高 (约6~7倍)。表达产物相对完整稳定,纯化回收效率也远高于大肠杆菌系统。由此,毕赤酵母表达系统相比大肠杆菌系统更适合蛛丝蛋白重复片段的表达,是一种更好的天然蛛丝蛋白表达宿主。本研究为选择天然蛛丝蛋白基因表达系统提供了线索,也为A. ventricosusMiSp全序列的表达奠定了前期实验基础。
1 材料与方法
1.1 材料
MiSp阳性克隆由早期建立的A. ventricosusfosmid文库筛选鉴定得到。实验所用酵母表达载体pPic3.5购自Invitrogen公司,大肠杆菌表达载体PKT则由PET32a (+) 改造而来。实验所用的宿主菌E. coliBL21 (DE3)、DH5α和P. pastorisGS115分别购置Merck公司、上海生物工程技术有限公司和Invitrogen公司。DNA限制性内切酶和T4 DNA连接酶购自Fermentas公司。Phusion mix购自 NEB公司。质粒抽提和胶回收试剂盒购自上海生物工程技术有限公司。酵母基因组抽提试剂盒购自天根公司。蛋白纯化Ni-NTA购自Qiagen公司。6×His-tag, anti-mouse,mAb抗体购自 Merck公司。Western blotting试剂盒购自Invitrogen公司。实验中所用培养基配方参见分子克隆第3版[24]。
1.2 酵母表达载体PIC3.5-P1的构建、转化及阳性克隆GS115: PIC3.5-P1的鉴定
以A. ventricosusfosmid文库筛选鉴定的MiSp阳性克隆为模板,设计 PCR引物 (P1和P2,见表1),并分别在引物上下游引入酶切位点BamHⅠ和EcoRⅠ。PCR扩增目的片段P1经酶切后与pPic3.5载体连接,命名为PIC3.5-P1,该重组质粒分别经酶切和测序鉴定。P1编码序列如图1所示。
参照Invitrogen公司的酵母表达手册,将由StuⅠ单切线性化的 PIC3.5-P1重组质粒转入GS115感受态细胞,涂布于 MD平板,30 ℃倒置培养3~5 d。挑取单克隆扩大培养,采用天根生物科技有限公司酵母基因组提取试剂盒抽提酵母GS115: PIC3.5-P1重组基因组,并以其上特定序列为模板进行PCR检测,引物P3和P4 (见表 1)。
1.3 PIC3.5-P1在酵母中的表达优化和鉴定
挑取阳性重组子单克隆至50 mL BMGY培养液中,30 ℃、250 r/min振荡培养。每3 h取样测培养液吸光度 (OD600),并绘制生长曲线图。

图1 P1编码的氨基酸序列 (与intein-his融合表达)Fig. 1 Protein sequence deduced from P1 (fused with intein and his). The letter in bold: amino acid sequence of intein.There are 8 phosphorylation sites showed in 3333: SSAD, SANE, VGTGTGSSAGYGRGAGAGAGAGAAAGSGAG AALK, KGREVLSY, LSYNE, SIK, TVR, TRAE; and the third is most like to happen. There are 2 glycosylation sites showed in ( ): NETL, NSTV.
将重组GS115接种于50 mL BMGY中,同时引入对照 (空酵母菌GS115和带有pPic3.5空载体的GS115菌株),30 ℃、250 r/min摇床培养至OD600达 2~6,约 18~20 h。方案 1 (常规组):直接取 BMGY培养液,离心收集菌体,适量转接至BMMY培养基,至OD600达0.8~1.0,每24 h补加甲醇使其浓度保持0.5%,诱导48 h。方案2(优化组):取1~2 mL培养液至新鲜50 mL BMGY培养基至OD600达 0.1~0.2,250 r/min摇床培养至OD600达0.8~1.0,离心收集菌体,将全部菌体转移至50 mL BMMY培养基,OD600达0.8~1.0,30 ℃、250 r/min振荡培养,每24 h补加甲醇使其浓度保持0.5%,诱导48 h。
吸取诱导后的菌液至 50 mL离心管中,3 000×g离心5 min,弃上清,收集菌体,按10%(W/V) 加入裂解液 (50 mmol/L Tris,50 mmol/L咪唑,500 mmol/L NaCl,pH 7.4) 重悬细胞。取20 µL细胞悬浮液,加入5 µL 5×上样缓冲液,100 ℃水浴10 min,顺势离心后进行SDS-PAGE和Western blotting鉴定。
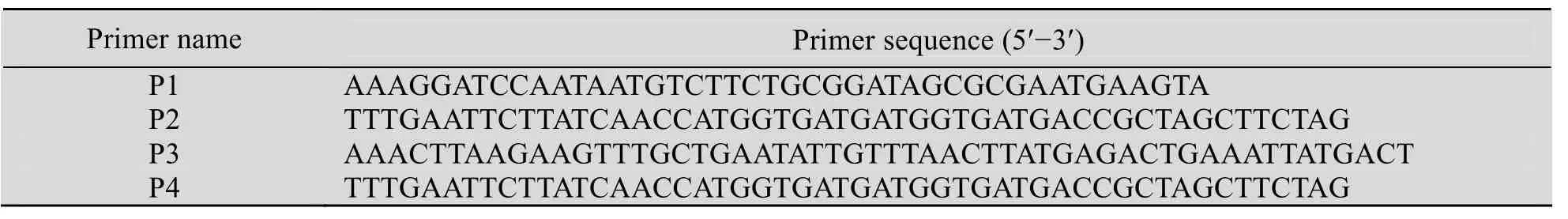
表1 PCR引物序列Table 1 primer sequence
1.4 酵母表达产物PIC3.5-P1的纯化
诱导后的菌液转移至 50 mL离心管中,3 000×g离心5 min收集菌体,按10% (W/V) 加入裂解液 (50 mmol/L Tris,50 mmol/L咪唑,500 mmol/L NaCl,pH 7.4) 重悬细胞。采用JnBio的高压破碎仪1 500~1 800 Pa破碎酵母,反复3次,8 000×g离心20 min分离上清和沉淀。可溶性蛋白和不可溶性蛋白分别采用非变性和变性纯化的方法纯化,方法均参照Qiagen标准手册。
1.5 大肠杆菌表达系统的构建、表达及纯化
借助于 PIC3.5-P1两端的酶切位点BamHⅠ和EcoRⅠ,酶切后经连接反应插入到 PKT载体,构建克隆 PKT-P1,经菌液 PCR、酶切和测序鉴定。
选取重组表达质粒转化至BL21(DE3),挑取单克隆37 ℃培养10 h, 按1∶100的比例接种于50 mL LB培养基 (卡那霉素 30 µg /mL),培养至OD600值达 0.6~1.0时加入终浓度为 0.8 mmol/L的IPTG,37 ℃诱导2.5 h,蛋白鉴定同1.3。裂解液重悬离心收集的菌体,超声波破碎细胞,8 000×g低温离心20 min分离上清和沉淀。纯化方法同1.4。
2 结果
2.1 GS115:PIC3.5-P1及对照 BL21(DE3):PKT-P1阳性克隆的鉴定
通过BamHⅠ和EcoRⅠ双酶切反应,将目标DNA片段分别插入载体pPic3.5和PKT,构建克隆PIC3.5-P1和PKT-P1。重组质粒由BamHⅠ和EcoRⅠ双酶切,琼脂糖凝胶图谱检测正确。另外,测序结果证实,该片段为MiSp重复区片段,且无核苷酸突变,可用于后续的表达研究。
载体 PIC3.5-P1通过转化进入酵母 GS115后,涂布于his−营养缺陷MD培养基,3~5 d后,可见生长良好的菌落,经过PCR鉴定证实P1基因通过同源重组转入酵母基因组中。
BL21(DE3): PKT-P1转化子经菌液PCR、测序鉴定,结果正确。
2.2 GS115:PIC3.5-P1表达优化及与参照BL21(DE3): PKT-P1的比较
目标基因长为1 348 bp,融合表达产物的理论分子量为38.54 kDa。诱导菌液SDS-PAGE检测结果如图 2所示,P1在 GS115出现和对照BL21(DE3) 大小一致的带,为34~50 kDa,阴性对照相应位置则无条带。以组氨酸标签 (6×his)作为检测抗原,以6×His-tag、Anti-Mouse、mAb为一抗,Alk-Phos. conjugated Anti-Mouse为二抗,参照Invitrogen产品实验技术,采用Western blotting进一步检测,该条带为目标蛋白。此外图中于50~90 kDa间,大约80 kDa处也出现了条带,而这初步推测是由于酵母的超糖基化、磷酸化所致,且本序列经相关生物学软件分析,如图1所示,存在多处糖基化、磷酸化位点,而这种超糖基化或磷酸化现象与优化条件是紧密相关的。
2.3 PIC3.5/PKT-P1表达产物的纯化
在变性 (含有8 mol/L 尿素) 与非变性的条件下通过Ni-NTA对GS115:PIC3.5-P1菌体破碎产物沉淀及上清进行纯化。如图3所示,在e1-3泳道中34~50 kDa处可以看到明显的目的条带,而沉淀中无明显的目的蛋白条带 (E1-E6),这表明目标产物,即MiSp部分重复区,能以可溶形式存在破碎液上清中。对于参照大肠杆菌,采用相同的办法对产物进行纯化处理发现,目标蛋白也是以可溶的形式存在。除了目的条带,26~34 kDa处还发现一条带,这是部分目标蛋白中 P1融合的 intein蛋白在纯化过程中断裂后剩余的部分P1,与理论大小26.61 kDa相符,研究表明intein融合蛋白表达时容易发生断裂现象[16]。本实验最初融合intein大约12.45 kDa,是为后续剪接实验准备,与蛛丝基因表达无关,这里不进一步讨论。
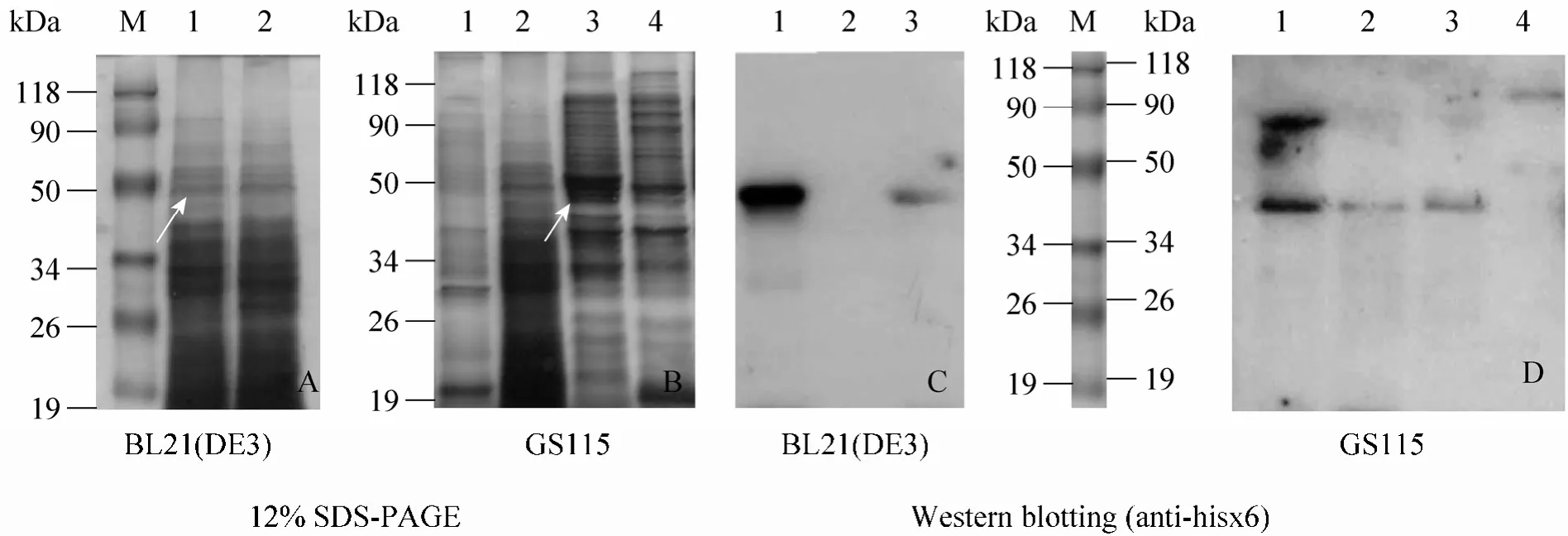
图2 P1在BL21(DE3)和GS115中表达产物的SDS-PAGE和Western blotting检测Fig. 2 SDS-PAGE and Western blotting analysis of the recombinant proteins derived from P1 in BL21 (DE3) and GS115 respectively. M: protein marker. (A) SDS-PAGE of BL21 (DE3) culture. 1: 37 °C induced 2.5 h; 2: negative control, strain without transform. (B) SDS-PAGE of GS115 after 48 h induction. 1: negative control; 2: negative control,strain with empty plasmid; 3: optimized expression sample; 4: not optimized expression sample. (C) Western blotting of BL21 (DE3). 1: 37 °C induced 2.5 h; 2: negative control, strain without transform; 3: 25 °C induced 12 h. (D) Western blotting of GS115 after 48 h induction. 1: optimized expression sample; 2–3: not optimized expression sample; 4:negative control, strain without transform.
纯化结果进一步与参照比较发现,纯化后GS115的产率 (目的蛋白占总蛋白的比例) 明显高于BL21(DE3),如表 3所示,可达到 13~14倍。
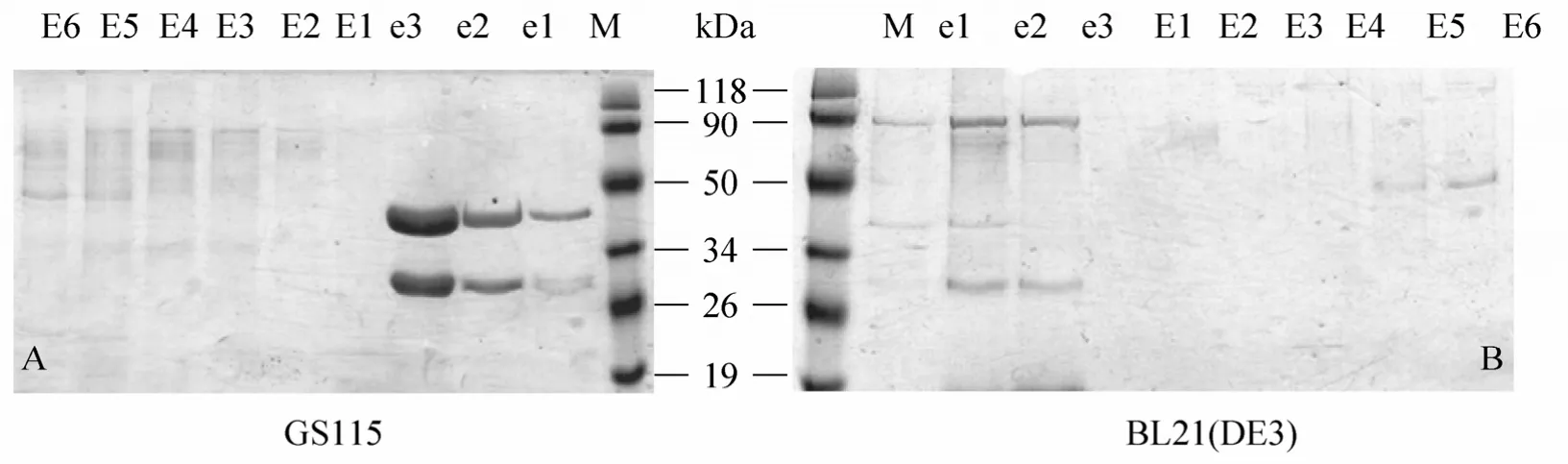
图3 P1在 BL21 (DE3) 和GS115表达产物在非变性与变性条件下纯化的检测Fig. 3 SDS-PAGE for purification of P1 expression products of BL21 (DE3) and GS115 in natured and denatured with 8 mol/L Urea condition. M: protein marker; e1−e3: native purification of supermatant; E1−E6: 8 mol/L Urea denature purification of precipitate. (A) SDS-PAGE for purification of P1 expression products of GS115. (B) SDS-PAGE for purification of P1 expression products of BL21 (DE3).
2.4 P1表达的优化及产量、产率及纯化效率的分析
对P. pastoris表达系统进行了初步优化,首先统计绘制了重组菌在 BMGY培养基中的生长曲线,如图4所示。
为同时保证诱导时适度的菌体密度和最佳生长状态,选取 18~20 h对数生长中后期的BMGY培养物转接于新鲜的BMGY培养基。在新鲜的 BMGY培养基中菌体重新分裂至OD600大约0.8左右,离心后按1∶1转接至新鲜BMMY培养基。如此通过再次分裂,保证新生的菌株在状态最佳时诱导;同时,诱导时菌体密度较低,保证了充足的营养物质。参照SDS-PAGE表达图谱,利用Image J软件比较分析各组蛋白的表达水平,结果如表2所示,优化后的表达量可提高6~7倍。
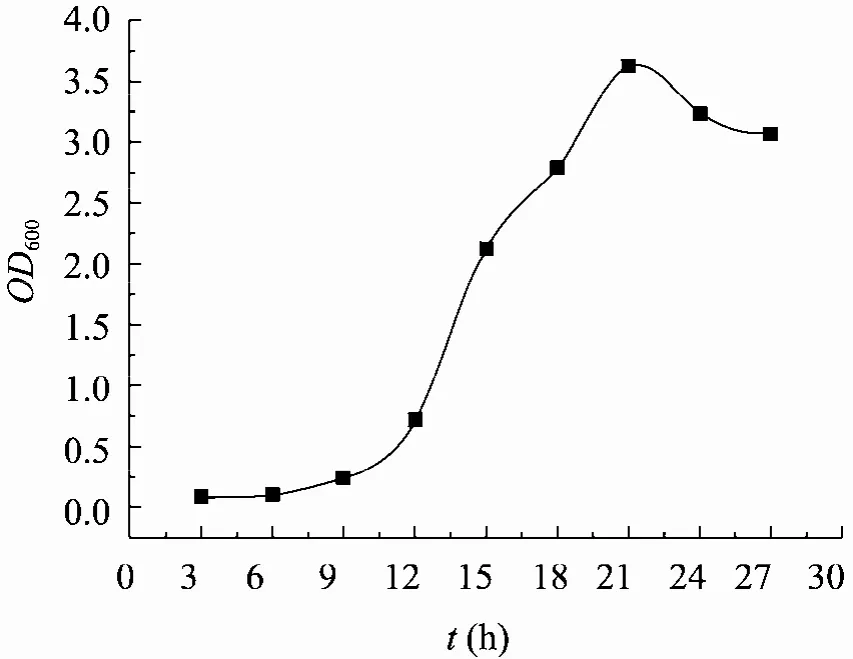
图4 重组菌株GS115: PIC3.5-P1在BMGY的生长曲线Fig. 4 growth curve of recombinant GS115: PIC3.5-P1 in BMGY.
如表 3所示,我们分析比较了纯化前后P. pastoris和E. coli中目的蛋白的产量和产率,并进一步计算了相应的纯化效率。P. pastoris和E. coli中重组蛋白的产量和产率存在较大差别,根据Image J分析比较的数据,纯化前P. pastoris表达系统经初步优化后,表达量可提高为原来的6~7倍,达到E. coli的 2~3倍,产率达E. coli的6倍,由此可以看出,两种表达系统对P1的表达水平存在较大的差别。另外经纯化,表达差距进一步扩大,说明P. pastoris和E. coli两种表达系统的纯化效率也存在较大差异,如表3和表4所示,P. pastoris为E. coli的6倍左右。

表2 纯化前目的蛋白P1的产量、产率 (目的蛋白在表达总蛋白中的含量) 在BL21(DE3)和GS115中常规组及优化组中的比较Table 2 Comparison of optimization and no optimization for protein yields and protein productivity in two expression system before purification
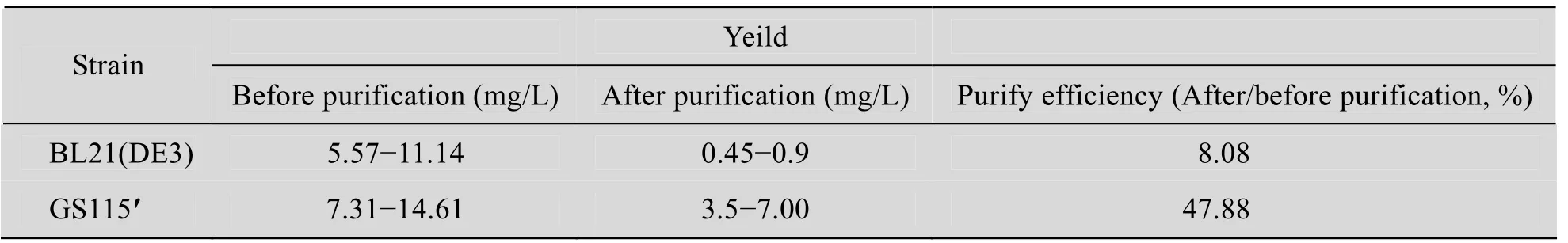
表3 目的蛋白P1在BL21(DE3)和GS115的产量在纯化前后的比较Table 3 Comparison of purify efficiency in the two expression system for protein yields

表4 目的蛋白P1在BL21(DE3)和GS115的产率在纯化前后的比较Table 4 Comparison of purify efficiency in the two expression system for protein productivity
3 讨论
自20世纪80年代以来,科学家就开展了蜘蛛丝的多项研究,包括基因克隆、蛋白表达以及仿生丝纤维的应用等,但蛛丝在表达上的困难严重阻碍它的发展。迄今为止,国内外只获得了3种丝纤维蛋白的全长基因组序列,分别为 MaSp(Major ampullate spidroin)、MiSp 和 AcSp(Aciniform spidroin),其中MaSp和AcSp均来自黑寡妇蜘蛛Latrodectus hesperus,而MiSp则来自A. ventricosus,由本课题组筛选鉴定[15,20-21]。这些完整的蛛丝蛋白,分子量大、编码基因 GC含量高,常见的表达系统很难完成其全长的表达。而研究表明,高分子量是决定蛛丝性能的重要因素,对此科学家分别尝试了不同的方法来获取高分子量的重组蛛丝蛋白[11,13]。2010年韩国科学家在代谢水平对大肠杆菌进行改造,补充Gly酰tRNA,最终表达出284 kDa的MaSp重组串联蛋白,但表达量较低,获得的重组蛛丝蛋白的纤维性能只有天然蛛丝的一半[13]。2012年德国科学家尝试了用蛋白质内含子 (Intein) 介导拼接的方法表达出高分子量的蛛丝蛋白,他们利用intein的体外剪接反应,在体外让融合 intein的蛛丝蛋白相互剪接产生Flag蛋白的串联体,产物可达到约300 kDa,但是该方法特异性较差,随机性较强,产物的大小无法控制,因此难于得到目标产物,不适合大规模的纯化生产[11]。
为了寻找适合表达天然蛛丝蛋白全长基因的系统,本研究在P. pastoris表达系统中首次尝试表达天然的MiSp部分重复序列 (P1),并与大肠杆菌表达结果进行比较。P1编码氨基酸序列富含Gly和Ala且高度重复,符合蛛丝蛋白序列的典型特征,在异源表达时,容易因为宿主密码子使用的偏爱性及稀有氨基酸合成代谢不足而受到影响;另外,片段本身的大小亦会一定程度上决定表达水平和产物的完整性,而有研究报道E. coli在表达高重复的大片段蛛丝蛋白时,容易出现表达提前终止现象,而片段达到1 000氨基酸长度,表达效率就会明显降低[2,13,22]。本研究结果表明在P. pastoris和E. coli系统中,P1均实现了表达,蛋白产物可溶性好 (图3),采用非变形纯化即可得到可溶性的蛋白。我们还分析比较了两种表达系统中 P1表达量和产率,在优化后P. pastoris表达系统中,P1表达量高,为E. coli表达系统的 2倍左右 (表 2)。这是由于天然的MiSp基因含有数十个精氨酸 (Arginine) 等,E. coli系统因为密码子的偏爱性无法高效地表达该氨基酸;另外,由于P1编码的氨基酸Gly和Ala含量非常高 (60%左右),E. coli表达系统的氨基酸合成亦会受到影响。P. pastoris为真核表达系统,可以更好地编码上述稀有密码子。参照GS115生长曲线 (图4),对P. pastoris表达系统进行初步优化,选择18~20 h对数生长中后期的BMGY培养物转接新鲜 BMGY,离心收集菌体去除了陈旧的培养基等,减轻了经过长期的代谢产生的有害物的影响以及pH变化的影响、提高菌体的代谢水平,菌体生长状态;二次培养达到较低菌种密度开始诱导,外环境营养丰富,更好地促进了外源基因的表达,优化前后表达量可提高6~7倍。P. pastoris系统是常用的真核表达系统,较E. coli而言,有更大的优化空间 (包括诱导时间、诱导甲醇浓度和扩大发酵培养等),且易于扩大,适合工业大规模生产,是表达蛛丝蛋白或其他多重复大片段分子的良好宿主[23]。由于蛛丝基因本身的特点,为了获取更高表达量的重组蛋白,我们将会进一步优化P. pastoris表达系统并尝试MiSp天然基因和其他蛛丝蛋白基因的全长表达。
本研究通过对P. pastoris和E.coli两种表达系统地比较以及对P. pastoris系统地优化,证明了P. pastoris作为天然蛛丝蛋白MiSp表达宿主的优越性。为天然蛛丝蛋白基因可溶性表达提供了线索,也为A. ventricosusMiSp全序列的表达提供了前期实验基础。
[1]Hinman MB, Jones JA, Lewis RV. Synthetic spider silk: a modular fiber. Trends Biotechnol, 2000, 18:374−379.
[2]Rising A, Widhe M, Johansson J, et al. Spider silk proteins: recent advances in recombinant production, structure-function relationships and biomedical applications. Cell Mol Life Sci, 2011,68: 169−184.
[3]Hofer M, Winter G, Myschik J. Recombinant spider silk particles for controlled delivery of protein drugs. Biomaterials, 2012, 33: 1554−1562.
[4]Lammel A, Schwab M, Hofer M, et al.Recombinant spider silk particles as drug delivery vehicles. Biomaterials, 2011, 32: 2233−2240.
[5]Lewicka M, Hermanson O, Rising AU.Recombinant spider silk matrices for neural stem cell cultures. Biomaterials, 2012, 33: 7712−7717.
[6]Hudspeth M, Nie X, Chen W, et al. Effect of loading rate on mechanical properties and fracture morphology of spider silk. Biomacromolecules,2012, 13: 2240−2246.
[7]Foelix RF. Biology of Spiders. 2 ed. New York:Oxford University Press, 1996.
[8]Guinea GV, Elices M, Plaza GR, et al. Minor ampullate silks from nephila and argiope spiders:tensile properties and microstructural characterization.Biomacromolecules, 2012, 13: 2087−2098.
[9]Work RW. Dimensions, birefringences, and force-elongation behavior of major and minor ampullate silk fibers from orb-web-spinning spiders—the effects of wetting on these properties.Textile Res J, 1977, 47: 650−662.
[10]Teule F, Addison B, Cooper AR, et al. Combining flagelliform and dragline spider silk motifs to produce tunable synthetic biopolymer fibers.Biopolymers, 2012, 97: 418−431.
[11]Hauptmann V, Weichert N, Menzel M, et al.Native-sized spider silk proteins synthesized in planta via intein-based multimerization. Transgenic Res, 2013, 22: 369−377.
[12]Wen H, Lan X, Zhang Y, et al. Transgenic silkworms (Bombyx mori) produce recombinant spider dragline silk in cocoons. Mol Biol Rep,2010, 37: 1815−1821.
[13]Xia XX, Qian ZG, Ki CS, et al. Native-sized recombinant spider silk protein produced in metabolically engineeredEscherichia coliresults in a strong fiber. Proc Natl Acad Sci USA, 2010, 107:14059−14063.
[14]Widhe M, Johansson J, Hedhammar M, et al.Current progress and limitations of spider silk for biomedical applications. Biopolymers, 2012, 97:468−478.
[15]Chen G, Liu X, Zhang Y, et al. Full-length minor ampullate spidroin gene sequence. PLoS ONE,2012, 7: e52293.
[16]Qi X, Meng Q, Liu XQ. Spontaneous C-cleavage of a mini-intein without its conserved N-terminal motif A. FEBS Lett, 2011, 585: 2513−2518.
[17]Altman GH, Diaz F, Jakuba C, et al. Silk-based biomaterials. Biomaterials, 2003, 24: 401−416.
[18]Kuhbier JW, Reimers K, Kasper C, et al. First investigation of spider silk as a braided microsurgical suture. J Biomed Mater Res B Appl Biomater, 2011, 97: 381−387.
[19]Krishnaji ST, Kaplan DL. Bioengineered chimeric spider silk-uranium binding proteins. Macromol Biosci, 2012, 13: 256−264.
[20]Ayoub NA, Garb JE, Kuelbs A, et al. Ancient properties of spider silks revealed by the complete gene sequence of the prey-wrapping silk protein(AcSp1). Mol Biol Evol, 2012, 30: 589−601.
[21]Ayoub NA, Garb JE, Tinghitella RM, et al.Blueprint for a high-performance biomaterial:full-length spider dragline silk genes. PLoS ONE,2007, 2: e514.
[22]Fahnestock SR, Irwin SL. Synthetic spider dragline silk proteins and their production inEscherichia coli. Appl Microbiol Biotechnol,1997, 47: 23−32.
[23]Sreekrishna K, Brankamp RG, Kropp KE, et al.Strategies for optimal synthesis and secretion of heterologous proteins in the methylotrophic yeastPichia pastoris. Gene, 1997, 190: 55−62.
