小黑杨环锌指蛋白基因功能分析
2013-09-03姜廷波张介驰
王 雷,姜廷波,张介驰
(1.黑龙江省科学院高技术研究院,哈尔滨 150090;2.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040;3.黑龙江省科学院 微生物研究所,哈尔滨 150010)
黑龙江省作为传统的林业大省,经过多年粗放式采伐经营,不仅造成了森林可采资源匮乏,而且致使林木优良种质资源和林地土壤肥力严重退化。黑龙江省西部“三肇”、大庆、齐齐哈尔等地土壤盐渍化和荒漠化程度不断加重,这种恶劣的生态环境严重影响了当地的农林业生产。目前,在黑龙江省西部林草植被恢复过程中,林木生产用品种不仅数量少,而且品质差、产量低、抗逆性差。因此培育出抗逆的林木新品种,是解决上述问题的关键。林木由于生长周期长、遗传负荷大,许多重要性状不仅分析困难,而且遗传机理不明,从而造成了传统的林木育种方法具有周期长、见效慢、费时费工和优良性状基因的来源具有较大的局限性等缺点,因此利用常规方法选育耐盐碱、优质、速生的林木品种难度大,所以至今尚未培养出真正耐盐的林木品种。现代分子生物学的快速发展以及在林木遗传育种研究中的广泛应用,为在较短时间内培育出高产、稳产和抗逆性强的林木新品种提供一条新的思路和方法。通过基因工程手段,可以得到大量的目的基因。按照中心法则遗传信息的传递规律,最终影响生物体表型的是蛋白质。如何获悉这些基因翻译成蛋白质后的具体作用,就需要对它们进行功能分析。从林木中克隆抗逆相关基因并研究这些基因的功能将为林木基因工程育种研究打下坚实基础。
小黑杨(Populus simonii×P.nigra)是小叶杨与欧洲黑杨的杂交种,1959年由中国林科院培育,现在在黄河流域及其以北的广大地区均有栽植,是黑龙江省重要的防护树种和用材树种。小黑杨生长快,轻度耐盐碱,材质细密,可用于造纸、民用建筑等。小黑杨的研究早期多集中于引种与栽培[1,2],近些年关注的热点多集中于利用转基因方法导入外源基因提高小黑杨抗病性[3]、抗虫性[4,5]和耐盐性[6]的研究,而对小黑杨盐应答基因的研究却很少。
环锌指蛋白(ring zinc finger protein,RZF)最早由Lovering等[7]发现,它具有典型的C3HC4保守序列,保守区由40~60个氨基酸组成,富含半胱氨酸和组氨酸,可结合两个锌原子。由于此蛋白的性质不稳定,容易聚合,对其功能的研究尚不深入,初步研究表明,此蛋白可与其他蛋白相互作用,参与信号转导或蛋白质泛素化降解[8,9]。迄今人们已在水稻[10]和巴西橡胶树[11]中克隆了 C3HC4型环锌指蛋白基因。Zeba等[12]报道,大多非生物胁迫因素均可诱导甜椒环锌指蛋白基因的表达,将甜椒中的C3HC4型环锌指蛋白基因导入烟草后,转基因植株的生长量明显高于非转基因植株。Schumann等[13]的研究表明,拟南芥中的一种C3HC4型环锌指蛋白[14]在光呼吸的过程中也起作用。
本研究利用RACE技术克隆小黑杨环锌指蛋白(Populus simonii× P.nigra ring zinc finger protein,PsnRZF)基因的全长cDNA,进一步研究该基因在根、茎、叶中的表达以及NaCl胁迫过程中的表达变化,将小黑杨环锌指蛋白基因构建于植物表达载体,转化烟草,通过对盐胁迫下转基因烟草表型及生理指标的检测,分析该基因的功能。本研究不仅为环锌指蛋白基因功能的深入研究提供依据和参考,也为小黑杨基因工程育种研究奠定基础。林木基因工程新品种对于提高我省西部干旱地区的林木覆盖率,改善当地严酷的生态环境,将产生不可估量的生态效益。林木基因工程新品种一旦进入产业化阶段,不仅具有广阔的市场推广前景,也必将产生巨大的经济、社会及环境效益。
1 材料与方法
将从温室中取材的同一无性系小黑杨(Populus simonii×P.nigra)枝条进行水培,于人工气候室中培养,昼/夜温度为26℃/22℃,光照16 h/d,光照强度175μmol/(m2·s),相对湿度约75%。生长40 d左右,长出新的根和叶片,将其分成两组,一组作为对照于正常条件下培养,另一组用200 mmol/L NaCl进行胁迫处理,分别在胁迫开始时(第0 天)和胁迫后的第1、2、4、6、8 天中取小黑杨的根、茎、叶,每组重复3次,用蒸馏水清洗,拭干后置于液氮中,于-70℃中保存备用。烟草品种为SR-1(Nicotiana tabacum L.cv.Petit Havana SR-1)。
用SDS法[14]分别提取小黑杨根、茎、叶中的RNA,用SYBR Premix ExTaq试剂盒(购于大连宝生物工程有限公司)进行实时定量 PCR(Real-time PCR)[15,16]。以胁迫后第2天的小黑杨叶片RNA为模板,根据PsnRZF基因的序列信息(GW672596)设计引物进行5’/3’克隆,方法见5’/3’RACE Kit,2nd Generation(Roche)。将 PsnRZF 基因连接到植物表达载体pROKⅡ35S启动子后,用农杆菌介导法对烟草进行遗传转化[17],对转化植株进行RT-PCR的检测,分别检测非转基因和转基因烟草在正常生长和NaCl胁迫状态下的 POD活性、SOD活性、MDA含量[18],使用SPAD-502叶绿素仪测定样本叶绿素相对含量的变化情况。所得数据利用SPSS11.0统计软件进行单因素方差分析 Duncan 检验[19]。
2 结果与讨论
2.1 小黑杨环锌指蛋白基因全长cDNA的克隆
采用5’/3’RACE(rapid amplification of cDNA ends)的方法扩增PsnRZF基因的5’/3’端,3’RACE得到一条630 bp的条带(图1),5’RACE得到一条404 bp的片段(图2),经电子拼接获得带有PolyA的全长cDNA序列为1 061 bp。采用NCBI中的ORF程序显示5’非翻译区为184 bp,3’非翻译区为82 bp,开放读码框为795 bp,编码264个氨基酸。用NCBI的保守功能区域(conserved domains)分析程序预测基因的保守区,结果表明该基因编码产物属于环锌指蛋白超家族,保守区位于第58~104氨基酸。

图1 PsnRZF 3’RACE扩增产物Fig.1 3’RACE product of PsnRZF cDNA M为DL2000分子量标准;1为3’RACE扩增产物
2.2 NaCl胁迫下小黑杨环锌指蛋白基因的表达分析
为研究小黑杨环锌指蛋白基因在盐胁迫下的应答,用Real-time PCR检测NaCl胁迫前后PsnRZF基因在根、茎、叶中表达的结果(图3)表明:在正常生长状态下,PsnRZF基因在根、茎、叶中均表达。在NaCl胁迫条件下,PsnRZF基因表达量在根、茎、叶中均升高,此基因在根中表达量变化并不显著。随着胁迫时间的延长,PsnRZF基因在茎和叶中的表达量逐渐升高。此基因在叶中表达量的变化最为明显,在胁迫后第2天和第4天显著高于对照(P<0.05),在胁迫后的第6天,此基因的相对表达量达到最高,极显著地高于对照(P<0.01)。胁迫后的第4、6、8天,PsnRZF基因在茎中的相对表达量显著高于对照(P<0.05)。
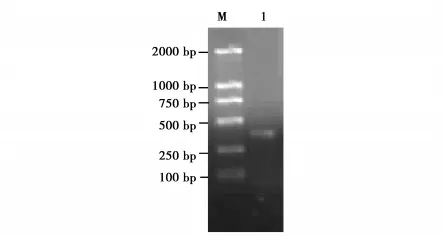
图2 PsnRZF 5’RACE扩增产物Fig.2 5’RACE product of PsnRZF cDNA M为DL2000分子量标准;1为5’RACE扩增产物
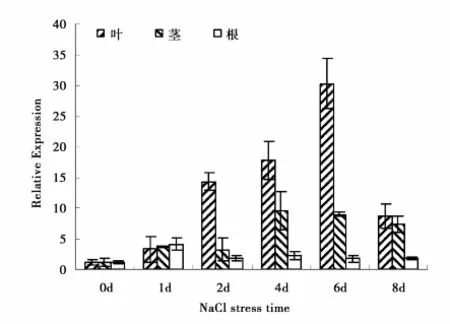
图3 NaCl胁迫下小黑杨PsnRZF基因在根茎叶中的表达Fig.3 The expression levels of PsnRZF gene in roots,stems and leaves under NaCl stress
小黑杨PsnRZF基因在不同器官中表达量变化存在差异,这可能是由于此基因编码的环锌指蛋白参与的很多生理反应主要是在叶中进行,如光呼吸,所以PsnRZF基因在叶中的表达量变化最为明显。随着NaCl胁迫时间的延长,PsnRZF基因的表达量也随之升高,说明盐胁迫影响了该基因的表达,PsnRZF可能在盐胁迫应答过程中发挥作用。植物在逆境胁迫时,体内会积累很多物质,如信号分子ABA,有研究表明环锌指蛋白可能参与ABA介导的信号转导过程。随着盐胁迫时间的延长,体内信号分子不断积累,PsnRZF基因表达量升高,作为信号受体的PsnRZF数目增多,PsnRZF作为信号受体与信号分子互作,从而调控盐应答基因的表达。但小黑杨环锌指蛋白(PsnRZF)与哪类信号分子互作,以及这种互作调控哪些基因的表达都有待进一步研究。
2.3 小黑杨环锌指蛋白基因功能验证
本研究利用正向遗传学的方法来研究小黑杨环锌指蛋白基因(PsnRZF)的功能。将PsnRZF基因连接到植物表达载体pROKⅡ35S启动子后,用农杆菌介导法导入烟草,使其在烟草中过量表达,检测过量表达的PsnRZF基因对植物产生的影响,从而确定其功能。对转基因烟草的分子检测已经证明,PsnRZF基因已经导入烟草中,并在转录水平表达(图4)。通过表型观察发现,转基因烟草与非转基因烟草并无差别。正常生长条件下,多数转基因烟草的叶绿素含量低于非转基因烟草(图5),转基因烟草MDA含量却高于非转基因烟草(图6)。这说明在正常生长条件下,PsnRZF基因的过量表达对植物体是有害的,这种伤害可能与氧化胁迫相关,导致膜脂的过氧化,因此转基因植株MDA含量高于非转基因植株。在盐胁迫下,非转基因植株SOD和POD活性迅速增强(图7、8),有效清除活性氧。但非转基因烟草MDA含量仍高于正常条件下的水平,说明盐胁迫对非转基因烟草膜脂造成了伤害;而盐胁迫下转基因烟草MDA含量却低于正常条件下的水平,这说明环锌指蛋白对盐胁迫下的膜脂氧化有一定的抑制作用或参与膜脂过氧化后的修复。盐胁迫后,小黑杨环锌指蛋白发挥了与正常生长条件下不同的功能。环锌指蛋白具有E3泛素连接酶的活性,在正常生长与盐胁迫下,环锌指蛋白可能对不同的蛋白质进行泛素化修饰,从而执行不同功能[20]。

图4 转PsnRZF基因烟草的RT-PCR检测Fig.4 RT-PCR detection of PsnRZF gene in transgenic tobacco
3 结论
克隆获得小黑杨环锌指蛋白基因cDNA序列,全长1 061bp,属于环锌指蛋白超家族基因。PsnRZF基因在不同器官中表达量变化存在差异,在叶中的表达量最高,其次为茎,在根中的表达量最低;在胁迫条件下,茎和叶中表达量呈现先逐渐升高后降低的变化趋势,而在根中,该基因表达量的变化不显著。在正常生长条件下,PsnRZF基因的过量表达可导致植物膜脂氧化程度增强;但在盐胁迫条件下,PsnRZF基因的过量表达可以缓解膜脂的过氧化作用。
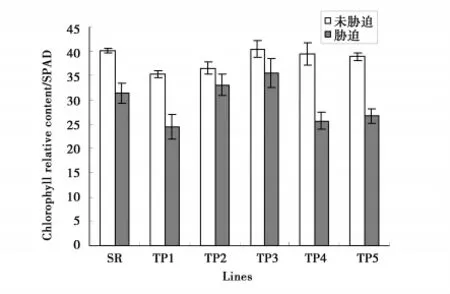
图5 NaCl胁迫对烟草叶绿素相对含量的影响Fig.5 Chlorophyll relative content of transgenic NaCl stress
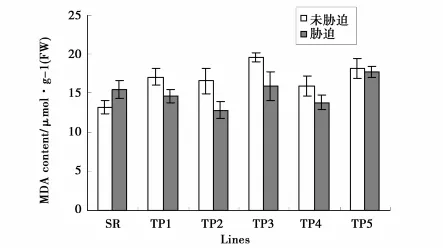
图6 NaCl胁迫对烟草MDA含量的影响Fig.6 MDA content of transgenic tobacco under tobacco under NaCl stress
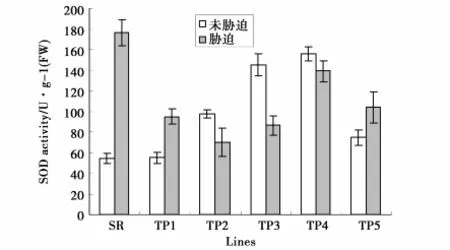
图7 NaCl胁迫对烟草SOD活性的影响Fig.7 SOD activity of transgenic tobacco NaCl stress
4 展望
本研究分析了PsnRZF基因的过量表达对植物的影响,在未来的工作中可以利用RNA干扰的方法使小黑杨环锌指蛋白基因沉默,观察小黑杨的变化,从而进一步研究小黑杨环锌指蛋白基因的功能,并且可以采用酵母双杂交的方法确定不同生长条件下环锌指蛋白与何种蛋白发生互作。本研究中,植物表达载体上的启动子为35S启动子,该通用型启动子有一定的局限性,在未来的育种研究中,建议将35S启动子替换成诱导型启动子,这样可以更好地调控PsnRZF基因表达,提高小黑杨的抗逆性。
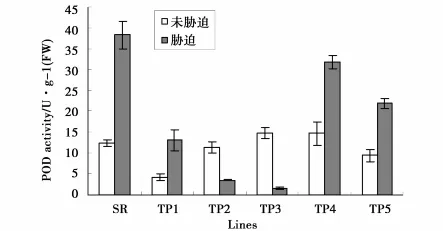
图8 NaCl胁迫对烟草POD活性的影响Fig.8 POD activity of transgenic tobacco under under NaCl stress
[1]常玉广.小黑杨花粉植株转抗虫基因的研究[D].哈尔滨:东北林业大学,2004.
[2]范海娟,胡春祥,王志英,刘桂丰.转蜘蛛杀虫肽与Bt毒蛋白C肽基因小黑杨对杨扇舟蛾的抗性[J].昆虫学报,2006,49(5):780-785.
[3]郝建军,刘延吉.植物生理学实验技术[M].沈阳:辽宁农业科学技术出版社,2001:71-73,144-145,180-181.
[4]黄留玉.PCR最新技术原理、方法及应用[M].北京:化学工业出版社,2005:131-157.
[5]李凤娟.植物铁蛋白基因表达载体的构建及对烟草和杨树的遗传转化[D].哈尔滨:东北林业大学,2007.
[6]林杰斌,陈湘,刘明.SPSS11.0统计分析实务设计宝典[M].北京:中国铁道出版社,2002:245-248.
[7]刘桂丰,杨传平,蔡智军,程桂兰,詹丽平.转betA基因小黑杨的耐盐性分析及优良转基因株系的选择[J].林业科学,2006,42(7):33-36
[8]刘志明.农田防护林主要树种小黑杨生长规律的研究[J].林业科技,1988,(5):14-16.
[9]朴志勇,赵存玉,王晓娟,唐翠,朴志焕,梁淑娟.小黑杨引种及山地速生丰产栽培技术[J].东北林业大学学报,2004,32(4):9-11.
[10]王玉成.柽柳抗逆分子机理研究与相关基因的克隆[D].哈尔滨:东北林业大学,2005.
[11]张福丽.小黑杨抗真菌病转基因的研究[D].哈尔滨:东北林业大学,2006.
[12]ARAVIND L,LYER LM,KOONIN EV.Scores of RINGs but No PHDs in ubiquitin signaling[J].Cell Cycle,2003,2(2):123-126.
[13]BORDEN KLB.RING domains:master builders of molecular scaffolds[J].Mol Biol,2000,(295):1103-1112.
[14]EISENHABER B,CHUMAKN,EISENHABER F,et al.The ring between ring fingers(RBR)protein family[J].Genome Biology,2007,8(3):20901-20910.
[15]LOVERING R,HANSON IM,BORDEN KL,et al.Identification and preliminary characterization of a protein motif related to the zinc finger[J].Proc Natl Acad Sci USA,1993,(90):2112-2116.
[16]MA K,XIAO JH,LI XH,et al.Sequence and expression analysis of the C3HC4-type RING finger gene family in rice[J].Gene,2009,(444):33-45.
[17]SCHUMANN U,PRESTELE J,O’GEEN H,et al.Requirement of the C3HC4zinc RING finger of the Arabidopsis PEX10 for photorespiration and leaf peroxisome contact with chloroplasts[J].Proc Natl Acad Sci USA,2007,104(3):1069-1074.
[18]WANG YM,ZHU W,LEVY DE.Nuclear and cytoplasmic mRNA quantification by SYBR green based real-time RT-PCR[J].Methods,2006,(39):356-362.
[19]ZEBA N,ISBAT M,KWON NJ,et al.Heat-inducible C3HC4type RING zinc finger protein gene from Capsicum annuum enhances growth of transgenic tobacco[J].Planta,2009,(229):861-871.
[20]ZHUJH,LIU-HL,TUFZ,et al.Cloning and molecular characterazation of a RING zinc finger gene of Hevea brasiliensis[J].J Plant Physiol Mol Biol,2006,32(6):627-633.