纤维素乙醇高温发酵的研究进展与展望
2013-09-03乐易林邵蔚蓝
乐易林,邵蔚蓝
江苏大学环境学院 生物质能源研究所,江苏 镇江 212013
纤维素乙醇高温发酵的研究进展与展望
乐易林,邵蔚蓝
江苏大学环境学院 生物质能源研究所,江苏 镇江 212013
乐易林,邵蔚蓝. 纤维素乙醇高温发酵的研究进展与展望. 生物工程学报, 2013, 29(3): 274−284.
Le YL, Shao WL. Advances in and challenges for thermophilic fermentation of cellulosic ethanol. Chin J Biotech, 2013,29(3): 274−284.
利用高温细菌发酵,纤维素乙醇生产有望实现“生物质降解-乙醇发酵-乙醇蒸馏”过程的同步化,从而最大限度地降低纤维素乙醇的生产成本;这是一个目标更高、道路更远、科学性更强的可再生能源发展策略。纤维素乙醇高温发酵研究已经取得了重要进展,目前面临的主要挑战包括发酵乙醇的高温细菌的遗传转化系统不够稳定、缺少内源的高活性和耐热性纤维素酶,以及乙醇代谢调控机理有待进一步解析。这些科技难题将会在DNA生物合成和进化技术、细胞生物学技术,以及合成生物学技术的发展中得到解决。
纤维素乙醇,高温发酵细菌,代谢调控,遗传转化系统,合成生物学
石油、煤炭等石化能源的生成需要经历上万年的时间;近代工业的飞速发展使石化能源被迅速消耗、日渐枯竭,成为相对意义上的不可再生资源。20世纪70年代以来,世界经历了数次能源危机和经济危机,人们已经认识到开发可再生的替代能源已经成为人类社会可持续发展的战略任务。地球上绿色植物的光合作用,每年产生大约1 500~2 000亿t的碳水化合物,其中绝大部分是构成植物支撑组织的木质纤维;仅我国农业,每年产生的秸秆就多达7亿t。据估算,如果5%的木质纤维中所含的生物质能得到开发利用,人类对能源的需求就能够得到满足[1-2]。因此,木质纤维原料的开发利用在现代生物技术领域已经形成了研究热点。
木质纤维原料水解产生的戊糖和己糖可以用作发酵原料生产各种发酵产品,如乙醇、乙酸、丙酮-丁醇、柠檬酸、氨基酸等。以木质纤维为原料生产燃料乙醇是最早提出的可再生能源发展策略,也是投入最大、研究最多的科学技术。近年来,世界各国都在加强纤维素乙醇的研发,例如,美国国家资源保护委员会提出,在不减少食品和饲料生产的前提下,到 2050年全部运输燃料的50%将是燃料乙醇[1]。
1 纤维素乙醇的转化途径和策略
1.1 一般工艺流程及面临的问题
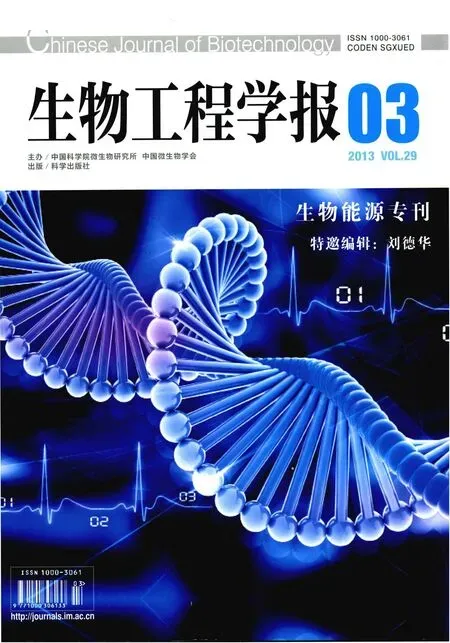
从木质纤维到燃料乙醇的转化通常要经过一个复杂的工艺流程,例如,最早提出并且研究得最多的稀酸水解工艺至少包含生物质降解、乙醇发酵、乙醇蒸馏这3个过程 (图1)。人们用目前通用的工艺生产纤维素乙醇[1],所面临的主要挑战是生产成本居高不下,其中构成生产成本的关键因素包括:
1) 秸秆等原料分散于农田且比容很低,其收集与运输的成本相对很高。
2) 木质纤维经过预处理,破坏了天然结构以后才能被酶进一步水解。预处理过程中需要消耗大量的化学品或热能,并且增加了设备投资或污水处理成本。
3) 纤维素酶的生产成本高,应用效率低。
4) 常用的乙醇发酵菌株缺少利用和转化戊糖的能力或转化效率很低。
5) 以木质纤维水解液为原料,发酵液中的乙醇含量一般低于 5% (W/V),这种低浓度乙醇的精馏能耗很高。
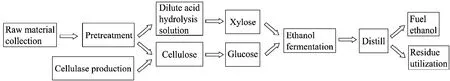
图1 用酸处理木质纤维生产纤维素乙醇的工艺流程Fig. 1 Procedures for the production of cellulosic ethanol via acid pre-treatment of lignocellulose.
国内外科学家经过种种努力,对通用工艺中的各个环节进行了卓有成效的优化和改进,取得了可喜的进展。2012年8月11日的中国化工报上有报道称:纤维素乙醇的生产成本已经接近粮食乙醇[3]。然而,与一般工艺流程相比较,利用高温菌进行纤维素乙醇的发酵会形成一个不同的工艺;通过高温发酵工艺有望实现“生物降解-发酵-蒸馏”同步化,从而最大限度地降低纤维素乙醇的生产成本。
1.2 高温菌发酵可带来的有利因素
嗜高温微生物 (简称高温菌) 是指最适生长温度高于45 ℃的各种古菌、细菌、霉菌、酵母等微生物[4]。高温菌的遗传、代谢机理和常温菌一样,能够通过发酵代谢生产多种目标产品;所不同的是它们适应高温环境,所产生的蛋白质具有高度的活性和稳定性。随着科学研究技术的不断发展,越来越多的高温菌得到分离培养,为人们选择利用其细胞功能和酶功能提供了丰富的资源。美国Wiegel和Ljungdahl教授于1986年发表了一篇题为“嗜高温细菌在生物技术中的重要性”的经典性论文,并在这篇论文中总结了高温菌用于生物工程可能带来的有益效果[4]。这些潜在的有益效果包括:
1) 高温下代谢活性较高,可加速产物的转化。
2) 高温条件可杀灭杂菌或抑制杂菌的生长,减少发酵污染。
3) 减少灭菌后对降温的需求;无需通过降温 (<20 ) ℃终止生物反应。
4) 高温提高化合物的分散度、离子化和溶解度。
5) 高温菌能耐受或利用生物降解代谢和搅拌产生的热量。
6) 发酵液的密度、表面张力和粘度有所降低。
7) 挥发性的目标产物能够在发酵过程中得到收集和提取。
8) 高温菌产生热稳定性酶和蛋白质。
9) 高温菌产生较少细胞残体,提高产物与底物之比例。
1.3 高温菌用于纤维素乙醇生产的潜力分析
正如Taylor等指出,许多高温菌具有很强的降解纤维素、半纤维素的能力并且能够非常有效地发酵戊糖[5]。即使是常温菌所产生的酶,其最适反应温度也通常在45 ℃以上,因此,高温发酵为充分发挥酶的催化活性提供了有利条件。纤维素乙醇是典型的挥发性目标产物,在50 ℃以上的发酵时略加减压,乙醇就能够被蒸发回收[4-5]。综合而言,高温菌发酵生产纤维素乙醇的优势发挥到极致时,人们能够将常规的三大步骤合为一步,即:同步进行原料的生物降解、乙醇发酵和产物分离。不难看出,如果利用高温菌实现生物降解、发酵、蒸馏的同步化,纤维素乙醇的生产能够通过以下方法削减投入或降低消耗。
1) 高温菌自身产酶,不需要产酶设施,不需要纤维素酶发酵原料和能耗。
2) 乙醇能在发酵过程中被蒸馏,可减少对蒸馏装置的需求和降低蒸馏能耗。
3) 工序简化后减轻装备,能够多处设置作坊,降低原料运输成本。
4) 高温菌转化戊糖的能力与转化葡萄糖的能力相当,不需要代谢工程改造。
5) 原料预处理中,低温氨爆处理法的耗能和投资需求较低,较少产生抑制物质[1],但是处理后半纤维素较完整,需要用酶水解。高温菌能够产生所需要的半纤维素酶。
自20世纪80年代初,美国科学家就提出用高温菌发酵乙醇的策略,并且开始尝试将高温细菌运用于燃料乙醇的工业发酵过程[6-7]。此后,很多欧美科学家围绕乙醇高温发酵相关的课题展开全方位的研究。最近几年,由于解糖嗜热厌氧芽胞杆菌Thermoanaerobacterium saccharolyticum、马瑞氏嗜热厌氧杆菌Thermoanaerobacter mathranii、嗜热葡糖苷酶芽胞杆菌Geobacillus thermoglucosidasius等高温菌株的代谢途径工程取得了研究进展,在美国诞生了数家以纤维素乙醇高温发酵为主体技术的生物公司[5]。
2 纤维素乙醇高温发酵的研究进展
2.1 乙醇高温发酵菌株
有些高温菌能够利用半纤维素和淀粉生长、高效转化木糖,并且以乙醇为主要发酵产物,它们被推荐为乙醇发酵工程菌 (表 1);为了实现纤维素的水解和转化,产生高活性纤维素酶的菌株粪堆梭状芽胞杆菌Clostridiumstercocarium或热纤梭状芽胞杆菌C. thermocellum被组合到乙醇发酵过程中,进行纤维素乙醇的共发酵[3]。随着代谢工程技术的发展,美国科学家对能够利用半纤维素快速生长但是产生混合酸的菌株如T. saccharolyticum、T. mathranii、G. thermoglucosidasius等进行了乳酸、乙酸途径的阻断,获得了以乙醇为主要发酵产物的基因工程菌[4,8]。
高温菌中有很多菌株能够降解利用木聚糖类半纤维素;绝大多数菌株具有混合酸发酵途径,其中的乙醇发酵途径较弱。人们根据所要达到的目标来选择起始研究菌株。如果最终目标是构建一个能够同步完成“生物降解-发酵-蒸馏”过程的菌株,首先需要考虑如何充分利用菌株固有的优势,如降解纤维素和半纤维素的能力、产物以乙醇为主、高于乙醇沸点的生长温度等等。同样重要的是要善于发现和运用最前沿的科学技术和前人的工作基础,例如,Wiegel研究组分离和鉴定了T. saccharolyticumJW/SL-YS485;Shao等研究了该菌株的半纤维素酶系统,发现多种新型高效酶[10-13];Mai等构建了该菌株的遗传转化系统[14];最后,Lynd研究组将该菌株成功地构建成基因工程菌株,其利用混合糖发酵的乙醇产量高于经过代谢工程的酿酒酵母Saccharomyces cerevisiae和运动发酵单胞菌Zymomonas mobilis菌株[8]。进入21世纪以来,对于纤维素乙醇高温发酵菌株的研究再次掀起热潮,并且在分子水平上形成了几个重要的研究焦点:嗜热厌氧乙醇杆菌Thermoanaerobacter ethanolicus的基因组学和乙醇代谢调控机理研究,C. thermocellum和T. saccharolyticum的纤维素酶和半纤维素酶研究,以及T. mathranii、T. saccharolyticum和G. thermoglucosidasius的代谢工程研究。

表1 有效转化木糖发酵乙醇的重要高温菌Table 1 Important thermophiles able to convert xylose to ethanol
2.2 半纤维素水解能力
半纤维素是木质纤维中可利用的主要碳水化合物之一,可以被酸水解;经过其他方法预处理的木质纤维中,半纤维素成分需要在一系列的半纤维素水解酶的作用下才能产生可利用的单糖。仅木聚糖类半纤维素水解酶就需要内切木聚糖酶、木糖苷酶、阿拉伯糖苷酶、a-葡萄糖醛酸酶等多种酶的共同作用,才能得到充分水解和利用,因此,发酵工程菌自身具备利用木聚糖的能力是降低产品成本的一个重要环节。
T. ethanolicusJW200是最早发现的以乙醇为主要发酵产物的极端嗜热细菌[9,15]。T. ethanolicusJW200能够以木聚糖为唯一碳源生长,但是生长速度较慢;Shao等研究了其中的木聚糖水解酶的活性,发现该菌株虽然能够产生一种木糖苷酶/阿拉伯糖苷酶活性很高的双功能酶[16],但是它产生的木聚糖内切酶的活性较低。为了加强T. ethanolicusJW200利用木聚糖的能力,Wiegel研究组开始分离新菌株,寻找新型热稳定性木聚糖酶酶系统以及相应的外源基因。随后,该研究组获得了菌株T. saccharolyticumJW/SL-YS485及其独特的木聚糖水解酶系。
T. saccharolyticumJW/SL-YS485的最高及最适生长温度比T. ethanolicus低大约9 ℃;发酵产生乳酸、乙酸和少量乙醇;但是它比T. ethanolicus易于培养,其木聚糖水解酶活性高、系统完整、热稳定性较好。该菌株产生一种结合在细胞表面的木聚糖酶,能够有效地防止酶的流失;还产生2种乙酰酯酶和1种a-葡萄糖醛酸酶,有效分解源自双子叶植物的木聚糖的侧枝[10-12]。更有趣的是该菌株同时产生3种性质不同的木糖苷酶,其中 1种木糖苷酶能够耐受高浓度木糖的反馈抑制,它的酶学性状不同于所有已知的糖苷水解酶家族的特征,因此建立了 1个独立的新家族—— GH120[13]。这些性状表明,T. saccharolyticumJW/SL-YS485不仅能够为基因工程菌株的构建提供优选的外源基因,它自身也是构建代谢工程菌的优选菌株。
2.3 乙醇高温发酵条件与乙醇产量问题
20世纪80年代初,美国科学家对能够利用半纤维素产生乙醇的高温菌天然菌株及其突变体进行了大量的乙醇发酵试验;他们积累了丰富的经验也观察到一些当年不能解释的现象。早年所用的发酵菌株主要包括嗜热产硫化氢梭状芽胞杆菌Clostridium thermohydrosulfuricum39E(现用名:T. ethanolicus39E[17]),T. ethanolicusJW200及其衍生菌株、布洛克嗜热厌氧非芽胞菌Thermoanaerobium brockii等;用C. thermocellum与上述菌株进行共发酵时,可以直接利用纤维素为碳源产生乙醇[3]。试验结果表明,T. ethanolicus转化木糖产生乙醇的产物/底物比值达到1.5 (mol/mol);混合底物发酵的优选配方为20%淀粉、10%葡萄糖、6%木糖或木聚糖,发酵乙醇的产量接近4%。
高温菌利用戊糖和己糖的混合底物发酵时,乙醇产量与基因改造后的S. cerevisiae或Z. mobilis相似,但是用高浓度葡萄糖发酵时乙醇最终发酵浓度远远低于S. cerevisiae[3-4]。Ben-Bassat等1981年研究发现,T. brockii的生长受到乙醇的抑制,因此形成的观念是:高温菌对乙醇的耐受力低,从而导致乙醇产量低[4,18]。Burdete等通过对T. ethanolicus39E进行化学诱变获得一个能够在8%乙醇的培养基中生长的突变株,最近也有一些关于分离耐受高浓度乙醇的新型高温菌的报道和溶剂耐受机理的研究[4,19-20]。有趣的是T. ethanolicus39E的突变株对生长环境中的乙醇的耐受性虽然有了大幅度提高,其发酵产生内源乙醇的能力却没有增加;其他新分离的乙醇耐受性菌株在乙醇发酵能力方面也未见新的突破。
迄今为止,高温菌和常温菌之间在代谢途径、代谢生理方面没有发生本质上的差异。然而,特别的例子是Z. mobilis和S. cerevisiae的发酵乙醇的方式:它们通过丙酮酸脱羧酶产生乙醛,再由醇脱氢酶将乙醛转化为乙醇;而在其他常温或高温细菌中,丙酮酸脱羧酶尚未见报道。一般常温菌和高温菌的发酵途径大多为混合酸发酵途径,虽然有些高温细菌如T. ethanolicus等的主要发酵产物是乙醇,它们仍然会产生少量乳酸、乙酸等;即使这些有机酸消耗底物不多,但可能足以改变生存环境或诱导细胞休眠和凋亡。高温菌代谢途径工程在近几年取得了较大的突破:T. mathranii、T. saccharolyticum、G. thermoglucosidasius分别经过基因敲除阻断了乳酸、乙酸发酵途径,其纤维素乙醇发酵水平已经赶上或超过了目前最好的S. cerevisiae代谢工程菌株[4,8]。这些实例充分证明高温菌和Z. mobilis以外的常温细菌一样,乙醇发酵产量达不到工业化要求的重要原因之一是它们具有混合酸发酵途径。
2.4 代谢途径与调控机制研究
2.4.1 同功酶的发现与生理功能的解析
除Z. mobilis以外,细菌厌氧发酵中的乙醇发酵途径通常是由醛脱氢酶和醇脱氢酶催化的从乙酰辅酶 A (Ac-CoA) 经乙醛产生乙醇的代谢支路 (图2A)。20世纪 80年代末,人们开始研究T. ethanolicus体系中的醛脱氢酶和醇脱氢酶,至2000年,先后纯化了2种醇脱氢酶 (酶A和酶B),并克隆了相应的基因adhA和adhB[21-23]。由于在常规条件下醛脱氢酶活性很脆弱,而酶B又显示兼有醛脱氢酶活性,美国科学家Zeikus等认为酶 B是催化产生乙醇的关键酶 (图 2B)[22]。Peng等 2008年报道了醛脱氢酶 (酶 E) 及其基因adhE,并发现它仅出现于以乙醇为主要产物的菌株中;Pei等发现adhE具有醛/醇脱氢酶双功能,从而揭示乙醇转化途径中包含2个醛/醇双功能脱氢酶和1个醇脱氢酶,大多数催化反应都可能有2~3种同功酶的参与 (图2C)[24-25]。
图2 嗜热厌氧杆菌的乙醇发酵途径及关键酶[25]Fig. 2 Schemes for the ethanol pathway in Thermoanaerobacter spp. (A) Reactions in the final steps of the ethanol pathway in anaerobes. (B) The scheme proposed before adhE was identified. (C) The new scheme based on observed enzyme activities [25].
要在一个多酶体系中进行代谢工程,首先必须了解各个酶的生理功能和重要性。在生理条件下分析酶的生理功能时发现,纯化的酶B和酶E虽然在酶学条件下都具有醛/醇脱氢酶双重活性,但是在模拟的生理条件下,酶B只有微弱的醛脱氢酶活性,其主要功能是催化乙醛与乙醇之间的可逆反应;酶E具有很高的醛脱氢酶活性而没有醇脱氢酶活性[25]。细胞提取液中脱氢酶活性的分析表明,酶E是保证乙醛快速生成或消耗的关键酶,在细胞中的比活性比来自酶A和B的醇脱氢酶总活性高10倍左右;酶B的功能与美国学者的推断不同,它在乙醇浓度较高时主要催化消耗乙醇的逆反应。但是,酶B在发酵早期具有微弱的醛脱氢酶活性,可启动乙醇的少量生成[25],这可能是将代谢流导向乙醇发酵途径、减少乙酸或乳酸发酵的必要条件。
2.4.2 脱氢酶的转录调控现象及调控因子的研究
通过实时定量PCR测定3种脱氢酶基因的转录情况,结果表明adhB的转录不需要乙醇的诱导,而adhA和adhE需要少量乙醇的诱导才能进行表达;但是,adhB和adhE的转录水平随着乙醇浓度的进一步提高而逐步下降。葡萄糖对基因转录水平没有直接影响,但是稍后所产生的内源乙醇引起同样的效应 (图3)[25]。
通过以adhB和adhE上游的转录及调控区域的DNA制备特异性的亲和层析载体发现,细胞提取液中有3种蛋白质与DNA发生特异性的结合[26]。Pei等从中发现 1种还原力感应蛋白(RSPTet),与已研究报道的同类蛋白的同源性不到41%;它在凝胶阻滞试验中能够分别与adhB和adhE上游的转录调控区域的DNA结合;浓度低至1 μmol/L的NADH就能够解除RSPTet与DNA的结合。体外转录试验证明,adhB和adhE的转录能够被RSPTet完全阻遏,但是 NADH的出现导致解阻遏,NAD+又能够干扰 NADH的解阻遏作用[26]。此前报道过的还原力感应蛋白都源自好氧微生物,它们的调控节点是将还原力导入电子传递链的 NADH脱氢酶;而 RSPTet不参与NADH脱氢酶的转录调控,它是糖酵解途径与发酵途径之间的调控枢纽。微生物在厌氧发酵中只能从糖酵解途径获得生存所需的ATP,这个过程中产生的大量还原力需要通过发酵途径倾泻,RSPTet能够控制发酵途径的强弱以保持还原力的平衡。

图 3 通过实时定量 PCR测定乙醇对静息细胞中adhA,adhB和adhE基因转录水平的影响[25]Fig. 3 Relative abundance of mRNA transcribed from adhA, adhB, and adhE. The cells were incubated under anaerobic conditions at 69 ℃ for 0.5 h in the presence of 0%, 0.25%, 0.75%, and 1% ethanol [25].
2.4.3 调控基因和调控机理的解析
Pei等在adhA、adhB、adhE上游的基因转录-翻译元件区域共发现 4个 RSPTet结合位点,典型操纵基因具有完全互补的回文序列-ATTGTTANNNNNNTAACAAT-,它的 20个碱基正好涵盖DNA双螺旋的两周,形成立体结构上完全对称的反向重复[26]。试验证明,序列不完全互补的操纵基因的出现是因为回文两端的重复序列中的有些碱基可以被特定的碱基所取代,然而这些碱基的取代产生的异型操纵基因与RSPTet的亲和力明显低于典型操纵基因。操纵基因的分析表明,操纵基因在各个基因的表达调控区的分布是实现系统性调控的基础,而不同操纵基因之间序列的差异是实现精密调控的必要条件。adhB的上游有1个异型操纵基因,与RSPTet的亲和力较低,低浓度的NADH就能够解阻遏;而adhA和adhE的上游都有1个典型操纵基因,adhE的上游还存在着另一个异型操纵基因,NADH积累较多时它们才被诱导表达。
3 面临的挑战
3.1 乙醇发酵途径需要优化改造
关键酶的催化功能和基因转录调控研究表明:嗜热厌氧菌属的乙醇产生菌株中存在一种对乙醇代谢途径进行系统性精确调控的机制,而乙醇代谢途径中的关键酶能够实时调整乙醇的生成与消耗反应。在分批发酵中,乙醇的生成和消耗可能经历这样一个动态变化过程:1) 酶 B在发酵初期表达,此酶在pH≥7.2时活性高,及时催化Ac-CoA将代谢引入乙醇发酵途径;2) 随着乙醇的增加和NADH积累,脱氢酶A和E得到诱导表达;3) 酶E快速催化Ac-CoA到乙醛的转化,酶A和B共同催化从乙醛到乙醇的之间的可逆反应,此时以乙醇的生成为主要反应;4) 随着乙醇浓度的提高,酶B和E基因的转录减缓,乙醇消耗反应加强,使乙醇的最终浓度停留在特定的水平上。
解析代谢途径及其调控机理的目的不仅仅是为了认识相关的自然规律或基础科学问题,更重要的目的是了解如何打破代谢途径的自然调控,如何设计和改造自然系统,建立更为有效的新体系。例如,Peng等用带有adhE的质粒转化T. ethanolicus,证明增加adhE拷贝数能够提高乙醇产量[24,27]。但是截至目前,代谢调控网络中还有一些问题没有得到明确的解释,例如:在耐乙醇的突变菌株中,酶 A的活性明显下降[19],而酶 A的生物活性极不稳定,其生理功能难以解析;从图3中可以看出,静息细胞中酶B和酶E的基因转录明显受到乙醇的抑制,这种反馈抑制的机理还不明了。进一步阐明这些问题是正确设计代谢工程或合成生物学技术方案的必要条件。
3.2 热稳定性的高活性纤维素酶和半纤维素酶
木质纤维的降解利用过程中,结晶态纤维素的水解是主要瓶颈。纤维素酶的研究在国内外已经有大量的成果积累,研究得最多的是木霉产生的纤维素酶系和热纤梭菌C. thermocellum的纤维素酶小体。这些酶的活性比其他来源的纤维素酶的活性相对较高,但是它们的催化速度、稳定性还达不到工业化应用的要求,从而使酶的应用成本偏高。将外源基因克隆到发酵乙醇的高温菌中适时表达和分解纤维素底物,可以节省纤维素酶生产的费用;但是这些基因所编码的酶在高温生长条件下必须具有较强的稳定性。
许多高温菌具有很好的半纤维素酶活性。但是,这些酶通常都是诱导酶,在单糖浓度较高的条件下,基因转录和酶的活性通常会受到抑制[13,16]。与此相反,高糖发酵液是实现高浓度乙醇发酵的必要条件。因此,人们一方面要采用各种耐受高糖的高活性酶,另一方面要打破这些酶的自然表达调控机制,使这些酶的基因成为持家基因;同时,还希望这些酶的催化活性比较持久,或者说有较强的热稳定性。所有这些目标都期待着通过基因重组来实现。
3.3 高温细菌缺少稳定的遗传转化系统
对高温菌实施基因重组和代谢途径工程已经成为迫切需要。美国 Wiegel研究组首先构建了适用于高温厌氧芽胞杆菌Thermoanaerobacterium的穿梭质粒和整合质粒pIKM1[14,28];Peng等对高温厌氧杆菌Thermoanaerobacter发展了的基因转化质粒pTE16和相应的基因转化技术[27];为了提高转化率,Lin等将超声波转化技术应用于嗜热厌氧细菌的基因转化,提高了质粒转化的效率[29]。这些遗传转化系统和基因转化技术的发展为当前高温菌的分子生物学研究和基因敲除试验奠定了基础[8,24]。但是,这些遗传转化系统是在E. coli-Clostridium acettobutylicum的穿梭质粒pIMP1的基础上构建的,它们在高温细菌宿主细胞中很不稳定,甚至不能筛选到转化子的单菌落;只能靠转化后的一次混合培养来分析目标基因所表现的性状。迄今为止,还没有产生稳定性更好的适合于高温细菌基因转化的新型质粒。因此,遗传转化系统的缺乏是对高温乙醇发酵菌株实施大规模基因修饰和改造所面临的技术瓶颈。
4 展望
通过分子改造或生物合成将高温菌的优异性状组合到发酵工程菌株中,能够实现纤维素乙醇工艺中的“生物降解-发酵-蒸馏”的同步化,从而尽可能降低纤维素乙醇的生产成本。同步进行“生物降解-发酵-蒸馏”是纤维素乙醇发展中的一个目标更高、道路更远、科学性更强的可再生能源发展策略。欧美科学家在 30多年前就开始研究以高温细菌进行乙醇发酵和高温细菌水解利用纤维素、半纤维素的能力和机理,所取得的科学进展为今后的研究和发展奠定了良好的基础。目前面临的主要挑战包括发酵乙醇的高温细菌的遗传转化系统的不够稳定、缺少内源的高活性和耐热性的纤维素酶,以及代谢途径及其调控机理有待于进一步解析。这些科技难题将会在DNA生物合成和进化技术、细胞生物学技术,以及合成生物学技术的发展中得到解决。同时,虽然有些国际公司已经在尝试用高温菌生产纤维素乙醇,其技术前沿与人们的最高目标之间还有相当的距离;我们在该领域有很大的发展空间和机遇。但是我们应当注意到,欧美国家的学者对本领域科技前沿信息的接受与拓展速度是非常惊人的,例如,关于乙醇代谢途径调控机理的论文发表以后,很快就被引用到不同菌株或不同产物的研究中,新的研究结果已见报道[30-36]。我们需要更多有志解决科学问题、有发明创造能力的科技工作者的参与。
[1]Qu YB. Industrialization of cellulosic ethanol. Prog Chem, 2007, 19(7/8): 1098−1108 (in Chinese).
曲音波. 纤维素乙醇产业化. 化学进展, 2007,19(7/8): 1098−1108.
[2]Xu XJ, Wang XH, He YQ. The crucial problems and solutions on producing fuel ethanol by straw.Food Ferment Ind, 2010, 36(7): 108−113 (in Chinese).
许晓菁, 王祥河, 何雨青. 秸秆燃料乙醇的关键问题与对策. 食品与发酵工业, 2010, 36(7):108−113.
[3]谢忠设, 张建民. 纤维素乙醇成本接近粮食乙醇[EB/OL]. [2012-12-8]. http://www.ccin.com/cn/ccin/news/2012/08/07/236290.shtml (in Chinese).
[4]Wiegel J, Ljungdahl LG. The importance of thermophilic bacteria in biotechnology. CRC Crit Rev Biotechnol, 1986, 3(1): 39−107.
[5]Taylor MP, Eley KL, Martin S, et al.Thermophilic ethanologenesis: future prospects for second-generation bioethanol production. Trends Biotechnol, 2009, 27(7): 398−405.
[6]Ljungdahl LG, Bryant F, Carreira H, et al. Some aspects of thermophilic and extreme thermophilic anaerobic microorganisms. Basic Life Sci, 1981,18: 397−419.
[7]Wiegel J. Formation of ethanol by bacteria. A pledge for the use of extreme thermophilic anaerobic bacteria in industrial ethanol fermentation processes. Experientia, 1980, 36: 1434−1446.
[8]Shaw AJ, Podkaminer KK, Desai SG, et al.Metabolic engineering of a thermophilic bacterium to produce ethanol at high yield. Proc Natl Acad Sci USA, 2008, 105(37): 13769−13774.
[9]Wiegel J, Ljungdahl LG.Thermoanaerobacter ethanolicusgen. nov., spec. nov., a new, extreme thermophilic, anaerobic bacterium. Arch Microbiol,1981, 128: 343−348.
[10]Shao W, Wiegel J. Purification and characterization of two thermostable acetyl xylan esterases fromThermoanaerobacteriumsp. strain JW/SL-YS485.Appl Environ Microbiol, 1995, 61:729−733.
[11]Shao W, DeBlois S, Wiegel J. A high-molecularweight, cell associated xylanase isolated from exponentially growingThermoanaerobacteriumsp.strain JW/SL-YS485. Appl Environ Microbiol,1995, 61:937−940.
[12]Shao W, Obi SKC, Puls J, et al. Purification and characterization of the a-glucuronidase fromThermoanaerobacteriumsp. strain JW/SL-YS485.Appl Environ Microbiol, 1995, 61:1077−1081.
[13]Shao W, Xue Y, Wu A, et al. Characterization of a novel beta-xylosidase XylC fromThermoanaerobacterium saccharolyticumJW/SL-YS485. Appl Environ Microbiol, 2011,77(3): 719−726.
[14]Mai V, Wiegel J. Advances in development of a genetic system for spp.: expression of genes encoding hydrolytic enzymes, development of a second shuttle vector, and integration of genes into the chromosome. App Environ Microbiol, 2000,66(11): 4817−4821.
[15]Ljungdahl LG, Carriera LH. High ethanol producing derivatives ofThermoannaerobacter ethanolicus: US, 4385117. 1982-05-24.
[16]Shao W, Wiegel J. Purification and characterization of a thermostable β-xylosidase fromThermoanaerobacter ethanolicus. J Bacteriol,1992, 174: 5848−5853.
[17]Burdette D, Zeikus JG. Purification of acetaldehyde dehydrogenase and alcohol dehydrogenases fromThermoanaerobacter ethanolicus39E and characterization of the secondary-alcohol dehydrogenase (2° ADH) as a bifunctional alcohol dehydrogenase-acetyl-CoA reductive thioesterase.Biochem J, 1994, 302: 163−170.
[18]Ben-Bassat A, Lamed R, Zeikus JG. Ethanol production by thermophilic bacteria:metabolic control of end product formation inThermoanaerobing brockii. J Bacteriol, 1981, 146:192−199.
[19]Burdette DS, Jung SH, Shen GJ, et al.Physiological function of alcohol dehydrogenases and long-chain (C-30) fatty acids in alcohol tolerance ofThermoanaerobacter ethanolicus.Appl Environ Microbiol, 2002, 68: 1914−1918.
[20]Ramos JL, Duque E, Gallegos MT, et al.Mechanisms of solvent tolerance in gram-negative bacteria. Ann Rev Microbiol, 2002, 56: 743−768.
[21]Bryant F, Wiegel J, Ljungdahl LG. Purification and properties of primary and secondary alcohol dehydrogenases formThermoanaerobacter ethanolicus. Appl Environ Microbiol, 1988, 54:460−465.
[22]Burdette D, Vieille C, Zeikus JG. Cloning and expression of the gene encoding theThermoanaerobacter ethanolicus39E secondary-alcohol dehydrogenase and biochemical characterization of the enzyme. Biochem J, 1996,316: 115−122.
[23]Holt PJ, Williams RE, Jordan KN, et al. Cloning,sequencing and expression inEscherichia coliof the primary alcohol dehydrogenase gene fromThermoanaerobacter ethanolicusJW200. FEMS Microbiol Lett, 2000, 190: 57−62.
[24]Peng H, Wu G, Shao W. The aldehyde/alcohol dehydrogenase (AdhE) in relation to the ethanol formation inThermoanaerobacter ethanolicusJW200. Anaerobe, 2008, 14: 125−127.
[25]Pei J, Zhou Q, Jiang Y, et al.Thermoanaerobacterspp. control ethanol pathway via transcriptional regulation and versatility of key enzymes. Metab Eng, 2010, 12: 420−428
[26]Pei J, Zhou Q, Jing Q, et al. The mechanism for regulating ethanol fermentation by Redox levels inThermoanaerobacter ethanolicus. Metab Eng,2011, 13: 186−193.
[27]Peng H, Fu B, Mao Z, et al. Electrotransformation ofThermoanaerobactor ethanolicusJW200.Biotechnol Lett, 2006, 28: 1913−1917.
[28]Mai V, Lorenz WW, Wiegel J. Tranformation ofThermoanaerobacteriumsp. Strain JW/SL-YS485 with plasmid pIKM1 conferring kanamycin resistance. FEMS Microbiol Lett, 1997, 148(2):163−167.
[29]Lin L, Song H, Ji Y, et al. Ultrasound-mediated DNA transformation in thermophilic Gram-positive anaerobes. PLoS ONE, 2010, 5(9): e12582.
[30]Bielen AAM, Verhaart MRA,Vanfossen AL, et al.2013. A thermophile under pressure:Transcriptional analysis of the response ofCaldicellulosiruptor saccharolyticusto different H2 partial pressures. Int J Hydrogen Energ, 2013,38(4): 1837−1849.
[31]Wietzke M, Bahl H. The redox-sensing protein Rex, a transcriptional regulator of solventogenesis inClostridium acetobutylicum. Appl Microbiol Biotechnol, 2012, 96(3): 749−761.
[32]Joe Shaw A, Covalla SF, Miller BB, et al. Urease expression in aThermoanaerobacterium saccharolyticumethanologen allows high titer ethanol production. Metab Eng, 2012, 14(5):528−532.
[33]Ravcheev DA, Li X, Latif H, et al. Transcriptional regulation of central carbon and energy metabolism in bacteria by redox-responsive repressor rex. J Bacteriol, 2012, 194(5): 1145−1157.
[34]Revel S, Doudet L, Alonso L, et al. 2012. Surface acoustic wave sensing of linear alcohols using para-acylcalix[n]arenes Chem Commun, 2012, 48(1): 73−75.
[35]Shao X, Raman B, Zhu M, et al. Mutant selection and phenotypic and genetic characterization of ethanol-tolerant strains ofClostridium thermocellum. Appl Microbiol Biotechnol, 2011,92(3): 641−652.
[36]Rydzak T, Levin DB, Cicek N, et al. 2011.End-product induced metabolic shifts inClostridium thermocellumATCC 27405. Appl Microbiol Biotechnol, 2011, 92(1): 199−209.
January 11, 2013; Accepted: February 6, 2013
Weilan Shao. Tel: +86-511-88796122; E-mail: weilanshao@gmail.com
国家自然科学基金 (No. 31170027),江苏高校优势学科建设工程 (PAPD) 项目资助。
Advances in and challenges for thermophilic fermentation of cellulosic ethanol
Yilin Le, and Weilan Shao
Biofuels Institute,School of Environment,Jiangsu University,Zhenjiang212013,Jiangsu,China
Thermophiles can produce cellulosic ethanol at a high temperature where ethanol is directly distillated from fermentation, and biodegradation of lignocellulose can be simultaneously achieved when these thermophiles carry and express cellulase and hemicellulase genes. The simultaneous biodegradation, fermentation and distillation, a three-in-one process, can result in low production costs of cellulosic ethanol. We reviewed the advances and challenges in the approach to the three-in-one process, which refer to lignocellulases, regulation mechanisms, and genetic transfer systems.
cellulosic ethanol, thermophiles, regulation mechanisms, genetic transfer systems, synthetic biology
Supported by: Nantional Natural Science Foundation of China (No. 31170027), PAPD of Jiangsu Higher Education Institutions.
(本文责编 陈宏宇)