CKD患者尿沉渣中CCN2/CCN3 mRNA检测的临床意义探讨
2013-09-03陈珑高民刘丹倪海峰曹玉涵刘宏张建东刘必成
陈珑,高民,刘丹,倪海峰,曹玉涵,刘宏,张建东,刘必成
(东南大学附属中大医院肾内科,肾脏病研究所,东南大学医学院,江苏南京 210009)
慢性肾脏疾病(CKD)已被广泛地认为是威胁公众健康的重大疾病[1-2],CKD的进展表现为肾功能的下降和肾单位的破坏,而肾功能的下降通常在肾实质损伤之后,取决于残余肾单位的代偿能力[3]。因此,探究肾实质的结构损伤比测定肾功能的标记物如血肌酐更为重要。
肾活检是确认肾脏病理变化的有效手段,但它有不容忽视的风险、并发症和局限性[4]。基于此原因,已有大量的研究投入到寻找替代方法来监测肾脏病变进展[5]。例如白蛋白尿已证实为监测糖尿病肾病进展的可靠指标[6],但是也有相当多的证据显示,蛋白尿或白蛋白尿并不是监测非糖尿病肾病的理想指标[7-8],因此,寻找出其他生物标记物来监测非糖尿病肾病患者肾损害进展具有十分重要的意义[5]。
近来,测定尿中目的基因mRNA的表达已成为监测各种肾脏疾病的有效方法。例如,Li等研究发现尿沉渣穿孔素和颗粒蛋白酶B mRNA的测定可成为诊断肾移植后急性排斥反应的有效无创检测手段[9],最新的研究提示这种基于mRNA检测的技术方法亦可临床应用于评估小管间质纤维化及足细胞的损伤等[10-13]。我们前期的研究表明,结缔组织生长因子是重要的致肾纤维化因子,因此,本研究拟探讨非糖尿病性慢性肾脏疾病(CKD)患者尿沉渣中CCN2/CCN3mRNA表达与肾小球组织病理学变化之间的关系。
1 资料和方法
1.1 病例选取和一般资料
35例CKD患者来自于东南大学附属中大医院,病例诊断标准参照NKF KDOQI指南2000。选择标准为:存在蛋白尿且(或)评估肾小球滤过率 GFR≤60 ml·min-1。淘汰标准为:感染、其他全身系统性疾病症状体征者、取样前2周内使用血管紧张素转化酶抑制剂(ACEI)或血管紧张素受体拮抗剂(ARB)类药物。患者分为两组:轻度蛋白尿[蛋白尿≤1 g·(24 h)-1,n=13]和中重度蛋白尿[蛋白尿 >1 g·(24 h)-1,n=22]。正常对照组12例来自于体检中心,纳入标准为:年龄>40岁,无高血压、糖尿病,无临床或实验室证明患有CKD。临床资料包括体重、收缩压、24 h尿蛋白定量、肾小球滤过率估算值(eGFR),eGFR计算法参照Ma等提出的适合于中国人体质的计算方程[14]。
1.2 尿液标本采集和RNA提取
尿液标本采集沿用先前文献发表的方法[11],即在患者入院的第1天或者参加体检时收集晨尿标本。然后4℃下3 000 g离心30 min,收集沉渣,用1.5 ml经DEPC处理过的PBS重新悬浮后再次4℃下13 000 g离心5 min。有部分尿沉渣进行细胞病理学检查,余下的沉渣溶入1.0 ml的RNAiso Plus(TAKARA,Dalian,China),在-80℃下保存待检。
总RNA提取按照厂家(TAKARA)试剂说明书进行,RNA的完整性通过RNA电泳检测。RNA的浓度和纯度使用 nanodrop2000(Thermo,Wilmington,USA)检测。只有RNA样本吸光度比值(260/280)大于1.8才能进行下一步研究。
1.3 逆转录和Real-time PCR
根据试剂说明书进行,在逆转录过程中加入同样数量的模板RNA和PrimeScriptTMRT酶(TAKARA),随即置于 Bio-Rad thermal cycle(Bio-Rad,CA),按照程序37℃15 min、85℃ 5 s进行逆转录工作,然后加入RNase H(invitrogen,NY)以减少RNA残留。得到的cDNA用Nanodrop 2000检查浓度和纯度。
本研究中,CCN2和CCN3mRNA的相对定量使用ABI Prism 7300序列检测系统(Applied Biosystems,California,USA)。人GAPDH作为看家基因,引物序列如下:CCN2 F 5'-GGA AAA GAT TCC CAC CCA AT-3';CCN2 R 5'-TGC TCC TAA AGC CAC ACC TT-3';CCN3 F 5'-TAA ACT GAG GCC CAA AGC AC-3';CCN3 R 5'-TGG CCC AAG GAT AAG TTT TG-3'。根据操作指南为Real-time PCR(Applied Biosystem,CA)加入SYBRGRYN master。所有样本分3份,至少进行两次检测。PCR反应分两步骤进行:95℃ 30 s、95℃5 s,然后60℃ 31 s(40个循环)。记录解离曲线DC和解链温度 Tm,使用 Sequence Detection Software version 1.4(Applied Biosystems,CA)分析结果。目标基因的相关基因表达由标准曲线法定量。各基因的PCR前产物作为标准,在10次连续稀释下制定标准曲线。标准曲线包含于整个PCR流程。目标基因和看家基因的反应式丰度作为评估各基因的表达强度的指标,对照组使用ddH2O在整个流程中呈阴性。两次使用解链曲线和电泳法确认PCR产物的特异性。
1.4 肾活检标本的形态学测定
肾脏活体标本经过PAS染色,按照前述方法[15]使用计算机辅助方法进行形态学测定分析肾小球胞外基质增生情况。简述为:使用 Leica microscope system(Germany)对所有肾脏标本的肾小球进行40倍成像,ImageJ软件分析肾小球的PAS染色阳性比例。上述程序由两名肾脏病理医生独立进行。
1.5 统计学处理
使用Graph pad Prism 5.01进行分析,所有数据均以±s格式表示,除非其他特殊需说明的情况。3个组的基本数据进行单相方差分析(ANOVA),基因表达和肾小球病理评分的关联性分析使用Spearman rank-order correlation。P<0.05为差异有统计学意义。
2 结 果
2.1 受试人群基本临床参数
受试人群的基本特征见表1。正常对照组和非糖尿病CKD组之间年龄、体重、性别等差异无统计学意义,然而CKD组患者平均尿蛋白量明显高于正常对照组[(2.28 ±0.44)vs.(0.043 ±0.017)g·(24 h)-1,P <0.000 1]。
表1 受试者临床基本数据±s)Tab 1 Primary characteristics of the study subjects( ± s)
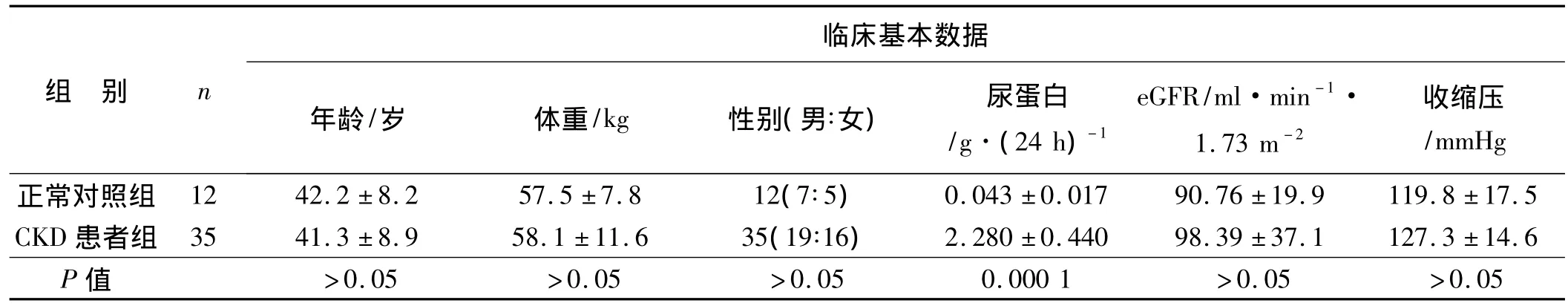
表1 受试者临床基本数据±s)Tab 1 Primary characteristics of the study subjects( ± s)
组 别 n临床基本数据年龄/岁 体重/kg 性别(男∶女) 尿蛋白/g·(24 h)-1 eGFR/ml·min-1·1.73 m-2收缩压/mmHg正常对照组 12 42.2 ±8.2 57.5 ±7.8 12(7∶5)0.043 ±0.017 90.76 ±19.9 119.8 ±17.5 CKD 患者组 35 41.3 ±8.9 58.1 ±11.6 35(19∶16) 2.280 ±0.440 98.39 ±37.1 127.3 ±14.6 P值 >0.05 >0.05 >0.05 0.000 1 >0.05 >0.05
2.2 尿沉渣CCN2和CCN3mRNA的表达
我们首先测定了所有受试者的尿沉渣中CCN2和CCN3mRNA的水平。如图1所示,在正常对照组中亦能检测出CCN2和CCN3mRNA的表达。检测中发现,CKD组的两种分子的mRNA水平较正常对照组显著升高(CCN2:P=0.005 2,CCN3:P=0.000 1)。提示这两种分子标记物可以很好地将正常对照和CKD患者的尿液区分出来。

图1 CKD患者组及正常对照组尿沉渣CCN2和CCN3的表达Fig 1 Urinary CCN2,CCN3 expression in CKD patients and health controls
2.3 以尿蛋白分级的CKD患者尿mRNA表达水平
我们研究了根据尿蛋白程度分级的CKD患者尿中的CCN2和CCN3mRNA表达水平是否一致。35例CKD患者分为两组:尿蛋白≤1 g·(24 h)-1和 >1 g·(24 h)-1。结果显示,这两组CKD患者尿CCN2和CCN3mRNA水平均较正常对照组显著增多(CCN2:P=0.020 4;CCN3:P=0.000 6),而两组CKD患者尿中的CCN2和CCN3mRNA表达水平并无显著性差异,提示尿液CCN2和CCN3mRNA水平并不随尿蛋白严重程度而增加。见图2。

图2 不同尿蛋白组CKD患者尿沉渣CCN2和CCN3 mRNA的表达Fig 2 Urinary CCN2,CCN3 mRNA expression among CKD patients with different level of proteinuria
2.4 肾小球组织病理分级和尿CCN2、CCN3mRNA表达水平及两者之间比率的相关性研究
35例患者中,17例接受了肾活检(其中7例IgA肾病,5例局灶节段性肾小球硬化,3例狼疮性肾炎,2例特发性膜性肾病)。我们进行了肾小球胞外基质增生的分级与CCN2、CCN3的关联分析及两者比值的关联分析。如图3所示,可见尿CCN2mRNA与胞外基质增生分级无显著相关性,而尿CCN3mRNA和肾小球胞外基质增生呈现负相关(r=-0.614 6,P=0.008 7)。更重要的是,尿CCN2和CCN3mRNA的比值与肾小球胞外基质增生分级密切相关(r=0.647 2,P=0.005)。另外我们发现两组CKD患者中尿蛋白程度与肾小球PAS评分之间无显著相关性,这更进一步证明尿蛋白的程度不适合作为评估非糖尿病CKD患者病理学改变的生物学指标。
2.5 肾脏活检标本的形态学测定结果
见图4。
3 讨 论
在本研究中,我们揭示了CKD患者的尿CCN2、CCN3mRNA显著地高于正常对照组,然而在蛋白尿水平不同的CKD患者尿中,这两种标记物的mRNA表达水平没有显著差异。虽然如此,我们发现尿CCN3mRNA的水平与肾小球病理分级呈显著负相关。此外,尿CCN2、CCN3的比值与肾小球硬化程度关系更加密切(图5),提示我们可以采用这种无创检查手段监测非糖尿病CKD患者肾小球病理变化的情况。
先前的研究证实,CCN2在病变的肾脏中表达增加,并且可以在血液和尿液等体液中检测到[16]。尿CCN2蛋白水平与糖尿病肾病的严重程度相关,但易被多种干预情况影响[17]。我们的研究清楚地显示了CKD患者尿CCN2mRNA显著增高,更证实了CCN2在肾脏纤维化的发病机制中起重要作用这一观点。而近期也有数据揭示,在肾小球肾炎和糖尿病患者中损伤的肾小球CCN3的表达增加[18]。与此一致,我们发现CKD患者尿CCN3mRNA较正常对照组显著增高。
为了研究这两种标记物能否作为监测肾小球病理改变严重程度的指标,我们研究了不同程度蛋白尿患者尿CCN2和CCN3mRNA水平。结果显示,不同程度的蛋白尿患者尿CCN2和CCN3mRNA表达水平没有显著性差异,同时我们的研究不能证实 CCN2或CCN3mRNA与eGFR降低之间的有无相关关系(数据未显示)。这一结果似乎与我们先前的研究及他人的研究结论相矛盾,即在人类肾脏病或实验动物模型中,尿液或肾组织CCN2蛋白的表达与肾脏纤维化密切相关[17,19]。因此,本研究提示:第一,特定分子的尿mRNA表达与其尿中的蛋白水平无明确相关性[20]。尿mRNA主要来源于尿沉渣中脱落细胞和外染色体结构,而尿中分子的蛋白水平取决于肾小球滤过和小管重吸收的共同作用。第二,当前的尿mRNA的测定技术采用看家基因来进行标准化,应该能排除其他因素干扰[21]。而尿蛋白水平为总体水平,不能将蛋白尿和白蛋白尿区分测定,这种情况与Goumenos的研究也相类似,他们的研究表明,尿TGF-β1mRNA而非TGF-β蛋白与肾小管间质纤维化密切相关[20]。

图3 尿沉渣CCN2、CCN3 mRNA及两者的比值与肾小球硬化的相关分析Fig 3 Correlation between Urinary CCN2,CCN3 mRNA ,their ratio and glomerulosclerosis
本研究最重要的发现是,在17例接受肾活检的患者中尿CCN3mRNA与肾小球硬化程度呈负相关。若用CCN2/CCN3mRNA之值替代CCN3mRNA则相关程度更为密切,结合既往研究工作我们认为,CCN2可能作为肾小球损伤病理变化的启动因子,而CCN3没有足够的拮抗作用,最终导致肾小球硬化的发生。
受限于医疗资源和其他原因,我们有很多CKD患者不能或不愿意接受肾活检。如果考虑到在中国和世界上其他不发达地区CKD的高发病率,那么我们会意识到除检测尿蛋白外,还迫切需要找到另外一种来监测肾脏病变情况的方法。先前我们课题组在糖尿病肾病模型的研究中首次应用抗体芯片技术,证实尿液中某些细胞因子水平的变化与糖尿病肾病的发生发展和转归密切相关,为监测糖尿病肾病病变情况提供了新的途径[22]。而在本临床研究中,我们的研究结果正是提供了一种可行性很强的替代手段,即可以通过检测CKD患者尿液CCN2/CCN3mRNA来检测肾脏病变的进展。
本研究也有些不可避免的局限性:第一,我们的研究结果需要在大样本的不同原因引起的CKD患者群中进一步确认。第二,我们的研究数据来自于初诊未接受医疗干预的患者。因此,下一步可将更多的精力用于研究常用的治疗药物如甾类、抗高血压药物是否能影响上述的研究结果。
总之,本研究证实了尿沉渣中CCN2/CCN3mNRA与非糖尿病的CKD患者的肾小球硬化程度密切相关,提示该项检测可能成为非创伤性评估非糖尿病CKD患者肾脏病变程度的有效检查手段。
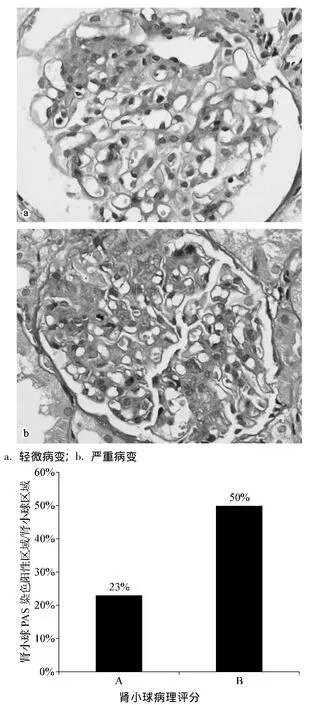
图4 不同程度的肾小球硬化典型图片及病理评分 ×400Fig 4 Representativeimagesand pathologicscoreof glomeruli with different degrees of sclerosis ×400
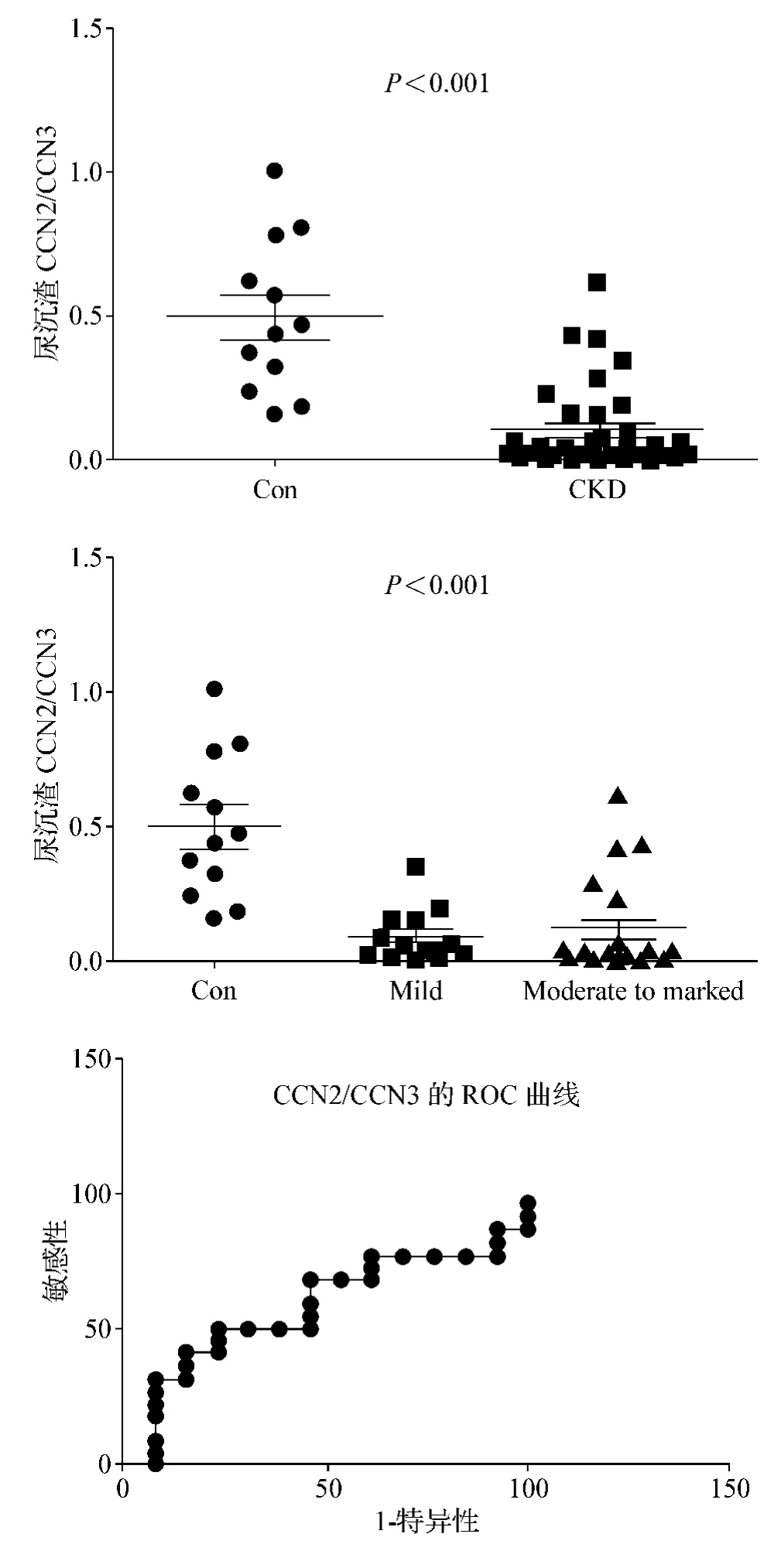
图5 CKD患者尿沉渣中CCN2/CCN3mRNA的比值研究Fig 5 Ratio of urinary mRNA of CCN2,CCN3 in CKD patients
[1]ZHANG L,WANG F,WANG L,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].Lancet,2012,379(9818):815-822.
[2]CORESH J,SELVIN E,STEVENS L A,et al.Prevalence of chronic kidney disease in the United States[J].JAMA,2007,298(17):2038-2047.
[3]MEGUID EI NAHAS A,BELLO A K.Chronic kidney disease:the global challenge[J].Lancet,2005,365(9456):331-340.
[4]SCHECKNER B,PEYSER A,RUBE J,et al.Diagnostic yield of renal biopsies:a retrospective single center review[J].BMC Nephrol,2009,10:11.
[5]BRAMHAM K,MISTRY H D,POSTON L,et al.The non-invasive biopsy—will urinary proteomics make the renal tissue biopsy redundant[J].QJM,2009,102(8):523-538.
[6]MACISAAC R J,JERUMS G.Diabetic kidney disease with and without albuminuria[J].Curr Opin Nephrol Hypertens,2011,20(3):246-257.
[7]CAGLAR K,YILMAZ M I,SONMEZ A,et al.ADMA,proteinuria,and insulin resistance in non-diabetic stage I chronic kidney disease[J].Kidney Int,2006,70(4):781-787.
[8]De JONG P E,GANSEVOORT R T.Albuminuria in non-primary renal disease:risk marker rather than risk factor[J].Nephrol Dial Transplant,2010,25(3):656-658.
[9]LI B,HARTONO C,DING R,et al.Noninvasive diagnosis of renal-allograft rejection by measurement of messenger RNA for perforin and granzyme B in urine[J].N Engl J Med,2001,344(13):947-954.
[10]SATO Y,WHARRAM B L,LEE S K,et al.Urine podocyte mRNAs mark progression of renal disease[J].J Am Soc Nephrol,2009,20(5):1041-1052.
[11]ZHENG M,LV L L,CAO Y H,et al.Urinary mRNA markers of epithelial-mesenchymal transition correlate with progression of diabetic nephropathy[J].Clin Endocrinol(Oxf),2012,76(5):657-664.
[12]ZHENG M,LV L L,NI J,et al.Urinary podocyte-associated mRNA profile in various stages of diabetic nephropathy[J].PLoS One,2011,6(5):e20431.
[13]SZETO C C,LAI K B,CHOW K M,et al.Messenger RNA expression of glomerular podocyte markers in the urinary sediment of acquired proteinuric diseases[J].Clin Chim Acta,2005,361(1-2):182-190.
[14]MA Y C,ZUO L,CHEN J H,et al.Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J].J Am Soc Nephrol,2006,17(10):2937-2944.
[15]HUANG Y,BORDER W A,YU L,et al.A PAI-1 mutant,PAI-1R,slows progression of diabetic nephropathy[J].J Am Soc Nephrol,2008,19(2):329-338.
[16]DENDOOVEN A,GERRITSEN K G,NGUYEN T Q,et al.Connective tissue growth factor(CTGF/CCN2)ELISA:a novel tool for monitoring fibrosis[J].Biomarkers,2011,16(4):289-301.
[17]RISER B L,CORTES P,DENICHILO M,et al.Urinary CCN2(CTGF)as a possible predictor of diabetic nephropathy:preliminary report[J].Kidney Int,2003,64(2):451-458.
[18] RISER B L,NAJMABADI F,PERBAL B,et al.CCN3(NOV)is a negative regulator of CCN2(CTGF)and a novel endogenous inhibitor of the fibrotic pathway in an in vitro model of renal disease[J].Am J Pathol,2009,174(5):1725-1734.
[19]LIU B C,HUANG H Q,LUO D D,et al.Connective tissue growth factor is associated with the early renal hypertrophy in uninephrectomized diabetic rats[J].Chin Med J(Engl),2006,119(12):1010-1016.
[20]GOUMENOS D S,TSAKAS S,EI NAHAS A M,et al.Transforming growth factor-beta(1)in the kidney and urine of patients with glomerular disease and proteinuria[J].Nephrol Dial Transplant,2002,17(12):2145-2152.
[21]COLUCCI G,FLOEGE J,SCHENA F P.The urinary sediment beyond light microscopical examination[J].Nephrol Dial Transplant,2006,21(6):1482-1485.
[22]倪杰,戴厚永,郑敏,等.抗体芯片在糖尿病肾病大鼠尿液细胞因子同步检测中的应用[J].东南大学学报:医学版,2012,31(3):249-253.
