叶色黄化突变体甜瓜叶片内部生理生化变化的研究
2013-09-03于泽源李兴国高艳娟
邵 勤 于泽源 李兴国 李 为 高艳娟
(东北农业大学园艺学院,黑龙江哈尔滨150030)
叶色变异是植物界的生命现象之一,其发生频率相对较高,是比较常见的突变性状。叶色突变体类型丰富,来源广泛,形成的原因各不相同。它们是研究植物光合系统、抗病机制及激素生理等代谢过程的重要材料(Singh et al.,2000;Agrawal et al.,2001;Fambrini et al.,2004),同时也是分析鉴定基因功能和创造优异种质资源的理想材料。近年来,国内外已从拟南芥(Jarvis et al.,1998)、水稻(Wu et al.,2007)、玉米(Yukari & Toshiya,2004)、大麦(Yaronskaya et al.,2003)、小麦(Koval et al.,2001)、油菜(Zhao et al.,2001)、黄瓜(苗晗 等,2010)等作物中发现、获得并鉴定出一些叶色突变体。以往对于甜瓜(Cucumis meloL.)叶色突变体的研究报道主要着重于叶色突变体的发生和遗传规律等方面(Whitaker,1952),但叶色变异的机理尚未明确,没有对光合系统的超微结构、叶绿素代谢变化等叶片内部生理生化变化进行深入研究。
本试验以新发现的甜瓜叶色黄化突变体9388-1为试材,通过对突变体与其突变亲本白莎蜜1号叶绿体超微结构、光合色素含量、叶绿素的生物合成、叶绿素荧光参数等方面的比较,对叶色黄化突变体的生理生化变化进行研究,初步明确突变体叶色黄化的生理机制,为该性状用于今后的育种实践提供理论依据。
1 材料与方法
1.1 材料
试验材料正常株系为白莎蜜1号(农家品种),不含叶色突变基因。突变体9388-1是在田间种植白莎蜜1号时发现的自然突变体,经过多年自交发现其后代叶色性状不发生分离,能够稳定遗传,在表型上与以往报道的甜瓜叶色突变体不同,整个生长周期都表现出该性状。突变体9388-1除了叶色与白莎蜜1号有差异外,其他性状并无较大差异。由于突变体9388-1叶片的黄化,影响其光合作用,植株生长比突变亲本稍缓慢,但是其他农艺性状均不受影响,生长发育正常(图1)。
2012年3月13日将白莎蜜1号及其突变体9388-1播种育苗,4月26日定植于东北农业大学园艺试验站塑料大棚中。试验设突变亲本和突变体两个处理,每处理20株,3次重复,随机区组排列,株距30 cm,行距60 cm,两侧各种保护行,常规田间管理。
1.2 方法
1.2.1 光合色素含量的测定 叶绿素a(Chla)、叶绿素b(Chlb)和类胡萝卜素(Caro)含量按照李合生(2000)的方法并略作修改,用T6紫外分光光度计进行测定,含量以mg·g-1(FW)表示。具体步骤如下:
① 5月15日植株处于伸蔓期,各处理随机选10株,8:00~9:00取植株顶部向下数第5片叶,洗净,用直径0.5 cm的打孔器取50个圆片。

图1 突变体与突变亲本叶片颜色
② 随机称取叶片圆片0.2 g,共3份,分别装入25 mL带塞的刻度试管中,加入10 mL 80%的丙酮,浸提48 h,至组织发白。
③ 离心去上清液,用80%的丙酮定容至25 mL,以80%的丙酮为空白对照,溶液在波长为663、646 nm和470 nm下进行比色,所测得的吸光度(OD)代入以下公式计算出溶液中的Chla、Chlb 和 Caro 含量(mg·L-1):

式中C表示叶绿素浓度。
1.2.2 叶绿素生物合成前体物质相对含量的测定 利用北京普析通用T6紫外分光光度计和日立850型荧光分光光度计测定叶绿素生物合成前体物质相对含量,参照徐培洲等(2006)的方法,略有改动。取处于伸蔓期(5月15日)的突变体和突变亲本植株顶部向下数第5片叶进行测定。将白莎蜜1号的各种前体物质含量定为100%,与突变体9388-1进行比较。
① 5-氨基乙酰丙酸(ALA)的测定。将0.5 g叶片,用5 mL 4%的三氯乙酸(W/V)及少量石英砂研磨3遍并合并上清液,定容至20 mL,18 000g离心10 min,取上清液5 mL加入2.4 mL的醋酸钠(1 mol·L-1)和0.15 mL的乙酰丙酮,沸水浴煮10 min后冷却至室温,取2 mL加入等体积的显色液(Ehrlich-Hg试剂:1 g P-二甲胺基苯甲醛溶解于30 mL冰乙酸中,加入8 mL 70%的高氯酸,再用冰乙酸稀释到50 mL,最后加入0.2 g升汞)黑暗条件下静置15 min,后用紫外分光光度计测定553 nm处的OD值。
② 胆色素原(PBG)的测定。将0.5 g叶片用液氮研磨后,加入5 mL提取缓冲液(0.6 mol·L-1Tris,0.1 mol·L-1EDTA,pH 8.2),18 000g离心10 min,取上清液2 mL加入等体积的显色液黑暗条件下静置15 min后用紫外分光光度计测定553 nm处的OD值。PBG含量以553 nm的摩尔消光系数7.2×104mol-1·cm-1计算。
③ 尿卟啉原Ⅲ(UrogenⅢ)和粪卟啉Ⅲ(CoprogenⅢ)的测定。1 g叶片用液氮研磨后,加入10 mL的提取缓冲液(0.067 mol·L-1PBS,pH 6.8),18 000g离心10 min,取上清液5 mL加入0.25 mL 1%的硫代硫酸钠,漩涡振荡,用强光照射20 min。加入1 mol·L-1的冰乙酸调整pH至3.5。用10 mL乙醚进行萃取,重复3次,静置分层后测定水相在405.5 nm处的OD值,UrogenⅢ含量以405.5 nm的摩尔消光系数5.48×105mol-1·cm-1计算;上述乙醚萃取液进行合并,再用3 mL 0.1 mol·L-1盐酸萃取3次,合并后测定盐酸相在395.5 nm处的OD值。CoprogenⅢ含量以405.5 nm的摩尔消光系数4.89×105mol-1·cm-1计算。
④ 原卟啉Ⅸ(ProtoⅨ)、镁原卟啉(Mg-Proto)和原脱植基叶绿素酸酯(Pchlide)的测定。取叶片1 g进行冰浴研磨,溶于20 mL丙酮-0.1 mol·L-1氨水(9V:1V)溶液中,用等体积的正己烷萃取该丙酮溶液,静置10 min,测定下层丙酮相的荧光发射强度E400F633、E400F622、E440F595和E440F640。根据以下公式即可计算ProtoⅨ和Pchlide的含量。
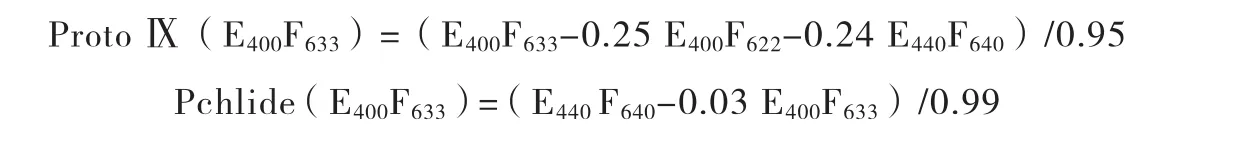
同时,镁原卟啉(Mg-Proto)相对含量直接以E440F595值表示。
1.2.3 叶绿素荧光参数的测定 采用美国LI-6400型便携式光合仪,室外自然条件下,于上午直射光照射叶片前进行测定。随机选取处于伸蔓期(5月15日)的突变体9388-1和白莎蜜1号植株顶部向下数第5片功能叶片进行测定,每个处理测10株,每株2次重复,取均值。测定前,叶片用锡泊纸包裹,进行暗适应30 min(全部做标记)后,按照LI-6400型便携式光合仪荧光叶室操作说明进行操作,记录初始荧光(F0)、最大荧光(Fm)、PSⅡ的实际利用量子产额(ФPSⅡ)、非环式电子传递速率(ETR)、光化学猝灭系数(qP)等荧光动力学参数。
1.2.4 叶绿体超微结构的观察
① 样品前处理:5月15日,随机选取处于伸蔓期的突变体9388-1和突变亲本白莎蜜1号植株各10株,8:00~9:00摘下植株顶部向下数第5片功能叶片,用去离子水迅速清洗干净,用滤纸吸干水分,切成1 cm×1 cm的小块在pH 6.8的2.5%戊二醛溶液中进行前固定,并置于4 ℃冰箱中保存。
② 电镜样品制备与观察:前固定期间将其切成1 mm×2 mm小块,用pH 6.8的磷酸缓冲液冲洗3次,再放入2%四氧化锇中固定1.5 h。之后用pH 6.8的磷酸缓冲液冲洗3次,用梯度10%的酒精系列脱水,从50%至100%,每级10 min。经过酒精和丙酮混合液及纯丙酮将样品中的酒精置换成丙酮,再将样品分别浸入丙酮∶环氧树脂812为1∶1和1∶2的混合物中40 min和1.5 h,在纯环氧树脂812中渗透24 h,然后包埋,在60 ℃的恒温培养箱中进行聚合反应。用奥地利Reichert-Jung公司的ULTRACUT-E型超薄切片机切厚度约为50~70 nm的切片,用带有支持膜的样品载网捞起,放入培养皿中,用醋酸双氧铀、柠檬酸铅在25 ℃下分别对样品进行染色,用双重蒸馏水冲洗干净。然后在日本日立公司的H-7650型透射电子显微镜下观察并照相。
1.3 数据分析
试验各项测定指标均3次重复,用DPS6.5软件进行差异显著性分析,数据处理及图表制作用EXCEL。
2 结果与分析
2.1 突变体与突变亲本叶片光合色素含量比较
由表1可以看出,突变体9388-1的光合色素含量都要显著低于白莎蜜1号,其中叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的含量分别减少了79.5%、90.3%、81.5%、70.7%,表明该突变体为总叶绿素缺乏突变体,植株黄化是由叶绿素含量降低所导致的。突变体9388-1的叶绿素a/b比值为8.67,显著高于白莎蜜1号,说明叶绿素a降低幅度小于叶绿素b,叶绿素含量和比例的变化,导致了叶色的黄化。

表1 突变体与突变亲本光合色素含量
2.2 突变体与突变亲本叶绿素生物合成前体物质相对含量比较
黑暗状态下的甜瓜,由于未见光,合成的叶绿素前体物质处于积累状态。由图2可以看出,突变体与突变亲本的5-氨基乙酰丙酸(ALA)含量差异不明显,但胆色素原(PBG)含量差异显著,且突变体的PBG含量显著高于突变亲本,之后突变体的各前体物质含量开始下降,且显著低于突变亲本正常株,说明突变体9388-1叶绿素合成受阻于胆色素原(PBG)与尿卟啉原Ⅲ(UrogenⅢ)之间。
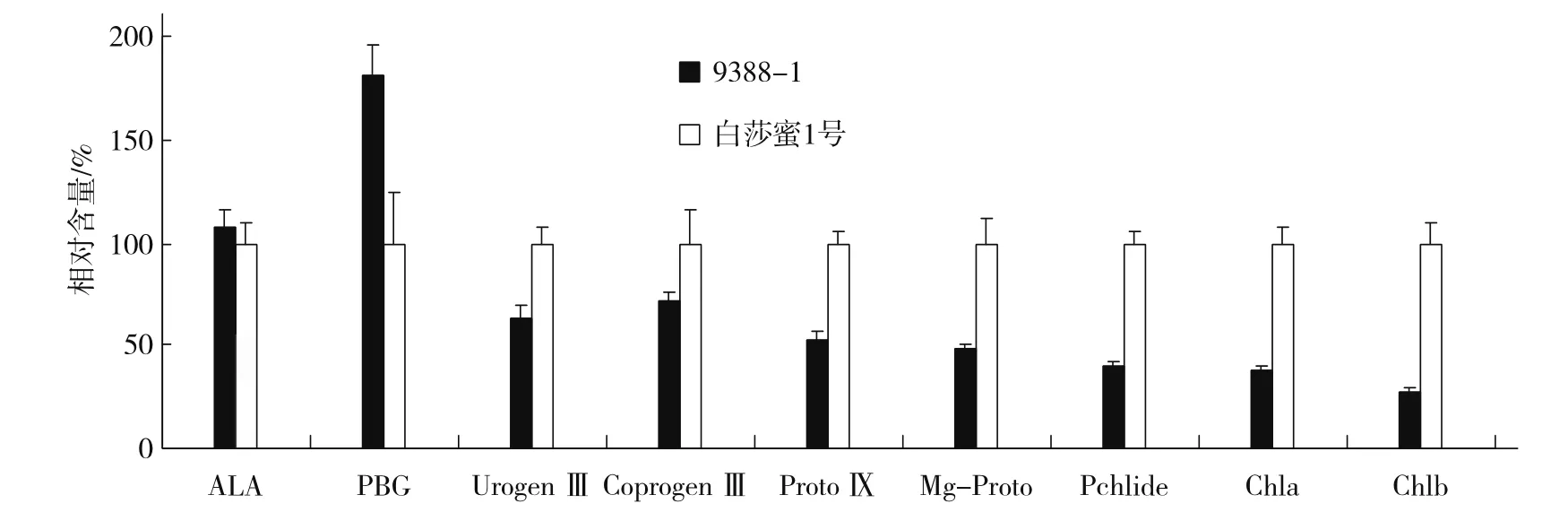
图2 突变体与突变亲本叶绿素生物合成前体物质相对含量
2.3 突变体与突变亲本叶绿素荧光参数比较
由表2可以看出,突变体F0、净光合速率(Pn)、ФPSⅡ和ETR显著低于突变亲本,非光化学猝灭系数qN和NPQ显著高于突变亲本,表明这与叶绿素含量降低的趋势一致,PSⅡ天线色素吸收光能并用于光合电子传递的量子产额和非环式电子传递效率有所降低。突变体Fm、PSⅡ原初光能转化效率(FV/Fm)和qP与突变亲本无显著差异,说明叶绿素含量在一定范围内的减少不会显著影响最大荧光产物,对光化学猝灭影响不大且突变体的光化学效率相对提高。综上表明,突变体能及时地耗散过剩的光能,对光合机构起一定的保护作用,维持正常的光合作用和能量代谢,使突变体能够正常生长发育。

表2 突变体与突变亲本叶绿素荧光动力学参数 μmol·m-2·s-1
2.4 突变体与突变亲本叶绿体超微结构比较
透射电镜观察结果如图3所示,突变体9388-1叶绿体内部基粒片层垛叠数有所减少,基粒排列不整齐,呈线条状;基粒片层间距离大,结构扭曲变形,排列疏松,双层膜结构不清晰,内含物混浊,淀粉粒少;突变亲本白莎蜜1号基粒片层结构有规律地紧密排列,结构完整,淀粉粒多。说明突变体的叶绿体结构比突变亲本简单,叶绿体结构发育不完整,光合产物的积累相对较少。
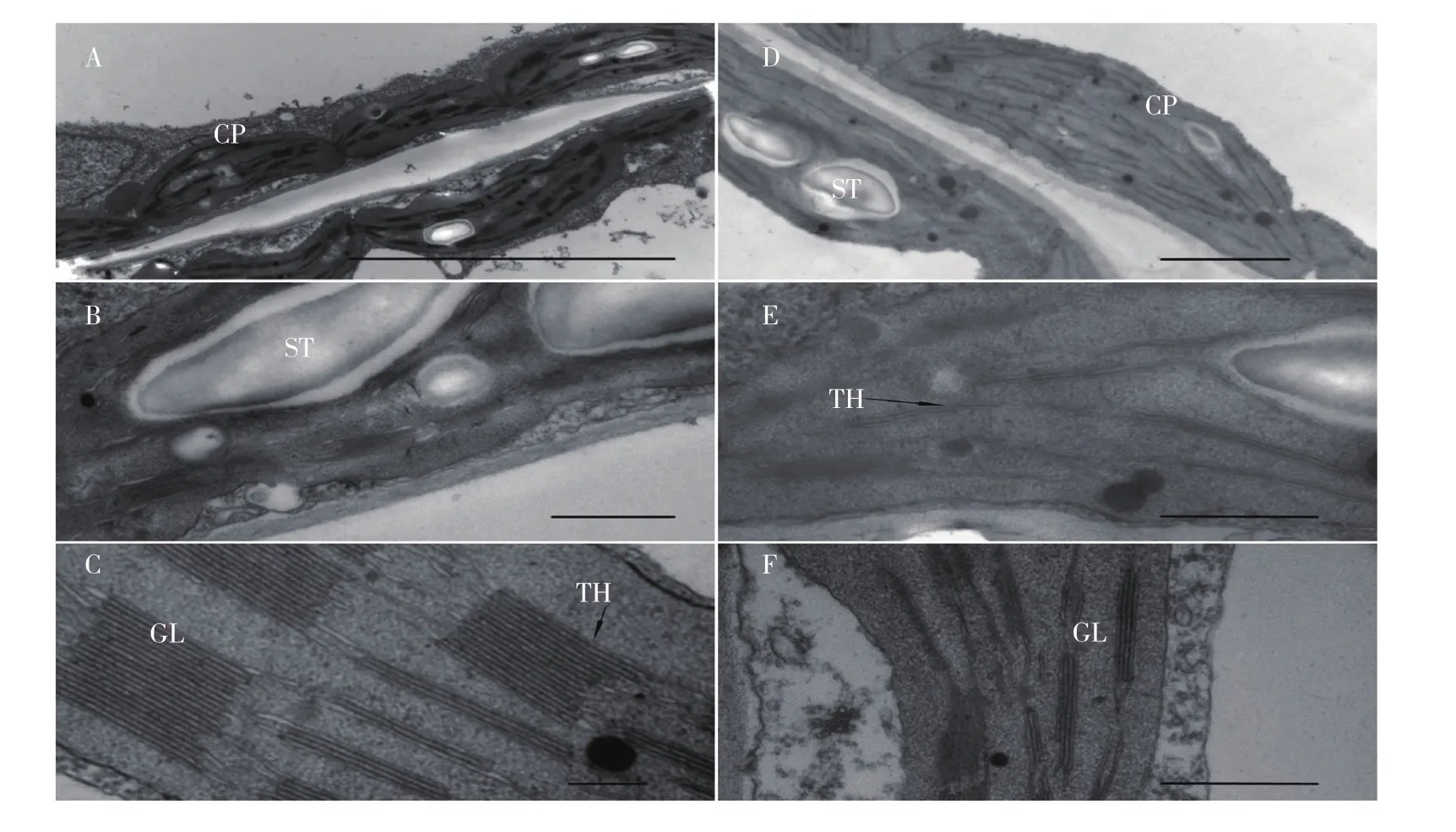
图3 突变体与突变亲本叶绿体超微结构比较
3 结论与讨论
近年来,国内外研究者已经在多种作物中发现叶色突变体,其利用价值也越来越受到关注。叶色变异的性状,在苗期可以作为鉴定杂交种纯度的有效手段(Zhao et al.,2000)。本试验选用的薄皮甜瓜叶色黄化突变体为自然突变体,其叶色黄化性状在子叶期就开始表达,利用这一标记性状能够最有效地简化良种繁育进程,同时也可为甜瓜育种提供优良的种质资源。
叶色变异常常伴随着一系列复杂的代谢过程。在一定条件下,叶绿素合成代谢、叶绿体发育等都是多层次、多元化的反应。叶色变异与叶绿素含量和叶绿体结构有直接关系(赵云 等,2003)。叶绿素的生物合成途径受阻,会影响叶绿素的合成,从而影响叶绿体的正常发育。研究发现,几乎所有的光合色素都包埋在类囊体膜中,叶绿体内部结构发育缺陷,影响叶绿素及其他光合色素的稳定性,最终改变叶绿体各种色素的含量与比例,最终导致叶色变异(Chen et al.,2005)。不同类型的叶色突变体,光合色素的组成和含量、叶绿素生物合成受阻部位存在差异,叶绿素荧光参数和叶绿体内部结构发育状况也各不相同。因此,有必要对甜瓜叶色突变体光合系统的超微结构、叶绿素代谢变化等叶片内部的生理生化指标进行比较分析。
本试验结果表明,突变体9388-1与白莎蜜1号的光合色素差异明显,且为总叶绿素缺失型突变体。在叶绿素生物合成过程中,合成途径阻碍发生在胆色素原(PBG)与尿卟啉原Ⅲ(UrogenⅢ)之间,受阻部位与崔海瑞等(2001)对水稻叶色突变体生物合成特性研究结果不一致。本试验还发现突变体叶绿素的合成受阻、叶绿体内部结构发育不良,使叶绿素合成失去了可依托的物质基础,使叶绿素的合成陷于不正常的停滞状态,改变了光合色素各成分的含量及比例,最终导致叶色发生变异。在一定范围内随叶绿素含量的减少,突变体9388-1光化学效率有所提高,且能及时地以热能的形式耗散光能,对光合机构起一定的保护作用,维持正常的光合作用和一系列的生理代谢过程,这与Xu等(1994)对大豆叶绿素缺失突变体叶绿素荧光参数的分析结果一致。
随着甜瓜全基因组测序的完成,甜瓜叶色突变体的研究已经开始进入新的模式。本试验结果从生理水平上揭示了甜瓜突变体叶色黄化的机理,为今后开展分子生物学方面的研究奠定了基础。植物叶色发生突变的机制一般是受内在和外界环境因素的影响,导致基因发生突变。因此,叶色黄化的内外在因素与突变基因之间的关系还有待于进一步深入研究。
崔海瑞,夏英武,高明尉.2001.温度对水稻突变体W1 叶色及叶绿素生物合成的影响.核农学报,15(5):269-273.
李合生.2000.植物生理生化实验原理和技术.北京:高等教育出版社:56-58.
苗晗,顾兴芳,张圣平,方智远,张振贤.2010.两个黄瓜(Cucumis sativusL.)叶色突变体的比较分析研究.中国蔬菜,(22):16-20.
徐培洲,李云,袁澍,张红宇,彭海,林宏辉,汪旭东,吴先军.2006.叶绿素缺乏水稻突变体中光系统蛋白和叶绿素合成特性的研究.中国农业科学,39(7):1299-1305.
赵云,王茂林,李江,张义正.2003.幼叶黄化油菜(Brassica napusL.)突变体Cr3529叶绿体超微结构观察.四川大学学报:自然科学版,40(5):974-977.
Agrawal G K,Yamazaki M,Kobayashi M,Hirochika R,Miyao A,Hirochika H.2001.Screening of the rice viviparous mutants generated by endogenous retrotransposonTos17insertion.Tagging of a zeaxanthin epoxidase gene and a novelOsTATCGene.Plant Physiol,125:1248-1257.
Chen G,Bi Y R,Li N.2005.EGY1 encodes a membrane-associated and ATP-dependent metalloprotease that is required for chloroplast development.The Plant Journal,41(3):364-375.
Fambrini M,Castagna A,Vecchia F D.2004.Characterization of a pigment-deficient mutant of sunflower (Helianthus annuusL.)with abnormal chloroplast biogenesis,reduced PS Ⅱ activity and low endogenous level of abscisic acid.Plant Sci,167:79-89.
Jarvis P,Chen L J,Li H,Peto C A,Fankhauser C,Chory J.1998.AnArabidopsismutant defective in the plastid general protein import apparatus.Science,282:100-103.
Koval S F,Baiborodin S I,Fedotova V D.2001.Interlocus interaction of chlorine mutant genescn-A1andcn-D1in near-isogenic lines of,spring wheat Novo sibirsksya 67(T. asetivum).Wheat Information Service,92:1-4.
Singh U P,Prithiviraj B,Sarama B K.2000.Development ofErysiphe pisi(powder mildew) on normal and albino mutants of pea(Pisum sativumL.).J Phytopathol,148 (11-12):591-595.
Whitaker T W.1952.Genetic and chlorophyll studies of a yellow-green mutant in muskmelon.Plant Physiol,27:263-268.
Wu Z M,Zhang X,He B,Diao L P,Sheng S L,Wang J L,Guo X P,Su N,Wang L F,Jiang L,Wang C M,Zhai H Q,Wan J M.2007.A chlorophyll-deficient rice mutant with impaired chlorophyllide esterification in chlorophyll biosynthesis.Plant Physiol,145:29-40.
Xu D Q,Chen X M,Zhang L X,Wang R F,Hesketh J D.1994.Leaf photosynthesis and chlorophyll-deficient soybean mutant.Photosynthetica,29 (1):103-112.
Yaronskaya E,Ziemann V,Water G,Averina N,börner T,Grimm B.2003.Metabolic control of the tetrapyrrole biosynthetic pathway for porphyrin distribution in the barely mutant albostrians.Plant J,35(4):512-522.
Yukari A,Toshiya H.2004.Maize mutant lacking chloroplastFtsYexhibit pleiotropic defects in biogenesis of thylakoid membranes.The Plant Cell,16:201-204.
Zhao Y,Wang M L,Zhang Y Z,Du L F,Pan T.2000.A chlorophyll-reduced seedling mutant in oilseed rape,Brassica napus,for utilization in a F1hybrid production.Plant Breeding,119(2):131-135.
Zhao Y,Du L F,Yang S H,Li S C,Zhang Y Z.2001.Chloroplast composition and structure differences in chlorophyll-reduced mutant of oilseed rape seedlings.Acta Boanicat Sinica,43 (8):877-880.
