小菜蛾类钙粘蛋白片段的原核融合表达载体构建及其条件优化
2013-09-03郑晓旭杨峰山张友军
郑晓旭 杨峰山 朱 勋 张友军*
(1黑龙江大学生命科学学院,微生物黑龙江省高校重点实验室,黑龙江哈尔滨150080 ;2 中国农业科学院蔬菜花卉研究所,北京1 00081)
小菜蛾(Plutella xylostella)属鳞翅目菜蛾科,是重要的植食性害虫。该虫对多种作物尤其是十字花科蔬菜构成严重威胁,严重为害时能造成作物90%以上的损失,据全球统计每年用于防治小菜蛾的费用达40亿~50亿美元(Talekar&Shelton,1993;Furlong et al.,2012)。苏云金芽孢杆菌(Bacillus thuringiensis,Bt)可产生多种具有杀虫活性的晶体蛋白(Insecticidal crystal proteins,ICPs),对鳞翅目、双翅目、鞘翅目等害虫具有较好的杀虫活性,这些蛋白作为新兴的农业害虫杀虫剂被广泛地喷洒或通过转基因技术转入作物中作为抗虫作物在世界各地广泛种植,导致许多地区田间小菜蛾种群产生抗药性(Schnepf et al.,1998;Fernández et al.,2008;Tabashnik et al.,2011;Vachon et al.,2012)。已经逐渐发现有多种害虫(草地贪夜蛾Spodoptera frugiperda、玉米茎夜蛾Busseola fusca、谷实夜蛾Helicoverpa zea)对Bt作物产生抗性(Tabashnik et al.,2009),因此如何解决害虫的抗性问题迫在眉睫。
钙粘蛋白是钙离子依赖的跨膜糖蛋白家族的重要成员,普遍存在于脊椎无脊椎动物体内,在多细胞有机体中起着保持细胞完整性的作用,在细胞间起连接作用。昆虫类钙粘蛋白(Cadherin-like protein)结构与钙粘蛋白(cadherin)很相似,从N端至C端依次是信号肽、由9~12个重复子(cadherin repeats,CR)组成的重复区、近膜区(membrane proximal extracellular domain,MPED)、跨膜区( transmembrane domain )和胞质区(intracell ular domain)(Xie et al.,2005;Hua et al.,2008)5个功能区域。Vadlamudi等(1993)在烟草天蛾Manduca sexta的刷状缘膜囊(BBMV)上首先发现类钙粘蛋白是Bt CrylA类蛋白(Bt菌产生的杀虫晶体蛋白)的一种受体蛋白。根据孔隙形成假说,Bt Cry1A毒素首先形成130 kDa大小的前毒素,被昆虫吞食进入中肠内,在中肠液的碱性条件下发生溶解作用,形成60 kDa的活性毒素单体,毒素单体与位于昆虫中肠上皮细胞的类钙粘蛋白表现出高的亲活性进而水解掉活性毒素的α-1螺旋和N-末端形成促进孔隙形成的寡聚物,进一步与氨肽酶、碱性磷酸酶等二级受体结合导致中肠孔隙形成,细胞裂解,最终导致昆虫死亡(Pardo-López et al.,2006;Soberón et al.,2007;Heckel,2012)。昆虫类钙粘蛋白靠近近膜区相邻的重复区域是与Bt Cry1A类杀虫蛋白结合并最终形成孔洞的关键区域,有时具有多个结合位点。Gómez等(2002)率先利用噬菌体显示技术筛选得到了烟草天蛾类钙粘蛋白(Bt-R1)及家蚕类钙粘蛋白(Bt-R175)与Cry1A类杀虫蛋白相结合的区域,两者的氨基酸序列分别为869HITDTNNK876及1296LDETTN1301。进一步研究表明烟草天蛾类钙粘蛋白Bt-R1a至少有3个与Cry1A类杀虫蛋白相互作用的部位(Gómez et al.,2002,2003,2006),其中CR12是与杀虫蛋白相结合的关键区域,而家蚕类钙粘蛋白Bt-R175受体与杀虫蛋白结合的关键区域则是CR9(Hua et al.,2004)。Chen等(2007)报道了烟草天蛾类钙粘蛋白Bt-R1中含CR12-MPED区的多肽,可在大肠杆菌中表达并作为CrylA杀虫蛋白的增效剂,用于防治鳞翅目幼虫。随后也有报道烟草天蛾类钙粘蛋白的CR7、CR11也是Cry1A的结合位点,CR7与 CR11片段也能提高Cry1Ac与Cry1Ab杀虫蛋白对烟草天蛾 幼虫的毒性,但是其增效作用弱于CR12片段。除此之外,CR12片段不仅可以增强Cry1Ab杀虫蛋白对烟草天蛾幼虫的毒杀活性,还对其他鳞翅目幼虫也有增效作用(Pacheco et al.,2 009)。随后冈比亚按蚊Anopheles gambiae(Hua et al.,2008)、玉米根叶甲Diabrotica virgifera(Park et al.,2009)、棉铃虫(Peng et al.,2010)、甜菜夜蛾(Lu et al.,2012)等也相继被报道包含杀虫蛋白结合区域的类钙粘蛋白片段,能增强Cry1类杀虫蛋白对其幼虫的杀虫活性。这些研究结果充分说明类钙粘蛋白片段在害虫防治上具有潜在的应用价值。
小菜蛾是一种世界性的农业害虫,在田间产生抗性多年并且极难治理。如何能够利用类钙粘蛋白片段防治小菜蛾是一种新的思路和途径。因此能够诱导得到大量高效的小菜蛾类钙粘蛋白连接区域片段蛋白是最首要的任务。本试验通过对小菜蛾钙粘蛋白序列的分析,得到了小菜蛾类钙粘蛋白靠近近膜区相邻的重复区序列片段PxCad,构建了大肠杆菌原核表达载体,经过温度、时间、IPTG浓度,以及可溶性分析方面的条件诱导优化,最终获得了大量的类钙粘蛋白片段融合蛋白,为进一步的增效研究奠定了基础。
1 材料与方法
1.1 供试材料
小菜蛾敏感种群(DBM1Ac-S):2003年由美国康奈尔大学赵建周教授提供。在中国农业科学院蔬菜花卉研究所养虫室内用无虫甘蓝苗进行继代饲养,期间未接触任何杀虫剂。
表达载体pET28a 由蔬菜有害生物控制与优质栽培北京市重点实验室保存,克隆载体pEASY-T5 Zero Cloning Kit和大肠杆菌E.coliBL21(DE3)购自全式金公司,Total RNA提取试剂、mRNA纯化试剂盒、1st St rand cDNA、Synthesis Kit、DNA Marker、质粒 DNA 提取纯化试剂盒、DNA回收试剂盒购自TIANGEN公司,TaqDNA 聚合酶购自TaKaRa公司,限制性内切酶BamHI、EcoRI,及T4 DNA 连接酶均购自NEB公司,蛋白质分子量标准购自Thermo公司,引物由北京擎科新业生物技术有限公司提供。
引物设计:根据 GenBank公布的序列(Accession No.EF541176.1) 及蛋白结构分析,选取靠近近膜区相邻的重复序列设计引物,下划线部分为引入的酶切位点。E-P.xy-cad-F:CGGGATCCCTCACGGAGGCTTTCCA(BamHI酶切位点);E-P.xy-cad-R:CGGAATTCAGAGGTGTCCGCTAC CAT(EcoRI酶切位点)。
1.2 试验方法
1.2.1PxCad基因的扩增和克 隆载体的构建 取4龄小菜蛾中肠,利用Trizol试剂提取总RNA;通过逆转录试剂盒将总RNA反转录成cDNA,再以cDNA为模板,通过PCR扩增出目的基因。PCR 的反应条件为:94 ℃ 3 min;94 ℃ 45 s,56 ℃ 45 s,72 ℃ 1 min,32 个循环;72 ℃ 10 min。利用克隆载体pEASY-T5 Zero Cloning Kit试剂盒构建PxCad-T5克隆载体。
1.2.2 原核表达载体的构建 用BamHI和EcoRI双酶切上述的PxCad-T5克隆载体和 pET28a原核表达载体,再分别切胶回收纯化。载体和融合片段(PxCad片段)按1∶3比例混合后加入T4 DNA连接酶,16 ℃过夜连接后转化大肠杆菌E.coliBL21(DE3),挑取阳性克隆抽提质粒。并将双酶切及测序鉴定正确的重组质粒,命名为PxCad-pET28a。
1.2.3 PxCad-pET28a/E.coliBL21(DE3)菌生长曲线测定 将种子液(构建好的菌株接种到2 mL的LB培养液中过夜培养好的菌液)按1%的比例接种于200 mL LB(Kna+),37 ℃,180 r·min-1,振摇培养,并开始计时。每小时从三角瓶内取2 mL 菌悬液,测定其吸光度OD600值,共测定10 h。以培养时间为横坐标,吸光度OD600值为纵坐标,作生长曲线图。
1.2.4 融合蛋白的诱导表达 挑取阳性单菌落接种到含卡那霉素的LB液体培养基中,于37 ℃,180 r·min-1,振摇培养过夜。次日,按照1%的比例接入同样的培养基中,振荡培养至OD600值约为0.6时,分别对融合蛋白表达的最适IPTG浓度、最佳时间和最佳温度进行条件诱导,并进行不同温度下融合蛋白可溶性分析。
融合蛋白表达最适IPTG浓度的诱导:在提前准备好的OD600值为0.6的菌液中分别加入0.05、0.1、0.2、0.4、0.6、0.8 mmol·L-1和 1.0 mmol·L-1IPTG 在 30℃、180 r·min-1条件下培养 24 h,以空载体作为对照,诱导24 h后提取蛋白经SDS-PAGE电泳选取最佳的IPTG诱导浓度。
融合蛋白表达最 佳时间的诱导:利用筛选的蛋白表达最适IPTG浓度,在30 ℃,180 r·min-1条件下培养,分别在2、4、8、12、24、36、48 h取样,提取蛋白经SDS-PAGE 电泳选取最佳的诱导时间。
融合蛋白表达最佳温度的诱导:利用筛选的最适IPTG浓度和最佳诱导时间,分别在16、25、30、37 ℃不同温度下180 r·min-1振摇培养,提取融合蛋白经SDS-PAGE 电泳选取最佳的诱导温度。
不同温度下融合蛋白的可溶性分析:将上述4个不同温度诱导的菌液离心收集菌体,超声破碎后分为全菌、上清、沉淀进行SDS-PAGE电泳,检测不同温度下融合蛋白的表达及可溶性情况。
2 结果与分析
2.1 小菜蛾钙粘蛋白基因重组载体的构建
提取小菜蛾4龄幼虫中肠RNA,并反转录为cDNA,作为实验用模板。根据筛选得到的靠近近膜区相邻的重复序列的特异性引物,扩展得到小菜蛾钙粘蛋白基因目的片段。从凝胶电泳(图1)可见,用特异性引物PCR扩增出432 bp大小的目的条带、pET28a单酶切5 369 bp大小的片段、重组质粒单酶切5 801 bp大小的片段、重组质粒经BamHI、EcoRI双酶切切出pET28a和目的片段两个大小相符的片段,可以看出抽提的质粒包含有正确的酶切位点及预期插入片段,菌液测序结果表明插入序列完全与预期符合,重组质粒构建成功。
2.2 生长曲线
生长曲线测定结果表明,PxCad-pET28a/E.coliBL21(DE3)工程菌在接种1.5 h后进入对数生长期(图2),约2.5 h左右,OD600达0.6,即为对数生长期中期,菌株生长速度快,呈指数级生长,新陈代谢活跃,蛋白表达水平高,所以可选取此时加入IPTG诱导表达融合蛋白。
2.3 重组蛋白的诱导表达
在30 ℃,180 r·min-1条件下对重组菌进行IPTG不同浓度诱导表达24 h,同时以空载体作为对照。提取蛋白经SDS-PAGE电泳(图3)可以看出,重组菌体与空载体对照菌和未诱导菌相比,重组菌出现预期靶标大小相符的目的蛋白条带(16 kDa),并且在IPTG浓度为0.1 mmol·L-1时蛋白的表达量最高,然后随着IPTG浓度的增高表达量逐渐降低,并且在1.0 mmol·L-1时表达量达到最低,所以最佳IPTG诱导终浓度为0.1 mmol·L-1。
选取最适IPTG浓度0.1 mmol·L-1对重组菌在30 ℃、180 r·min-1条件下进行不同时间的诱导表达,提取蛋白经SDS-PAGE电泳(图4)可以看出,重组菌体与空载体对照菌和未诱导菌相比,重组菌出现大小相符的目的蛋白条带(16 kDa),随着诱导时间的增加,目的蛋白的表达量逐渐增多,并且在36 h时表达量达到最高,在48 h时表达量又略有下降,因此36 h为最佳诱导时间。
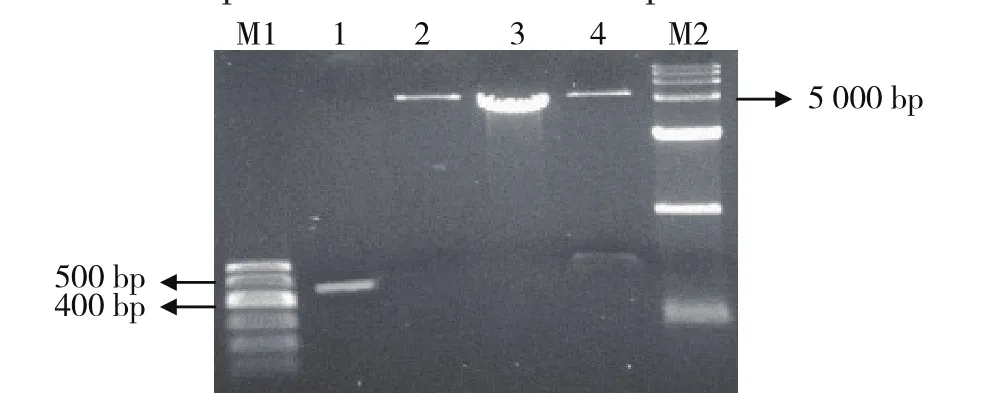
图1 小菜蛾PxCad基因重组载体的构建
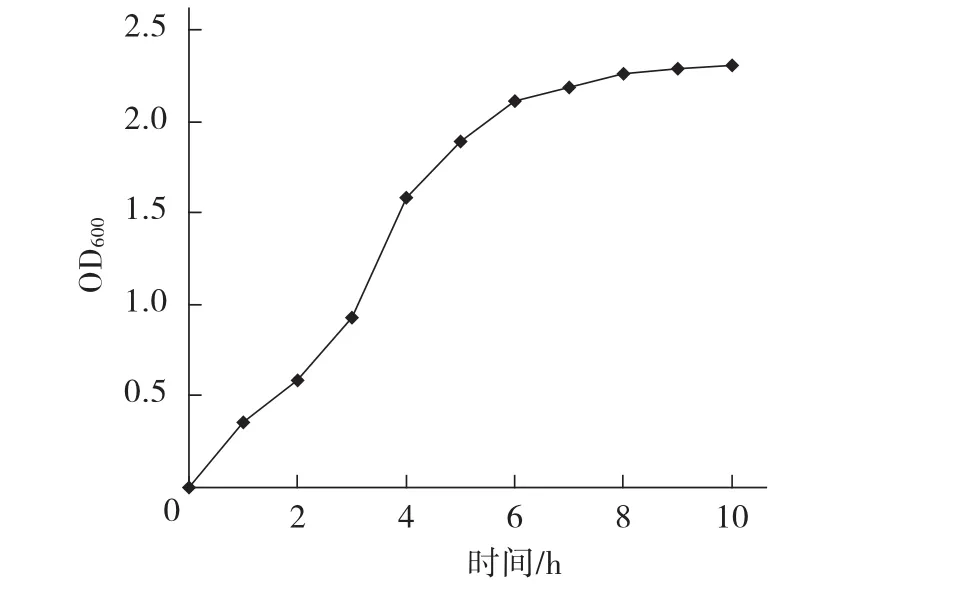
图2 融合蛋白PxCad-pET28a/E.coli BL21(DE3)工程菌株的生长曲线
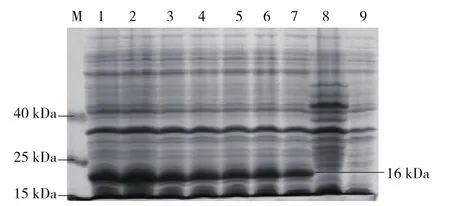
图3 不同IPTG 浓度对PxCad-pET28a/E.coli BL21(DE3) 表达量的影响
分别选取最适的IPTG浓度(0.1 mmol·L-1)和最佳诱导时间(36 h),在16、25、30、37℃等不同温度下180 r·min-1振摇培养。提取蛋白经SDS-PAGE电泳(图5)可以看出,目的蛋白(16 kDa)在16 ℃表达量很低,在25~37 ℃表达量依次减少,在25 ℃表达量最高,因此25 ℃为最高表达量的诱导温度。
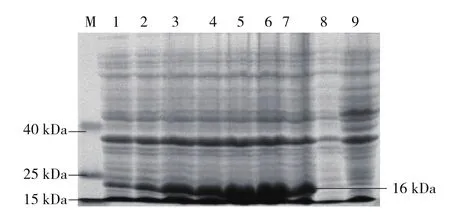
图4 不同诱导时间对PxCad-pET28a/E.coli BL21(DE3)表达量的影响
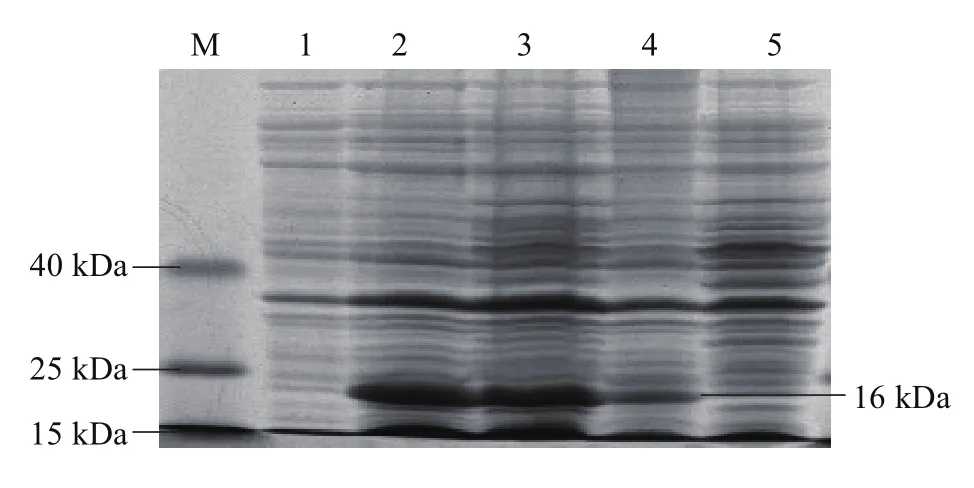
图5 不同诱导温度对PxCad-pET28a/E.coli BL21(DE3)表达量的影响
收集以上不同温度菌体经超声波破碎对不同温度表达的蛋白进行可溶性分析,从SDSPAGE电泳结果(图6)可以看出,16、25、30、37 ℃下表达的蛋白均以包涵体的形式存在,由此可见温度对蛋白的可溶性并没有太大的影响。
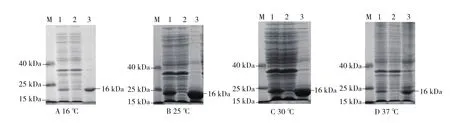
图6 PxCad-pET28a/ E.coli BL21(DE3)不同温度表达产物可溶性分析
3 结论与讨论
小菜蛾类钙粘蛋白基因全长5 380 bp,本试验克隆小菜蛾类钙粘蛋白靠近近膜区相邻的重复区序列片段基因全长432 bp,获得与理论值相符的16 kDa的融合蛋白。最佳诱导温度25 ℃,最佳IPTG诱导终浓度0.1 mmol·L-1,最佳诱导时间为36 h,蛋白在16、25、30、37 ℃条件下以包涵体的形式存在。
由于昆虫中不同种类之间类钙粘蛋白具有高度同源性(Bel & Escribe,2006)的特点,小菜蛾与其他鳞翅目昆虫的类钙粘蛋白一样,包含5个基本结构,具有昆虫钙粘蛋白典型的结构特征。这种蛋白结构上的保守性说明鳞翅目昆虫与Bt相关的类钙粘蛋白很可能也享有进化上的保守功能。已有的结果表明,昆虫类钙粘蛋白的钙粘蛋白重复区域为该蛋白与杀虫蛋白结合的功能区域,但不同的昆虫结合区域有所差异,多数为靠近近膜区的重复区域。如棉铃虫、棉红铃虫靠近近膜区的钙粘蛋白重复区域CR10-11是Cry1Ac杀虫蛋白的结合区域,而家蚕Bt-R175受体与杀虫蛋白结合的关键区域则是CR9(Hua et al.,2004;Fabrick &Tabashnik,2007)。烟草天蛾 Bt-R1a 受体中CR7、CR11与CR12均为杀虫蛋白的结合区域,但CR12才是与杀虫蛋白相结合的关键区域(Coates et al.,2005)。由于鳞翅目昆虫类钙粘蛋白的高度保守性,小菜蛾类钙粘蛋白与Cry类杀虫蛋白的结合区域很可能也在靠近近膜区的钙粘蛋白重复区域,这种功能上的保守性有利于阐明Bt Cry类杀虫蛋白对小菜蛾的分子机理以及鳞翅目小菜蛾对Bt Cry类杀虫蛋白产生抗性的机理。
有文献报道棉铃虫HaCad片段包含杀虫蛋白结合区域,所表达的包涵体蛋白能增强Cry1Ac杀虫蛋白对棉铃虫幼虫的杀虫活性(Peng et al.,2009)。然而,也有报道称可溶性的棉铃虫CR10-11片段降低了Cry1Ac的毒性(Liu et al.,2009)。包涵体类钙粘蛋白片段与可溶性片段对Cry类杀虫蛋白的作用不同,前者对杀虫蛋白有增效作用,而后者则表现为减效。这说明昆虫类钙粘蛋白对Bt杀虫蛋白的增效作用,和昆虫与杀虫蛋白种类、类钙粘蛋白与杀虫蛋白的质量比以及表达多肽片段的形式密切相关。因此,表达时控制融合蛋白包涵体的含量尤其重要。
原核表达中外源蛋白表达量的多少受到多种因素的影响,其中与温度、诱导剂诱导时间和诱导浓度的关系密切相关。温度过高或过低表达量都有所降低,Fass等(1991)研究表明IPTG的剂量有一定范围,浓度过低影响目的蛋白的表达,浓度过高则抑制细菌的生长;诱导时间也会对蛋白表达量有一定影响,诱导时间太短,菌体量少,目的蛋白量也少,诱导时间太长,菌体老化,酶体系统活性减弱,代谢速度减慢,转录翻译迟钝,不利于目的蛋白的表达。不同的基因由于其固有的特殊性,最优的表达条件也不尽相同,本试验经过条件的诱导优化,获取了大量的包涵体融合蛋白,对于明确其与Bt蛋白的相互作用机制,以及生产上利用类钙粘蛋白对Bt的增效作用的应用研究奠定了可行性的基础。
Bel Y,Eascribe B.2006.Common genomic structure for the Lepidoptera cadherin-like genes.Gene,381:71-80.
Chen J,Hua G,Jurat-Fuentes J L,Abdullah M A,Adang M J.2007.Synergism ofBacillus thuringiensistoxins by a fragment of a toxin-binding cadherin.PNAS,104(35):13901-13906.
Coates B S,Sumerford D V,Hellmich R L,Lewis L C.2005.Sequence variation in the cadherin gene ofOstrinia nubilalis:a tool for field monitoring.Insect Biochemistry and Molecular Biology,35:129-139.
Fabrick J A,Tabashnik B E.2007.Binding ofBacillus thuringiensistoxin Cry1Ac to multiple sites of cadherin in pink bollworm.Insect Biochemistry and Molecular Biology,37:97-106.
Fass R,van de Walle M,Shiloach A,Joslyn A,Kaufman J,Shiloach J.1991.Use of high density cultures ofEscherichia coliforhigh level production of recombinantPseudomonas aeruginosaexotoxin A.Appl Microbiol Biotechno,36(1):65-91.
Fernández L E,Gómez I,Pacheco S,Arenas I,Gilla S S,Bravo A,Soberón M.2008.Employing phage display to study the mode of action ofBacillus thuringiensisCry toxins.Peptides,29:324-329.
Furlong M J,Wright D J,Dosdall L M.2012.Diamondback moth ecology and management:problems,progress and prospects.Annual Review of Entomology,58:517-541.
Gómez I,Miranda-Rios J,Rudiño-Pinñera E,Oltean D I,Gill S S,Bravo A,Soberón M.2002.Hydropathic complementarity determines interaction of epitope869HITDTNNK876inManduca sextaBt-R1 receptor with loop2 of domain II ofBacillus thuringiensisCry1A toxins.The Journal of Biological Chemistry,277(33):30137-30143.
Gómez I,Dean D H,Bravo A,Soberón M.2003.Molecular basis forBacillus thuringiensisCry1Ab toxin specificity:two structural determinants in theManduca sextaBt-R1 receptor interact with loops alpha-8 and 2 in domain II of Cy1Ab toxin.Biochemistry,42(35):10482-10489.
Gómez I,Arenas I,Benitez I,Miranda-Rìos J,Becerril B,Grande R,Almagro G C,Bravo A,Soberón M.2006.Specific epitopes of domains II and III ofBacillus thuringiensisCry1Ab toxin involved in the sequential interaction with cadherin and aminopeptidase-N receptors inManduca sexta.The Journal of Biological Chemistry,281(45):34032-34039.
Heckel D G.2012.Learning the ABCs of Bt:ABC transporters and insect resistance toBacillus thuringiensisprovide clues to a crucial step in toxin mode of action.Pesticide Biochemistry and Physiology,104:103-110.
Hua G,Jurat-Fuentes J L,Adang M J.2004.Bt-R1a extracellular cadherin repeat 12 mediatesBacillus thuringiensisCry1Ab binding and cytotoxicity.The Journal of Biological Chemistry,279(27):28051-28056.
Hua G,Zhang R,Abdullah M A F,Adang M J.2008.Anopheles gambiae cadherin AgCad1 binds the Cry4Ba toxin ofBacillus thuringiensisisraelensis and a fragment of AgCad1 synergizes toxicity.Biochemistry,47(18):5101-5110.
Liu C K,Wu K M,Wu Y D,Gao Y L,Ning C M,Oppert B.2009.Reduction ofBacillus thuringiensisCry1Ac toxicity againstHelicoverpa armigeraby a soluble toxin-binding cadherin fragment.Journal of Insect Physiology,55:686-693.
Lu Q,Zhang Y J,Cao G C,Zhang L L,Liang G M,Lu Y H,Wu K M,Gao X W,Guo Y Y.2012.A fragment of cCadherin-like protein enhancesBacillus thuringiensisCry1B and Cry1C toxicity toSpodoptera exigua(Lepidoptera:Noctuidae).Journal of Integrative Agriculture,11(4):628-638.
Pacheco S,Gómez I,Gill S S,Bravo A,Soberón M.2009.Enhancement of insecticidal activity ofBacillus thuringiensisCry1A toxins by fragments of a toxin-binding cadherin correlates with oligomer formation.Peptides,30(3):533-588.
Pardo-López L,Gómez I,Rausell C,Sánchez J,Soberón M,Bravo A.2006.Structural changes of the Cry1Ac oligomeric prepore fromBacillus thuringiensisinduced by N-acetylgalactosamine facilitates toxin membrane insertion.Biochemistry,45:10329-10336.
Park Y,Hua G,Abdullah M A F,Rahman K,Adang M J.2009.Cadherin fragments from anopheles gambiae synergizeBacillus thuringiensisCry4Ba’s toxicity againstAedes aegyptiLarvae.Applied and Environmental Microbiology,75(22):7280-7282.
Peng D H,Xu X H,Ye W X,Yu Z N,Sun M.2009.Helicoverpa armigeracadherin fragment enhances Cry1Ac insecticidal activity by facilitating toxin-oligomer formation.Applied Microbiology and Biotechnology,85:1033-1040.
Peng D H,Xu X H,Ruan L F,Yu Z N,Sun M.2010.Enhancing Cry1Ac toxicity by expression of theHelicoverpa armigeracadherin fragment inBacillus thuringiensis.Research in Microbiology,161:383-389.
Schnepf E,Crickmore N,van Rie J,Lereclus D,Baum J,Feitelson J,Zeigler D R,Dean D H.1998.Bacillus thuringiensisand its pesticidal crystal proteins.J Microbiol.Mol Rev,62:775-806.
Soberón M,Pardo-López L,López I,Gómez I,Tabashnik B,Bravo A.2007.Engineering modified Bt toxins to counter insect resistance.Science,318:1640-1642.
Tabashnik B E,van Rensburg J B J,Carrière Y.2009.Field-evolved insect resistance to Bt crops:defnition,theory,and data.J Econ Entomol,102:2011-2025.
Tabashnik B E,Huang F,Ghimire M N,Leonard B R,Siegfried B D,Rangasamy M,Yang Y,Wu Y,Gahan L J,Heckel D G,Bravo A,Soberón M.2011.Efficacy of genetically modified Bt toxins against insects with different genetic mechanisms of resistance.Naturl Biotechology,29(12):1128-1131.
Talekar N S,Shelton A M.1993.Biology,ecology and management of the diamondback moth.J Annu Rev Entomol,38:275-301.
Vachon V,Laprade R,Schwartz J.2012.Current models of the mode of action ofBacillus thuringiensisinsecticidal crystal proteins:a critical review.Journal of Invertebrate Pathology,111:1-12.
Vadlamudi R K,Ji T H,Bulla L A.1993.A specific binding protein fromManduca sextafor the insecticidal toxin ofBacillus thuringiensissubsp.Bediner.The Journal of Biological Chemistry,268(17):12334-12340.
Xie R,Zhuang M,Ross L S,Gómez I,Oltean D I,Bravo A,Soberón M,Gill S S.2005.Single amino acid mutations in the cadherin receptor fromHeliothis virescensaffect its toxin binding ability to Cry1A toxins.J Biol Chem,280:8416-8425.
