4种诱抗剂诱导番茄抗晚疫病的初步效果
2013-09-03李少波石延霞刘君丽谢学文李宝聚
李少波 石延霞 刘君丽 谢学文 李宝聚
(1沈阳农业大学,辽宁沈阳 110866;2中国农业科 学院蔬菜花卉研究所,北京 100081)
番茄晚疫病又称番茄疫病、黑杆病,是由卵菌门卵菌纲霜霉目腐霉科疫霉属的致病疫霉〔Phytophthora infestans(Mont)de Bary〕侵染所致,在 北京、山西、云南、贵州、重庆、山东、陕西、河南、河北等省市均普遍发生。番茄晚疫病是保护地番茄的重要病害,一旦发生就会迅速蔓延,是一种毁灭性的病害。
生产中防治番茄晚疫病的方法主要为化学农药。目前常用的杀菌剂主要有75%百菌清可湿性粉剂(WP)、50%甲霜灵WP、72%霜脲·锰锌WP、68%精甲霜·锰锌WP、10%氰霜唑悬浮剂(SE)和70%丙森锌WP(石延霞 等,2007),但长期单一使用同类杀菌剂,使得病原菌对一些常用杀菌剂表现出抗药性(沈国强 等,2006),且化学杀菌剂常用于病害发生后,不利于控制病害的大规模爆发,易造成田间减产甚至绝收。近几年迅速发展的植物诱抗剂对病害具有预防作用,通过加强植物自身免疫达到对病原菌的抗性作用。本试验选用的4种诱抗剂在国内或者国外均有登记,其作用对象各不相同,本试验通过叶面喷雾施药,研究4种诱抗剂对番茄晚疫病的抗病反应,为其在田间番茄晚疫病的防治应用中提供相关参考。
1 材料与方法
1.1 试验材料
供试药剂:1%苯并噻二唑水乳剂(EW),北京广源益农化学有限责任公司生产。3%氨基寡糖素水剂(AS),购自大连奥德植保药业有限公司。2%几丁聚糖AS,购自山东科大创业生物有限公司。2%香菇多糖AS,购自黑龙江省大地丰农业科技开发有限公司。
供试植株:番茄品种为中杂105。
供试病原菌:番茄晚疫病菌P. infestans分离自番茄晚疫病发病植株,经致病性试验鉴定为强致病菌株,菌株编号为FQWY,由中国农业科学院蔬菜花卉研究所分离鉴定保存。
1.2 4种诱抗剂对番茄晚疫病菌的抑菌活性
采用平皿法测定4种诱抗剂对番茄晚疫病菌的抑制活性,将4种诱抗剂分别稀释配制成3种不同浓度(表1),对照杀菌剂为50%烯酰吗啉WP。在无菌条件下,将预先融化的燕麦培养基(35 g燕麦,20 g琼脂,1 000 mL H2O)定量加入无菌锥形瓶中,定量吸取药液,分别加入锥形瓶后摇匀,等量倒入培养皿中,制成相应浓度的含药平板。在无菌条件下用灭菌打孔器取菌饼,将菌饼接种于含药平板中央,菌丝面朝上,置于光照培养箱中培养,培养条件:温度28 ℃,光照12 h·d-1,光照强度10 000 lx。每个处理4次重复。3 d后调查病原菌菌丝生长情况,用卡尺测量菌落直径,用十字交叉法垂直测量直径各一次,取其平均值。
1.3 4种诱抗剂对苗期番茄晚疫病的诱导抗性
将4种诱抗剂分别配制成3种不同浓度,对照杀菌剂50%烯酰吗啉WP稀释成1 000倍液,选择3~4片复叶期的番茄幼苗,将4种诱抗剂均匀喷施于番茄叶面,间隔5 d喷施1次,连续喷雾诱导3次,第3次诱导后24 h叶面喷雾接种晚疫病病原菌孢子悬浮液(1×106个·mL-1),每株接种孢子悬浮液3 mL。对照杀菌剂50%烯酰吗啉WP采用叶面喷雾方式,施药时间和次数同诱抗剂,另设只接种不施药的清水对照处理,及不接种不施药的空白对照。接种后将番茄放入保湿箱中保湿培养,培养条件:昼温25 ℃,夜温18 ℃,湿度90%~100%。每处理4次重复,每重复20株番茄幼苗,待清水对照充分发病后调查病情指数,计算诱导效果。
番茄晚疫病病情分级标准(GB/T 17980. 31-2000):0级,无病斑;1级,病斑面积占整个叶面积5%以下;3级,病斑面积占整个叶面积6%~10%;5级,病斑面积占整个叶面积11%~20%;7级,病斑面积占整个叶面积21%~50%;9级,病斑面积占整个叶面积50%以上。

1.4 4种诱抗剂对成株期番茄晚疫病的诱导抗性
分别于2010年9月和2011年10月在中国农业科学院蔬菜花卉所试验温室对番茄进行诱导抗病性研究。在2010年9月中旬和2011年10月上旬番茄主茎7~9叶期,将不同浓度的4种诱抗剂均匀喷施于番茄植株上,施药量为每小区1 L,间隔5 d诱导1次,连续诱导3次,对照杀菌剂50%烯酰吗啉WP稀释1 000倍液,施药时间和次数同4种诱抗剂,另设不施药清水对照,每处理4次重复,每重复1个小区,每小区20株番茄苗,待对照发病后调查病情指数,计算诱导抗病效果,调查分级标准及病情指数计算方法同1.3。
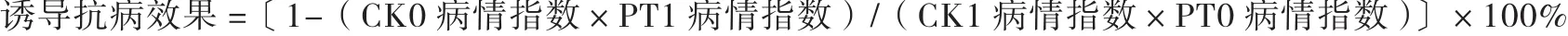
式中:CK0为空白对照区诱导前病情指数;CK1为空白对照区诱导后病情指数;PT0为药剂处理区诱导前病情指数;PT1为药剂处理区诱导后病情指数。
1.5 数据处理
利用SAS 9.0软件Duncan’s 新复极差法比较数据之间的差异显著性。
2 结果与分析
2.1 4种诱抗剂对番茄晚疫病菌的抑菌活性
4种诱抗剂对番茄晚疫病菌的抑菌活性测定结果表明(表1),不同浓度1%苯并噻二唑EW、2%香菇多糖AS、2%几丁聚糖AS和3%氨基寡糖素AS与对照杀菌剂50%烯酰吗啉WP相比,并无明显杀菌活性;4种诱抗剂的抑菌活性普遍低于30%,而对照杀菌剂抑菌活性为100%,证明这4种诱抗剂均无明显的杀菌活性。
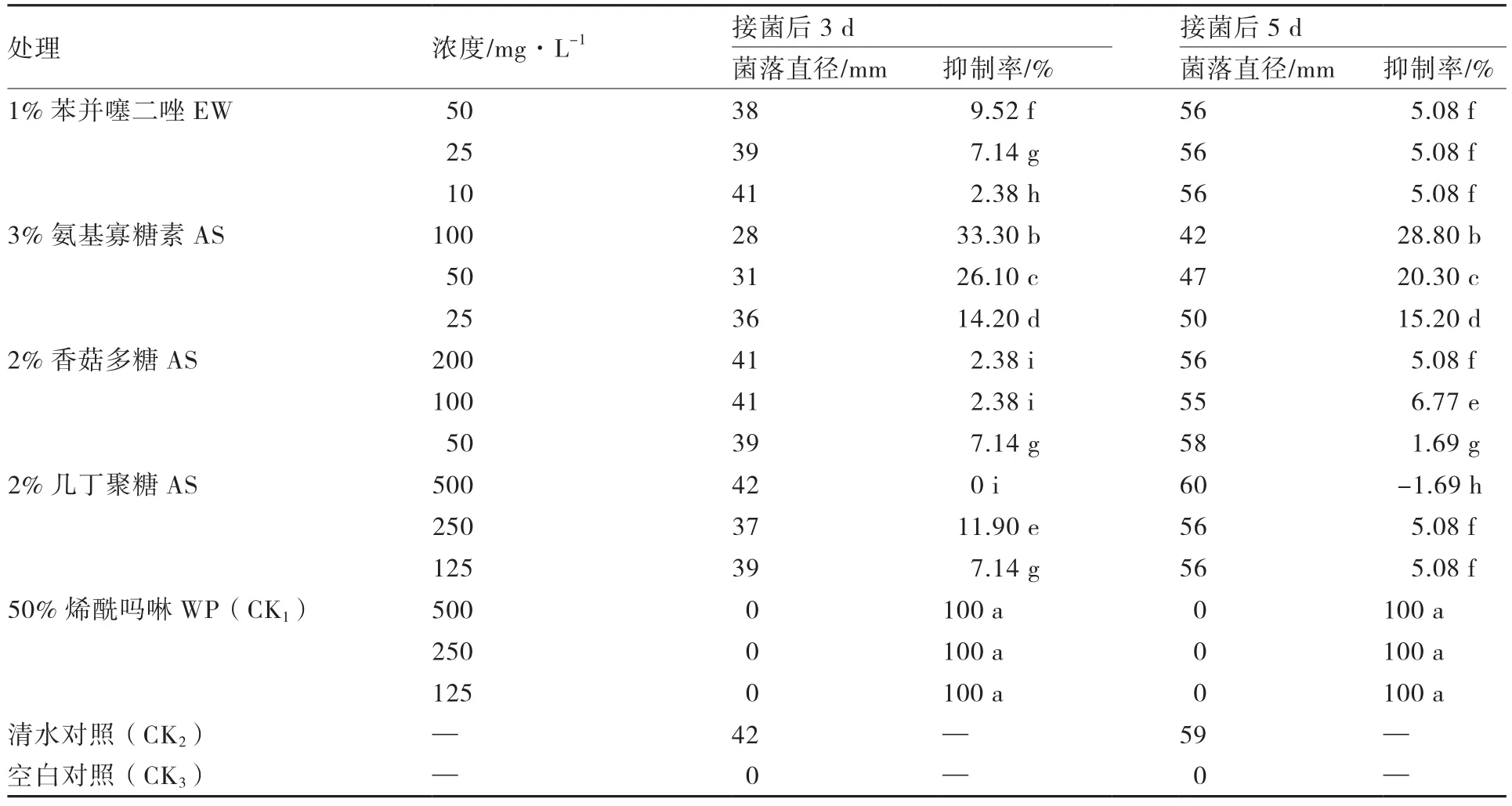
表1 4种诱抗剂对致病疫霉菌菌丝生长的抑制效果
2.2 4种诱抗剂对苗期番茄晚疫病的诱导抗性效果
通过苗期盆栽试验发现(表2),叶面喷施4种诱抗剂后,番茄对晚疫病均产生了很好的抗性,不同浓度产生的诱导抗性效果不同,平均效果均在60%以上,对照杀菌剂50%烯酰吗啉WP在处理前期防治效果为94.12%,在处理后28 d防治效果有所下降;3%氨基寡糖素AS和2%几丁聚糖AS诱导效果较好,不同浓度处理效果均达到了80%以上,其中100 mg·L-1的3%氨基寡糖素AS在处理后21 d和28 d的诱导效果分别为84.13%和88.42%,500 mg·L-1的2%几丁聚糖AS在处理后21 d和28 d的诱导效果分别为88.85%和90.06%,持效性好于对照杀菌剂50%烯酰吗啉WP(85.49%)。
2.3 4种诱抗剂对成株期番茄晚疫病的诱导抗性效果
通过田间温室试验发现,不同浓度的4种诱抗剂对田间番茄晚疫病起到了很好的诱导抗性效果(表3),大部分诱导抗病效果高于对照50%烯酰吗啉WP。2010年试验中50 mg·L-1的1%苯并噻二唑EW的诱导抗病效果最佳,为94.71%,100 mg·L-1和50 mg·L-1的3% 氨基寡糖素 AS、500 mg·L-1的2%几丁聚糖AS的诱抗效果也均超过了90%;2011年试验中100 mg·L-1的3%氨基寡糖素AS的诱导抗病效果最佳,为95.89%,50 mg·L-1的1%苯并噻二唑EW和500 mg·L-1的2%几丁聚糖AS的诱导抗病效果也超过了90%。
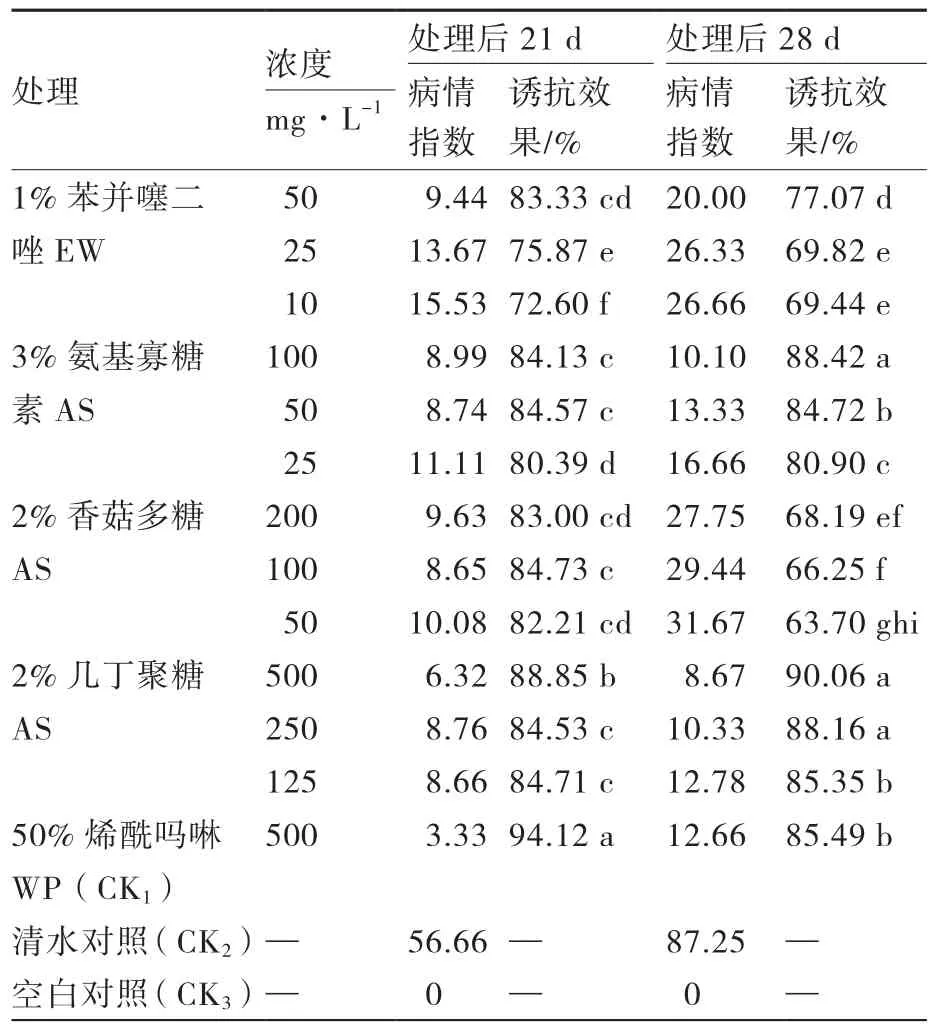
表2 4种诱抗剂对苗期番茄晚疫病诱导抗性效果
3 结论与讨论
本试验以番茄晚疫病为试验对象,研究4种诱抗剂对番茄晚疫病的诱导抗病性表达,通过抑菌活性测定证实4种诱抗剂对番茄晚疫病菌的菌丝生长没有明显的抑制作用,抑菌效果均在30%以下,证明这4种诱抗剂无明显的抑菌活性;盆栽和田间试验结果表明,4种诱抗剂对番茄晚疫病的防病效果为诱导抗病性,盆栽试验结果表明不同浓度的4种诱抗剂对苗期番茄晚疫病的诱导抗病效果均超过了60%,田间试验结果表明4种诱抗剂对成株期番茄晚疫病诱导抗病效果均超过了70%(除12.5 mg·L-1的2%几丁聚糖AS处理外)。且和对照杀菌剂50%烯酰吗啉WP相比持效性更好。
在蔬菜生产中,通常采用喷施化学农药的方法来控制病害的发生,但化学杀菌剂多施用于病害发生以后,具有不可控性,容易造成大面积减产,且长期大量的使用化学农药,尤其单一的使用某种杀菌剂,易导致病原菌产生抗药性、农产品中药剂残留和环境污染等一系列的问题,严重制约了农业的可持续发展。近年来,利用诱抗剂诱导果蔬产生抗病性逐渐成为作物病害防治的发展方向,目前有应用潜力的诱抗剂有很多,包括寡糖类生物农药、苯并噻二唑、水杨酸等,这些诱抗剂本身没有杀菌活性,但能激活植物体内防御机制,诱导植物抗病信号转导和相关抗病基因的表达,从而起到抗病的作用,诱导抗病技术在园艺作物病害防治领域起着越来越重要重要的作用。

表3 4种诱抗剂对成株期番茄晚疫病诱导抗性效果
目前国外报道苯并噻二唑 可用来诱导番茄抗花叶病毒病(Tobac co mosaic virus)、甘蓝抗霜霉病(Peronospora parasitica)、豌豆抗锈病(Uromyces pisi)、花椰菜抗霜霉病(Peronospora parasitica)等(Anfoka,2000;Barilli et al.,2012),其中叶面喷施苯并噻二唑后霜霉病对甘蓝的侵染由95%减少到15%,种子处理后对甘蓝的侵染由99%减少到73%;5~75 mg·L-1苯并噻二唑处理的花椰菜种子对霜霉病的抗性效果均超过了69%(Godard,1999),在番木瓜上也可引起植株的系统抗性(Zhu et al.,2003)。叶面喷施几丁聚糖对水稻纹枯病菌(Thanatephorus cucumeris)的诱导抗性效果均超过了60%(Liu et al.,2012),还能引起作物对镰刀菌属(Fusarium)和茄匍柄霉(Stemphylium solani)的诱导抗病性(Li et al.,2012),在烟草上可用来防治烟草黑胫病(Phytophtora parasiticavar.nicotianae)(Falcón-Rodríguez et al.,2011),也有报道称几丁聚糖和硼酸复配为可湿性粉剂对茄病镰刀菌(Fusarium solani)具有直接的杀菌作用(Saita et al.,2012);苯并噻二唑对厚皮甜瓜的黑斑病(Alternaria alternata)、番茄和辣椒的细菌性斑点病(Xanthomonas campstrispv.Vesicatoria)、葡萄灰霉病(Botrytis cinerea)、黄瓜蔓枯病(Didymella bryoniae)等多种果蔬病害均具有诱导抗性效果(Godard et al.,1999;Bokshi et al.,2003;Iriti&Faoro,2003),其中对霜霉病诱抗效果明显,如10~70 mg·L-1的苯并噻二唑叶面处理黄瓜植株对霜霉病的诱导抗病效果均超过63%(王莉 等,2005;蔡洪生 等,2007)。本试验选用的4种诱抗剂国内均有登记,但防治对象各不相同,国内登记的氨基寡糖素AS有0.5%、2%、3%和5%,防治对象为番茄晚疫病(P. infestans)、西瓜枯萎病(Mycosphaerella melonis)、白菜软腐病(Erwinia carotovorasubsp.carotovora)、烟草病毒病(TMV)、番茄病毒病(TMV)等;而2%几丁聚糖AS防治对象则主要为番茄晚疫病(P. infestans)、番茄病毒病(TMV)、黄瓜白粉病(Podosphaera fusca)、黄瓜霜霉病(Pseudoperonospora cubensis);香菇多糖AS已登记有0.5%、1%和2%,防治对象为烟草花叶病毒病(TMV)、番茄病毒病(TMV)、辣椒病毒病(Capsicum mottle virus)等病毒性病害(http://www.chinapesticide.gov. cn)。
番茄晚疫病是保护地番茄生产的毁灭性病害,近几年在田间生产上常造成大面积减产,在晚疫病发生前或者发生初期使用诱导抗病剂,具有很好的预防作用,可以有效的减少田间损失,在未来园艺作物病害防治中,诱导抗病技术有着广阔的应用前景。在田间实际应用中,由于诱抗剂需提前施药预防病害的发生,对病害发生后防治有一定的难度,因此几种诱抗剂在发病前的最佳施药间隔期和施药次数还有待进一步研究,以便达到对番茄晚疫病最经济有效的预防和防治。
蔡洪生,王晨芳,马青,冯东昕,高保利.2007.BTH和K2HPO4诱导黄瓜抗霜霉病研究.西北农业学报,16(1):95-97.
沈国强,胡妙丹,陈美娜,丁旭锋.2006.50%福帅得悬浮剂防治番茄晚疫病的研究.安徽农业科学,(1):98.
石延霞,李宝聚,薛敏菊.2007.番茄晚疫病症状诊断、流行规律及防治.中国蔬菜,(2):57-58.
王莉,黄丽丽,康振生,高小宁.2005.BTH诱导黄瓜对霜霉病的抗性.植物病理学报,35 (3):274-277.
Anfoka G H.2000.Benzo-(1,2,3)-thiadiazole-7-carbothioic acid S-methyl ester induces systemic resistance in tomato(Lycopersicon esculentum. Mill cv. Vollendung) toCucumber mosaic virus.Crop Protection,19(6):401-405.
Barilli E,Rubiales D,Castillejo M A.2012.Comparative proteomic analysis of BTH and BABA-induced resistance in pea (Pisumsativum) toward infection with pea rust (Uromyces pisi).Journal of Proteomics,75(17):5189-5205.
Bokshi A I,Morris S C,Deverall B J.2003.Effects of benzothiadiazole and acetylsalicylic acid on β-1,3-glucanase activity and disease resistance in potato.Plant Pathology,52(1):22-27.
Falcόn-Rodríguez A B,Costales D,Cabrera J C,Martínez-Téllez M Á.2011.Chitosan physico-chemical properties modulate defense responses and resistance in tobacco plants against the oomycetePhytophthora nicotianae.Pesticide Biochemistry and Physiology,100(3):221-228.
Godard J-F,Ziadi S,Monot C,Corre D L,Silué D.1999.Benzothiadiazole(BTH)induces resistance in cauliflower(Brassica oleraceavarbotrytis) to downy mildew of crucifers caused byPeronospora pa rasitica.Crop Protection,18 (6):397-405.
Iriti M,Faoro F.2003.Benzothiadiazole (BTH) induces cell-death independent resistance inPhaseolus vulgarisagainstUromyces appendiculatus.Journal of General Plant Pathology,151(3):171-180.
Li K C,Xing R,Liu S,Qin Y K,Meng X T,Li P C.2012.Microwave-assisted degradation of chitosan for a possible use ininhibiting crop pathogenic fungi.In ternational Journal of Biological Macromolecules,51(5):767-773.
Liu H,Tian W X,Li B,Wu G X,Ibrahim M,Tao Z Y,Wang Y L,Xie G L,Li H Y,Sun G C.2012.Antifungal effect and mechanism of chitosan against the rice sheath blight pathogen,Rhizoctonia solani.Biotechnol Lett,34(12):2291-2298.
Saita K,Nagaoka S,Shirosaki T,Horikawa M,Matsuda S,Ihara H.2012.Preparation and characterization of dispersible chitosan particles with borate crosslinking and their antimicrobial and antifungal activity.Carbohydrate Research,349:52-58.
Zhu Y J,Qiu X H,Moore P H,Borth W,Hu J,Ferreira S,Albert H H.2003.Systemic acquired resistance induced by BTH in papaya.Physiological an d Molecular Plant Pathology,63(5):237-248.
