酶活性、丙二醛含量变化与苦瓜抗枯萎病的关系
2013-08-29赵秀娟程蛟文李卫鹏胡开林
赵秀娟 ,唐 鑫 ,程蛟文 ,李卫鹏 ,谭 澍,胡开林
(1 广东科贸职业学院,广东 广州 510430;2 华南农业大学 园艺学院,广东 广州 510642)
苦瓜枯萎病是由尖镰孢菌苦瓜专化型(Fusarium oxysporum f.sp.momordicae Sun&Huang)侵染而引起的土传病害[1],是苦瓜生产中遇到的最严重病害之一,在我国各苦瓜种植区均有发生,其发病率一般为15%~25%,病重时高达60%~80%,严重影响苦瓜的产量和品质[2].
许多学者对病原菌侵染植株后寄主表现的抗病机理进行了研究.例如在瓜类抗枯萎病机理研究中,有学者认为某些抗病品种之所以抗病是因为其本身在组织结构和(或)生理生化和(或)遗传等方面存在抗病因子——指“即存抗性”[3],如:抗病品种通常具有抑制病菌孢子萌发的凝集素,细胞壁含有较多的木质素[4];西瓜子叶中的硬脂酸[5]、根系的SOD活性[6]、幼苗体内的抗坏血酸氧化酶活性及根系中的乙酸和柠檬酸含量[7],黄瓜的过氧化酶活性[8]等.尽管在瓜类枯萎病抗性生理生化方面的研究存在一些不同的结论[9],但有些指标已运用于瓜类抗性品种的筛选、鉴定与育种工作中[8,10-11].迄今为止,对苦瓜枯萎病抗性的生理生化相关研究鲜见报道.
本试验以苦瓜高抗枯萎病的自交系‘0417'和高感自交系‘472113'为材料,通过苗期人工接种苦瓜枯萎病菌,探讨苦瓜幼苗植株体内一系列防御酶如苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、几丁质酶(CHT)和β-1,3 葡聚糖酶(GUN)的活性及丙二醛(MDA)含量的变化与抗病性的关系,试图通过这几种酶的活性与材料抗病性的关系,为苦瓜枯萎病机理的研究提供一些参考依据.
1 材料与方法
1.1 材料
苦瓜‘0417'是斯里兰卡野生种经6 代自交纯化获得的抗病自交系,苦瓜‘472113'是广州本地的大顶苦瓜经8 代自交纯化获得的感病自交系,由华南农业大学园艺学院蔬菜系提供.苦瓜枯萎病菌由广东省农业科学院植物保护研究所提供,接种菌液的孢子密度为4×106mL-1.
1.2 方法
1.2.1 育苗、接种与培养 供试苦瓜种子经质量分数为0.1%的高锰酸钾溶液处理30 min,30℃条件下浸种10 h 后,在28℃恒温箱中催芽,然后播于灭过菌的培养土中.置于华南农业大学测试中心的人工气候室进行育苗[θ=(28±1)℃,相对湿度(RH)=90%,每天光照12 h (4 000 lx)].
当幼苗长至3~4 片真叶时拔出,洗净根部泥土,将每5 株幼苗放入霍格兰营养液100 mL/瓶(加入苦瓜枯萎病菌,调至孢子密度为4×106mL-1)中培养,对照为不加入枯萎病菌孢子的霍格兰营养液.3 次重复,分接种与不接种2 个处理,每处理80 株.
幼苗接种后仍然置于人工气候室中进行培养,接种后48 h 内黑暗培养,RH 100%,温度(28±1)℃;48 h后与育苗条件相同.
1.2.2 取材与酶液制备 分别于接种前(0 d)、接种后每隔24 h 取样,连续7 次.分别取苦瓜幼苗的叶片和茎基部(根部以上至第1 真叶以下)用于生理指标的测定.每个处理随机取10 株,设3 次重复.将样品称质量后(约0.6 g)放入-80℃冰箱中保存待用.
PPO、POD、SOD、CAT、MDA、CHT 和GUN 酶液的制备:分别取各处理材料按照质量体积比(g/mL)1∶9 的比例加入5.4 mL 0.1 mol/L 的磷酸缓冲液(PBS)(pH=7.0),研磨,4℃条件下8 000 r/min 离心20 min,取上清液即为待测酶液.
PAL 酶液的制备:分别取各处理材料按照质量体积比(g/mL)1∶9 的比例加入5.4 mL 0.1 mol/L 的硼酸缓冲液(pH=8.8,含5 mmol/L 巯基乙醇、1 mmol/L EDTA),研磨,4℃条件下8 000 r/min 离心20 min,取上清液待测.
1.2.3 酶活性和MDA 含量测定 POD、SOD、CAT活性和MDA 含量的测定使用南京建成生物工程研究所的试剂盒.POD 以每毫克鲜质量每分钟催化产生1 μg 底物的酶量为1 个酶活力单位(U),CAT 以每毫克鲜质量每秒钟分解1 μmol H2O2的量为1 个酶活力单位(U),SOD 以每克鲜质量在1 mL 反应液中SOD 抑制率达50%时所对应的SOD 量为1 个酶活力单位(U).
PPO、PAL、CHT 和GUN 的测定使用上海博耀生物科技有限公司的酶联免疫分析(ELISA)试剂盒.用酶标仪在450 nm 波长下测定光密度(D450nm),通过标准曲线计算样品中PPO、PAL 和GUN 的活性.以每分钟光密度变化0.01 所需酶量为1 个酶活力单位(U).
2 结果与分析
2.1 PPO 活性与抗性的关系
接种后抗、感自交系的茎基部PPO 活性均呈明显升高的趋势,其中抗病自交系的PPO 活性无论是升高速度还是峰值均高于感病自交系和对照,尤其是接种后第2 天,抗病自交系PPO 活性增加显著,分别比对照和感病自交系增加124.2%和77.1%[F=8 269.66,P=0(P<0.01)],差异达到极显著水平;抗、感自交系的PPO 活性均在接种后第6 天达到峰值(图1a).
从图1b 可看出,接种后的抗病自交系其叶片PPO 活性比感病自交系增加显著,尤其是第4 天增加幅度最大且达到最高值,比未接种对照增加202.9%,比感病自交系增加167.4%[F=6 274.40,P=0(P<0.01)],差异达到极显著水平.感病自交系第6 天上升幅度较大且达到峰值,此时比未接种对照增加92.3%.

图1 接种苦瓜枯萎病菌后茎基部和叶片PPO 活性变化Fig.1 The variation of PPO activity of the bitter gourd stem base and leaves after inoculation with Fusarium oxysporum
2.2 POD 活性与抗性的关系
接种后的抗病自交系茎基部POD 活性于第3 天达到峰值,比未接种对照高8.8%,比感病自交系高6.6%[F=22.105,P=0.009(P<0.01)],差异达到极显著水平;感病自交系酶活性在第4 天达到峰值,比未接种对照高6.8%(图2a).图2b 显示,接种后的抗、感自交系其叶片POD 酶活性峰值分别出现在第1、第3 天,比其未接种对照分别高16.3%、6.2%;抗病自交系POD 酶活性于第1 天比感病自交系高14.6% [F=744.42,P=0(P<0.01)],差异极显著.抗、感病自交系茎基部的酶活性升高幅度比叶片大,但叶片POD 活性峰值出现的时间比茎基部早.
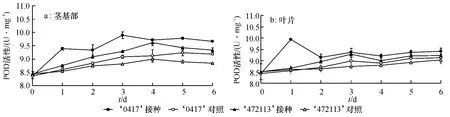
图2 接种苦瓜枯萎病菌后茎基部和叶片POD 活性变化Fig.2 The variation of POD activity of the bitter gourd stem base and leaves after inoculation with Fusarium oxysporum
2.3 SOD 活性与抗性的关系
接种后的抗病自交系茎基部SOD 活性于第5 天达到峰值,比未接种对照增加13.1%,比感病自交系增加17.3% [F=247.02,P=0(P<0.01)],差异极显著;感病自交系在第1~4 天上升快,第4 天达到最高值,比未接种对照高出16.2%(图3a).而抗病自交系其叶片SOD 酶活性高峰出现在第2 天,比未接种对照高10.1%,比感病自交系高8.8%[F=303.38,P=0(P<0.01)],差异达到极显著水平;感病自交系酶活性高峰出现在第3 天,比未接种对照高6.2%(图3b).从SOD 活性变化看,茎基部的酶活性变化幅度比叶片大,但叶片酶活性峰值出现的时间比茎基部早.

图3 接种苦瓜枯萎病菌后茎基部和叶片SOD 活性变化Fig.3 The variation of SOD activity of the bitter gourd stem base and leaves after inoculation with Fusarium oxysporum
2.4 PAL 活性与抗性的关系
从整体水平看,接种后的抗病自交系其茎基部PAL 活性高于感病自交系,于第3、4 、5 天分别比感病自交系高22.8%、19.4%、16.5%,并于第6 天达到峰值,比其未接种对照增加33.3%,比感病自交系高29.5%[F=129.45,P=0(P<0.01)],差异达到极显著水平(图4a).
接种枯萎病菌后,抗、感自交系叶片PAL 活性升高幅度较大.抗病自交系于第3 天达到峰值,比未接种对照增加15.2%,比感病自交系增加17.8% [F=506.45,P=0(P<0.01)],差异达到极显著水平;感病自交系在第4 天达到高峰,比对照增加18.0%(图4b).抗、感病自交系其叶片PAL 活性峰值出现的时间比茎基部早.

图4 接种苦瓜枯萎病菌后茎基部和叶片PAL 活性变化Fig.4 The variation of PAL activity of the bitter gourd stem base and leaves after inoculation with Fusarium oxysporum
2.5 CAT 活性与抗性的关系
接种后,抗、感自交系茎基部CAT 活性均在第4天达到最高,分别比其对照增加23.9%、18.9%,但抗病自交系比感病自交系仅高出7.0%[F=2.96,P=0.16(P>0.05)],差异不显著(图5a).从图5b可看出,接种后的抗、感自交系其叶片CAT 活性均于第3 天达到峰值,在第4 、6 天抗病自交系分别比感病自交系高17.5%[F=16.72,P=0.015(0.01<P<0.05)]和20.9%[F=10.40,P=0.032(0.01<P<0.05)],差异达显著水平.叶片的CAT 活性变化幅度比茎基部大,但抗、感病自交系的叶片CAT 活性峰值出现的时间比茎基部早.
2.6 MDA 含量与抗性的关系
接种后,抗、感自交系茎基部MDA 含量迅速上升,分别于第6 、4 天达到峰值,比其未接种对照增加128.6%、109.1%;感病自交系的MDA 含量高于抗病自交系,并于第4 天比抗病自交系高76.9%[F=60.0,P=0.001(P<0.01)],差异达极显著水平(图6a).而感病自交系叶片MDA 含量于第3、5 天分别比抗病自交系高出53.8%、47.1%,它们均于第6 天达到峰值,感病自交系比其未接种对照增加81.8%,比抗病自交系高145.5%[F=147.0,P=0(P<0.01)],差异也达极显著水平(图6b).

图5 接种苦瓜枯萎病菌后茎基部和叶片CAT 活性变化Fig.5 The variation of CAT activity of the bitter gourd stem base and leaves after inoculation with Fusarium oxysporum
总之,MDA 含量与苦瓜抗病性呈负相关.但感病自交系其茎基部MDA 含量的峰值出现时间比抗病自交系早,叶片变化幅度大于茎基部.
2.7 CHT 活性与抗性的关系
接种后的抗病自交系其茎基部CHT 活性于第6天达到峰值,比未接种对照增加56.1%,比感病自交系增加37.6%[F=25.29,P=0.007(P<0.01)],差异达极显著水平;感病自交系也于第6 天酶活性达峰值,比未接种对照增加29.3%(图7a).抗病自交系其叶片CHT 活性于第5 天达到峰值,比未接种对照增加49.3%,比感病自交系增加31.5%[F=37.36,P=0.004(P<0.01)],差异达极显著水平;感病自交系酶活性在第6 天达最大值,比未接种对照增加24.8%(图7b).叶片的CHT 活性变化幅度比茎基部小,但抗、感病自交系其叶片CHT 活性峰值出现的时间比茎基部早.

图6 接种苦瓜枯萎病菌后茎基部和叶片MDA 含量变化Fig.6 The variation of MDA content of the bitter gourd stem base and leaves after inoculation with Fusarium oxysporum

图7 接种苦瓜枯萎病菌后茎基部和叶片CHT 活性变化Fig.7 The variation of CHT activity of the bitter gourd stem base and leaves after inoculation with Fusarium oxysporum
2.8 GUN 活性与抗性的关系
接种后的抗病自交系于第6 天GUN 活性达到峰值,但第4 天升高幅度明显,比未接种对照高41.5%,比感病自交系高出28.2%[F=344.03,P=0(P<0.01)],差异达到极显著水平;感病自交系也于第6 天酶活性达到峰值,比未接种对照高30.1%(图8a).而抗病自交系其叶片GUN 活性升高幅度大,于第4 天酶活性达到峰值,比未接种对照增加55.3%,比感病自交系增加52.8%[F=2 982.87,P=0(P<0.01)],差异达极显著水平;感病自交系叶片GUN 活性于第6 天升高幅度大而达到峰值,比未接种对照增加28.0%(图8b).总之,抗、感自交系其茎基部和叶片均于第4 天GUN活性差异达到极显著水平,叶片的酶活性变化幅度比茎基部大,叶片GUN 活性峰值出现的时间比茎基部早.

图8 接种苦瓜枯萎病菌后茎基部和叶片GUN 活性变化Fig.8 The variation of GUN activity of the bitter gourd stem base and leaves after inoculation with Fusarium oxysporum
3 讨论与结论
综合本研究结果,苦瓜幼苗接种枯萎病菌后,除MDA 含量与抗病性呈负相关外,其余7 种酶活性与抗病性呈正相关.无论茎基部还是叶片的PPO、PAL、POD、SOD、CHT 和GUN 活性,抗病自交系都极显著高于感病自交系,表现出一致性;此外,从叶片的CAT 活性来看,抗病自交系也显著高于感病自交系.鉴于此,初步认为可用PPO、PAL、CAT、CHT、GUN、POD、SOD 活性和MDA 含量的峰值大小作为鉴定苦瓜品种或植株枯萎病抗性的生理指标.其中,首选PPO 活性,其次是CHT、GUN 活性和MDA 含量,因为它们的变化与苦瓜枯萎病抗性关系较为密切.
3.1 PPO、POD、SOD 活性与抗病性的关系
在抗病机制的研究中,大多数学者认为PPO 的含量与抗病性成正比.普遍认为植物感染病原菌后,POD 活性显著增强,感染后植株体内的POD 活性变化趋势呈一上升的单峰曲线,也有曲线中存在2 个酶峰的[10-12];但有相反结论,认为植株感病后POD活性上升,但感病品种活性明显高于抗病品种[13].多数研究认为,SOD 活性与抗病性存在正相关.本试验表明,苦瓜接种枯萎病菌后,抗、感自交系的PPO、POD、SOD 活性均有升高的趋势,但抗病自交系比感病自交系升高幅度更大且峰值出现时间更早,抗、感自交系酶活性差异达到极显著水平.茎基部的酶活性变化幅度大于叶片,符合枯萎病菌从根部侵染后就在根、茎基部产生感染的变化趋势,也反映出根、茎维管束感染也影响到叶片的生理生化变化.
3.2 PAL 活性与抗病性的关系
一般由亲和性互作引起的感病反应中PAL 活性降低,非亲和性互作引起的抗病反应中PAL 活性升高,PAL 活性与抗病性呈正相关,许多研究证明了这一点[11,14].本研究表明,苦瓜幼苗接种枯萎病菌后,抗病自交系PAL 高于感病自交系,抗、感自交系PAL活性差异极显著.抗、感病自交系叶片PAL 活性峰值出现的时间比茎基部早,其原因有待进一步研究.
3.3 CAT 活性和MDA 含量与抗病性的关系
前人的大量研究表明,CAT 活性越强则植物的抗病性也越强,而MDA 含量与抗病性呈负相关[15-16].本结果表明,苦瓜幼苗接种枯萎菌后,抗病自交系CAT 活性高于感病自交系,这可能与其发挥防御伤害能力增强有关.抗、感病自交系的叶片CAT活性峰值出现的时间比茎基部早;但叶片的酶活性变化幅度比茎基部大,这与王玲平[16]的研究报道不一致.而感病自交系MDA 含量始终高于抗病自交系,即MDA 含量与苦瓜抗性呈负相关;叶片MDA 含量变化幅度大于茎基部,这与王玲平[16]的研究报道也不一致.
3.4 CHT 和GUN 活性与抗病性的关系
CHT 和GUN 在离体条件下可联合抑制病原菌,它们的转基因植物对病原菌的抗性比未经转基因的野生种强[17-18],证实了CHT 和GUN 在植物抗病中的重要作用.苦瓜在接种枯萎菌后,抗、感病自交系CHT 和GUN 活性均上升,可认为是对病菌侵染的一种防卫反应,加强对枯萎菌侵染的抑制作用.同时,抗病自交系叶片CHT、GUN 活性升高比感病自交系早且快,也反映出抗病自交系在受到病原菌的侵入后引起的防御反应比感病自交系快,从而抑制病原菌的进一步入侵.
[1]朱天圣,戚佩坤.苦瓜枯萎病病原菌研究[J].华南农业大学学报,1998,19(4):14-18.
[2]唐锷.苦瓜枯萎病的发生及综合防治措施[J].科学种养,2009(6):30.
[3]谢大森,何晓明,彭庆务,等.瓜类枯萎病发生机理研究进展[J].仲恺农业技术学院学报,2006,19(3):65-70.
[4]徐建华,王建波,利容千.黄瓜感染枯萎病后病理组织学的研究[J].植物病理学报,1997,27(4):349-352.
[5]王浩波,王鸣.西瓜品种脂肪酸组分与抗枯萎病关系研究[J].北方园艺,1994(3):35-36.
[6]马国斌,林德佩,王叶筠,等.西瓜枯萎病菌镰刀菌酸对西瓜苗作用机制的初步探讨[J].植物病理学报,2000,30(4):373-374.
[7]张显,王鸣.西瓜枯萎病抗性及其与体内一些生化物质含量的关系[J].西北农业学报,2001,10(4):34-36.
[8]许启新,余纪柱.黄瓜苗期过氧化物酶活性的变化规律及其与抗枯萎病的关系[J].上海农业学报,1994,10(3):58-62.
[9]云兴福.黄瓜组织中氨基酸、糖和叶绿素含量与其对霜霉病抗菌素性的关系[J].华北农学报,1993,8(4):52-58.
[10]徐建华,利容千,王建波.黄瓜不同抗病品种感染镰刀菌枯萎病菌后几种酶活性的变化[J].植物病理学报,1995,5(3):239-242.
[11]邹芳斌,司龙亭,李新,等.黄瓜枯萎病抗性与防御系统几种酶活性关系的研究[J].华北农学报,2008,23(3):181-184.
[12]阎文昭,裘维蕃.TMV 侵染不同抗性番茄品种后引起的过氧化物酶活性及同工酶的变化[J].植物病理学报,1985,15(4):193-198.
[13]李妙,王校栓,李延增,等.不同抗枯萎病类型棉花品种超氧物歧化酶和过氧化物酶活性研究[J].华北农学报,1993,8(增刊):119-122
[14]马艳玲,吴凤芝.枯萎病菌对不同抗性黄瓜品种苯丙氨酸解氨酶的影响[J].沈阳农业大学学报,2006,37(3):335-338.
[15]姚怀莲,羊杏平,曹碚生.西瓜枯萎病抗性遗传及生理生化基础研究[D].扬州:扬州大学,2007.
[16]王玲平.黄瓜感染枯萎病菌后生理生化变化与抗病性关系的研究[D].太谷:山西农业大学,2001.
[17]MAUCH F,MAUCH-MANI B,BOLLER T.Anti-fungal hydrolases in pea tissue:II.Inhbition of fungal growth by combination of chitinase and 1,3-glucanase [J].Plant Physiol,1988(88):936-942.
[18]BROGLIE K,CHET I,HOLLIDAY M,et al.Transgenic plant with enhanced resistance to the fungal pathogen Rhizoctonia solani[J].Science,1991(254):1194-1197.
