维拉帕米对肝星状细胞凋亡和Bax表达的影响*
2013-08-29任美萍刘明华李蓉李万平
任美萍 刘明华 李蓉 李万平△
1.泸州医学院药物与功能性食品研究中心,四川 泸州 646000;2.泸州医学院药理学教研室,四川 泸州 646000)
肝纤维化是所有慢性肝病进展成肝硬化的共同病理基础与必经阶段。肝纤维化的主要特征是肝星状细胞(Hepatic stellate cells,HSCs)的增殖及细胞外基质(Extracellular matrix,ECM)的过度沉积[1]。而HSCs又是产生ECM 最重要的细胞,肝脏遇到致病因子侵袭时,静息的HSCs被激活分化为肌成纤维样HSCs,分泌胶原和多种细胞因子,引起肝ECM 合成增加,降解减少,造成肝内ECM 不断积聚,最后导致肝纤维化甚至肝硬化[2-3]。抑制HSCs的增殖和诱导其凋亡是治疗慢性肝损伤和肝纤维化的重要策略。有研究显示维拉帕米和丹参或尼群地平联合使用,可预防CCl4/乙醇对大鼠肝功能的损伤,降低肝纤维化程度[4-5],但维拉帕米对体外培养的HSCs的作用报道甚少。本研究初步观察了维拉帕米对体外培养的HSCs增殖、凋亡以及凋亡相关蛋白Bax表达的影响。
1 材料与方法
1.1 材料
1.1.1 细胞株
肝星状细胞株HSCs引自泸州医学院附属医院传染与免疫实验室,采用含10%胎牛血清的DMEM 高糖培养基pH 7.2~7.4的完全培养基,在37℃、5%CO2条件下常规培养。
1.1.2 药品与试剂
盐酸维拉帕米片:规格:每片40mg,天津市中央药业有限公司,批号: 090101;DMEM 高糖培养基:赛默飞世尔生物化学制品(北京)有限公司,批号:NUB0146;胰蛋白酶:美国Sigma公司;胎牛血清:天津灏洋生物制品科技责任有限公司;CCK-8(Cell Counting Kit-8)试剂盒:碧云天生物技术研究所;4%多聚甲醛固定液:博士德生物工程有限公司,批号:20 081106;AnnexinV-FITC 试剂 盒:Beckman coulter公 司;SABC 试剂 盒 和DAB显色剂由武汉博士德公司提供;苏木精染液、伊红染液、二甲苯等由泸州医学院附属医院病理科提供。
1.1.3 仪器
酶标分析仪:北京普朗新技术有限公司,型号:DNM-9602;流式细胞仪:BECKMAN COULTER 公司;倒置相差显微镜:日本Olympus公司,型号:CKX41;CO2培养箱:日本Sanyo公司,型号:MCO-15A。
1.2 方法
1.2.1 CCK-8检测维拉帕米对肝星状细胞增殖的抑制作用
取对数生长期的HSCs细胞,调整为适当浓度后接种于96孔培养板,每孔90μL,37℃、5%CO2培养箱常规培养24h贴壁后加药。维拉帕米采用DMEM 培养基稀释至所需浓度后加入96孔板,每孔10μL,使其终浓度分别为0.08、0.10、0.12、0.14、0.16mol·L-1,每个浓度均设4个复孔,阴性对照为等体积培养基。继续培养48h后每孔加入CCK8 10μL 培养1 h,酶标仪450nm 波长下检测各孔吸光度A 值,按下列公式计算抑制率,细胞增殖抑制率=[1-(A给药组-A空白孔)/(A阴性对照组-A空白孔)]×100%。LOGIT 法计算半数抑制浓度(IC50)。
1.2.2 HE染色观察细胞形态变化
取对数生长期的细胞,0.25%胰酶制成单细胞悬液,细胞浓度为1×108· L-1,每孔450μL 加入铺有盖玻片的24 孔板,培养24h待其贴壁。每孔加药50μL,维拉帕米终浓度分别为0.02、0.04、0.06、0.08、0.10mol· L-1,阴性组加等体积培养基,继续培养48h,常规HE 染色,脱水,透明,中性树胶封片,显微镜下拍照观察细胞形态、超微结构变化。
1.2.3 流式细胞仪Annexin V-FITC/PI双染法检测细胞凋亡率
将终浓度分别为0.02、0.04、0.06、0.08、0.10mol·L-1的维拉帕米作用后的HSCs细胞收集于离心管,经预冷的PBS洗涤一次后将细胞悬浮于100μL 的4℃PBS中,每管加Annexin V-FITC 5μL、PI 2.5μL,轻轻震荡混匀,置冰上避光染色10min,每管加400μL 1×Buffer,流式细胞仪检测细胞凋亡率。
1.2.4 免疫组化SABC法检测Bax表达的影响
取对数生长期的HSCs细胞制成密度为5×107· L-1的细胞悬液,每孔450μL加入预先铺有盖玻片的24孔板,37℃、5%CO2培养24h待其贴壁。每孔加药50μL,维拉帕米终浓度分别为0.02、0.04、0.06、0.08、0.10mol· L-1,阴性组加等体积培养基,继续培养48h,4%多聚甲醛固定后,采用SABC 法行免疫组化染色,中性树胶封片,晾干。显微镜下观察,每组随机采取8个视野拍照,结果用Image-Pro plus6.0图像分析软件进行分析,检测其阳性物质的平均光密度。
1.3 统计学处理
结果以均数±标准差()表示,采用SPSS13.0统计软件行单因素方差分析(组间比较用SNK 法),以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 CCK-8检测维拉帕米对肝星状细胞增殖的抑制作用
维拉帕米可抑制HSCs的增殖,随浓度的增加,抑制作用增强,其IC50值为0.15±0.01 mol· L-1。浓度-抑制率曲线,见图1。
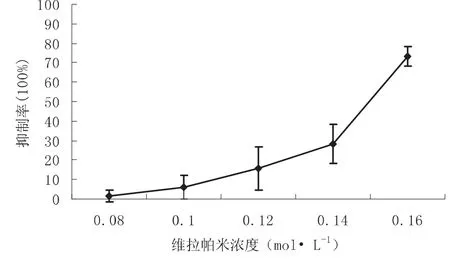
图1 维拉帕米对肝星状细胞增殖的浓度抑制率曲线(n=4)
2.2 HE染色观察细胞形态变化
HE染色可见维拉帕米组出现不同程度的细胞体积变小,胞浆减少,核固缩呈蓝黑色,细胞贴壁差等改变,而阴性对照组细胞大小均一,胞浆丰富均匀,细胞核规则,核内染色均一呈淡蓝色,贴壁良好。
2.3 流式细胞仪Annexin V-FITC/PI双染法检测细胞凋亡率
0.02 ~0.10mol·L-1的维拉帕米均可诱导HSCs细胞的凋亡,凋亡率分别为(7.41±0.95)%、(10.06±0.62)%、(13.38±0.61)%、(17.98±0.65)%、(25.11%±1.33)%,呈现出一定的剂量依赖关系,与阴性对照组比较差异有统计学意义(P<0.05),见表1。
表1 维拉帕米诱导HSCs细胞的凋亡率(,n=3)

表1 维拉帕米诱导HSCs细胞的凋亡率(,n=3)
注:与阴性对照组比较,aP<0.05。
2.4 免疫组化SABC法检测Bax表达的影响
不同浓度的维拉帕米作用48h后HSCs细胞Bax的表达不同程度增强,平均光密度值增加,与阴性对照组比较差异有统计学意义(P<0.05),见表2。
3 讨论
HSCs活化是肝纤维化形成的关键,而增殖是HSCs活化的重要特征之一。因此,抑制HSCs的增殖、诱导其凋亡是防治肝纤维化的策略之一[6]。细胞凋亡是组织细胞在正常发育过程中或在病理条件下的一种主动死亡形式,受细胞内基因的精确调控。Bax为促进细胞凋亡基因,在细胞凋亡中发挥重要的调节作用[7]。Bax可直接结合到线粒体膜上,改变膜的通透性,引起细胞色素C释放入胞浆,激活Caspases家族,最终引起凋亡[8]。
表2 维拉帕米对HSCs细胞Bax表达免疫组化染色平均光密度(,n=8)

表2 维拉帕米对HSCs细胞Bax表达免疫组化染色平均光密度(,n=8)
注:与阴性对照组比较,aP<0.05。
细胞内Ca2+是胞内重要的第二信使,在细胞的功能活动中起着重要的作用。维拉帕米是L型钙通道阻滞剂,能减少细胞外Ca2+的内流。HSCs细胞上存在L型钙通道,维拉帕米通过降低细胞内Ca2+,引起细胞内钙平衡紊乱,本实验结果显示维拉帕米可抑制 HSCs 的增殖,且呈剂量依赖性。0.02~0.10mol·L-1的维拉帕米均可诱导HSCs 细胞的凋亡,且药物浓度增加,凋亡率增加,其机制可能是增强Bax的表达而诱导凋亡。维拉帕米可抑HSCs的增殖,诱导其凋亡,有利于肝纤维化的逆转。Ca2+的变化可能是诱导HSCs凋亡的关键信号,但凋亡的发生是否也有其他信号系统的参与,维拉帕米影响Bax表达的确切机制等相关问题均有待进一步深入研究。
1 史红阳,许君望,任晓侠.木黄酮对肝星状细胞增殖及脂质过氧化的影响[J].南方医科大学学报,2008,28(11):2066-2069.
2 谌辉,刘文琪.姜黄素对日本血吸虫病小鼠肝纤维化的影响[J].中国医院药学杂志,2008,28(119):1679-1682.
3 杨悦杰,黄芬.肝星状细胞及相关细胞因子在肝纤维化形成中的作用[J].世界华人消化杂志,2007,15(27):2885-2890.
4 郭晏同,赵景明,宋磊,等.罗格列酮抑制体外大鼠肝星状细胞活化[J].基础医学与临床,2008,28(11):1129-1133.
5 王青山,李亮成.维拉帕米和尼群地平对大鼠肝硬化的实验研究[J].山西医科大学学报,2002,33(4):307-308.
6 李霞,李亮成.丹参与维拉帕米对大鼠肝纤维化?肝硬化防治作用的实验研究[J].山西医科大学学报,2003,34(1):18-21.
7 胡泰洪,黄利华,杨玲,等.NHE-1与肝星状细胞增殖的关系及姜黄色对其的影响[J].世界华人消化杂志,2009,17(18):1860-1863.
8 Paradiso A,Simone G,Lena MD,et al.Expression of apoptosis-related markers and clinical outcome in patients with advanced colorectal cancer[J].?Br J Cancer,2001,84(5):651-658.
9 Lucken-Ardjomande S,Martinou JC.Regulation of Bcl-2proteins and of the permeability of the outer mitochondrial membrane[J].C R Biol,2005,328(7):616-631.
